超高效液相色譜-串聯(lián)質(zhì)譜法同時(shí)測定蜂蜜中雷公藤紅素和雷公藤次堿
雷美康,彭 芳,祝子銅,丁 濤,徐佳文,吳曉勤
(1.衢州出入境檢驗(yàn)檢疫局技術(shù)中心,浙江 衢州 324002;2.江蘇出入境檢驗(yàn)檢疫局食品實(shí)驗(yàn)室,江蘇 南京 210001)
超高效液相色譜-串聯(lián)質(zhì)譜法同時(shí)測定蜂蜜中雷公藤紅素和雷公藤次堿
雷美康1,彭 芳1,祝子銅1,丁 濤2,徐佳文1,吳曉勤1
(1.衢州出入境檢驗(yàn)檢疫局技術(shù)中心,浙江 衢州 324002;2.江蘇出入境檢驗(yàn)檢疫局食品實(shí)驗(yàn)室,江蘇 南京 210001)
建立了一種超高效液相色譜-串聯(lián)質(zhì)譜同時(shí)檢測蜂蜜中雷公藤紅素和雷公藤次堿的快速分析方法。樣品用水溶解后,乙腈鹽析提取,采用Hypersil GOLD C18柱(50 mm×2.1 mm,1.9μm)分離,電噴霧離子源正離子多反應(yīng)監(jiān)測模式串聯(lián)質(zhì)譜進(jìn)行檢測。結(jié)果表明:雷公藤紅素和雷公藤次堿在0.01~20 ng/mL范圍內(nèi)具有較好的線性關(guān)系,相關(guān)系數(shù)均大于0.997。該方法定量限均為0.05μg/kg。在0.05μg/kg和1.0μg/kg添加量條件下,雷公藤紅素和雷公藤次堿的回收率為69.9%~101.5%,相對標(biāo)準(zhǔn)偏差均不大于10%(n=6)。本方法快速、靈敏、準(zhǔn)確,適用于蜂蜜中雷公藤相關(guān)物質(zhì)殘留的定性、定量檢測。
超高效液相色譜-串聯(lián)質(zhì)譜;蜂蜜;雷公藤紅素;雷公藤次堿
蜂蜜作為一種傳統(tǒng)的天然保健食品,主要是由蜜蜂采集植物花蜜、分泌物或蜜露,與自身分泌物混合后,經(jīng)充分釀造而成的天然甜物質(zhì)[1]。蜜蜂如果采集有毒植物的花粉,蜂蜜就可能混進(jìn)有毒物質(zhì)[2-5],國內(nèi)外關(guān)于使用有毒蜂蜜事件時(shí)有報(bào)道[6-9]。GB 14963—2011《蜂蜜》中明確規(guī)定蜜蜂采集植物的花蜜、分泌物或蜜露應(yīng)安全無毒,不得來源于雷公藤(Tripterygium wilfordiiHook.F.)等有毒蜜源植物[1]。因此,建立蜂蜜中痕量雷公藤相關(guān)物質(zhì)的快速篩查方法十分必要。
蜂蜜中雷公藤相關(guān)物質(zhì)檢測方法報(bào)道較少,閆繼紅[10]介紹了采用化學(xué)檢驗(yàn)方法定性判斷蜂蜜中是否含有雷公藤堿,此方法準(zhǔn)確性和靈敏度低,同時(shí)檢測過程中需使用三氯化銻等危險(xiǎn)化學(xué)品。郭艷紅等[11]采用高效液相色譜法檢測昆明山海棠蜜中雷公藤甲素,但溶劑消耗量大,耗時(shí)繁瑣、靈敏度低。雷公藤紅素和雷公藤次堿是雷公藤的主要毒性成分[12-16],目前國內(nèi)外同時(shí)檢測蜂蜜中雷公藤紅素和雷公藤次堿的方法尚未見報(bào)道。
本實(shí)驗(yàn)建立了超高效液相色譜-串聯(lián)質(zhì)譜同時(shí)測定蜂蜜中雷公藤紅素和雷公藤次堿的分析方法。該方法操作簡便、靈敏度高、結(jié)果準(zhǔn)確,適用于蜂蜜中雷公藤相關(guān)物質(zhì)的快速篩查和確證的檢測手段。
1 材料與方法
1.1材料、試劑與儀器
蜂蜜樣品為浙江省衢州地區(qū)出口企業(yè)提供。
雷公藤紅素(≥98%)和雷公藤次堿(≥98%)南通飛宇生物科技有限公司;甲醇、乙腈、甲酸均為色譜純,氯化鈉、無水硫酸鎂均為分析純。
Ultimate 3000超高效液相色譜-TSQ Vantage三重四極桿串聯(lián)質(zhì)譜聯(lián)用儀、MULTIFUGE XIR高速離心機(jī)美國Thermo Scientific公司;MS 3 digital漩渦混合器 德國IKA公司。
1.2方法
1.2.1標(biāo)準(zhǔn)溶液的配制
標(biāo)準(zhǔn)儲備液:稱取雷公藤紅素和雷公藤次堿標(biāo)準(zhǔn)品10 mg(精確至0.1 mg)置于100 mL棕色容量瓶中,用甲醇溶解并定容至刻度,混勻配制成100 mg/L的單標(biāo)儲備液;標(biāo)準(zhǔn)中間液:分別準(zhǔn)確移取1mL各單標(biāo)儲備液置于100 mL棕色容量瓶中,用甲醇定容至刻度,配成1.0 mg/L的混合標(biāo)準(zhǔn)中間液;標(biāo)準(zhǔn)工作液:根據(jù)需要移取適量混合標(biāo)準(zhǔn)中間液,用甲醇-水(1∶1,V/V)稀釋成0.01、0.02、0.05、0.1、0.2、0.5、1、2、5、10、20 ng/mL的標(biāo)準(zhǔn)工作溶液。各種標(biāo)準(zhǔn)溶液避光保存于4℃冰箱中。
1.2.2試樣制備
對未結(jié)晶的蜂蜜將其用力攪拌均勻,對有結(jié)晶析出的蜂蜜可將樣品瓶蓋塞緊后,置于不超過60℃的水浴中溫?zé)幔龢悠啡咳诨髷嚢瑁杆倮鋮s至室溫。在融化時(shí)必須防止水分揮發(fā)[17]。
1.2.3樣品前處理
稱取試樣5.0 g(精確至0.01 g)于50 mL具蓋離心管中,加入10 mL水溶解,加入10 mL乙腈、1 g NaCl、4 g無水硫酸鎂,搖勻,渦旋后離心(6 000×g,5 min),取上層溶液經(jīng)0.22 ?m有機(jī)相濾膜過濾后用于分析。
1.2.4色譜條件
色譜柱:Hypersil GOLD C18柱(50 mm×2.1 mm,1.9μm);柱溫:35℃;進(jìn)樣量:2μL;流速:0.25 mL/min。流動(dòng)相:A為水,B為含0.15%甲酸的甲醇溶液。梯度洗脫程序:0~2.0 min,70%A;2.0~5.0 min,70%~5%A;5.0~10.0 min,5%A;10.1~14.0 min,70%A。
1.2.5質(zhì)譜條件
掃描方式:正模式掃描;檢測方式:多反應(yīng)監(jiān)測;電噴霧電壓:+3 500 V;鞘氣:207 kPa;輔助氣:10 arb;;毛細(xì)管溫度:350℃;蒸發(fā)溫度:300℃;碰撞氣:氬氣(1.5 mTorr)。S-Lens電壓、碰撞電壓、掃描模式和保留時(shí)間等條件見表1。
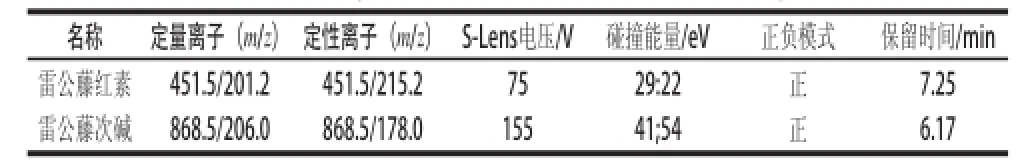
表1 雷公藤紅素和雷公藤次堿的多反應(yīng)監(jiān)測質(zhì)譜參數(shù)Table 1 Mass spectrometric parameters for the analysis of triptolide and wilforine by multiple reaction monitoring (MRM)
2 結(jié)果與分析
2.1色譜條件的優(yōu)化
分別考察甲醇-水、酸化甲醇-水等流動(dòng)相對雷公藤紅素和雷公藤次堿目標(biāo)分析物的分離效果。結(jié)果表明,以酸化甲醇-水溶液為流動(dòng)相時(shí),目標(biāo)物的分離度和峰形較好。雷公藤紅素和雷公藤次堿的多反應(yīng)監(jiān)測色譜圖如圖1所示。
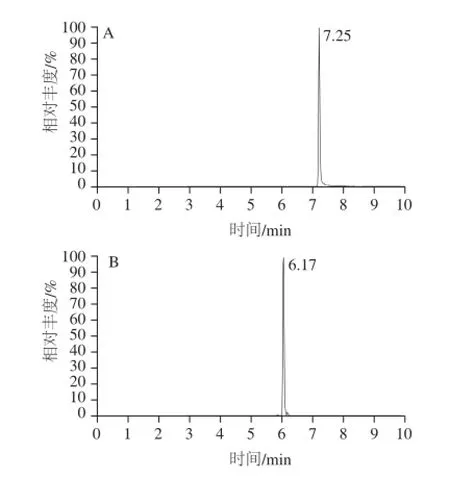
圖1 雷公藤紅素(A)和雷公藤次堿(B)標(biāo)準(zhǔn)溶液(5 μg/kg)的多反應(yīng)監(jiān)測色譜圖Fig.1 Chromatograms of standards of triptolide and wilforine (5μg/kg) in MRM mode
2.2質(zhì)譜條件的優(yōu)化
將雷公藤次堿標(biāo)準(zhǔn)品溶液采用流動(dòng)注射直接進(jìn)樣,通過全掃描確定化合物母離子,再對母離子進(jìn)行二級質(zhì)譜掃描,得到碎片離子,通過優(yōu)化S-Lens電壓、碰撞能量等參數(shù)進(jìn)行優(yōu)化,得到二級質(zhì)譜圖。
分別考察電噴霧電離源的正離子和負(fù)離子模式和大氣壓力化學(xué)電離源的正離子和負(fù)離子模式4種電離方式,結(jié)果表明,目標(biāo)物在ESI源的正離子模式條件下最佳。
通過SRM選擇相對豐度較高的離子對,確定為定量和定性離子對。同時(shí),優(yōu)化S-lens電壓、碰撞電壓等參數(shù),優(yōu)化后的質(zhì)譜參數(shù)如表1所示。
2.3基質(zhì)效應(yīng)
分別以蜂蜜的空白提取凈化液作為標(biāo)準(zhǔn)溶液的稀釋液,以各組分的峰面積對質(zhì)量濃度繪制基質(zhì)加標(biāo)標(biāo)準(zhǔn)曲線,將其斜率與標(biāo)準(zhǔn)品的標(biāo)準(zhǔn)曲線的斜率相比。結(jié)果表明經(jīng)過凈化處理后對各目標(biāo)測定物的基質(zhì)效應(yīng)影響不明顯[18]。
2.4方法的線性范圍和定量限
配制一系列不同質(zhì)量濃度的混合標(biāo)準(zhǔn)工作溶液(0.01、0.02、0.05、0.1、0.2、0.5、1、2、5、10、20 ng/mL),并依次進(jìn)樣,分別以雷公藤紅素和雷公藤次堿的峰面積Y為縱坐標(biāo),以相應(yīng)的質(zhì)量濃度X為橫坐標(biāo),作標(biāo)準(zhǔn)曲線,結(jié)果表明:這2種目標(biāo)物在0.01~20 ng/mL范圍內(nèi)其質(zhì)量濃度與峰面積呈良好的線性關(guān)系。雷公藤紅素和雷公藤次堿的線性方程分別為Y=-408.081+58 216.7X和Y=-166.356+14 146.4X,相關(guān)系數(shù)r大于0.997。以實(shí)際檢測時(shí)的信噪比大于10確定方法定量限均為0.05μg/kg。
2.5方法的回收率和精密度
分別在0.05μg/kg和1.00μg/kg水平下進(jìn)行空白加標(biāo)回收率實(shí)驗(yàn),每個(gè)水平重復(fù)6次,測定平均回收率及精密度。0.05μg/kg添加水平時(shí)雷公藤紅素和雷公藤次堿的回收率分別為69.9%~88.6%和84.3%~101.5%,相對標(biāo)準(zhǔn)偏差分別為9.2%和10%;1.0μg/kg添加水平時(shí)雷公藤紅素和雷公藤次堿的回收率分別為75.2%~93.1%和81.2%~99.8%,相對標(biāo)準(zhǔn)偏差分別為7.7%和7.9%,均符合殘留檢測的要求[19]。
3 結(jié) 論
本實(shí)驗(yàn)建立了固相萃取-超高效液相色譜-串聯(lián)質(zhì)譜同時(shí)檢測蜂蜜中雷公藤紅素和雷公藤次堿殘留的分析方法。采用直接水溶解后離心凈化,有效提高了提取率,快速、簡潔。該方法作為蜂蜜中雷公藤相關(guān)物質(zhì)殘留的確證和定量方法,具有簡便、快捷、準(zhǔn)確的優(yōu)點(diǎn),可以用于蜂蜜的質(zhì)量安全檢測和蜂蜜中毒事件中有毒樣品的定性和定量分析。
[1]衛(wèi)生部. GB 14963—2011蜂蜜[S].北京:中國標(biāo)準(zhǔn)出版社, 2011.
[2]孟麗峰,刁青云,譯.健康的潛在威脅:蜂蜜中的吡咯里西啶類生物堿:上[J].中國蜂業(yè), 2012, 63(9): 52-54.
[3]孟麗峰,刁青云,譯.健康的潛在威脅:蜂蜜中的吡咯里西啶類生物堿:下[J].中國蜂業(yè), 2012, 63(10): 52-54.
[4]謝文聞,譯.蜂蜜中羥基馬桑毒素污染[J].中國蜂業(yè), 2012, 63(7): 57.
[5]方文富. 12種有毒蜜粉源植物及預(yù)防中毒措施[J].中國蜂業(yè), 2007, 58(2): 28-29.
[6] NIHAL A B, TELAT K, TAHIR D, et al. A rare cause of atrial fibrillation: mad honey intoxication[J]. The Journal of Emergency Medicine, 2012, 43(6): 389-391.
[7]荊戰(zhàn)星.重慶秀山蜂蜜中毒事件[J].中國蜂業(yè), 2011, 62(11): 43.
[8] JAUHARI A C, JOHOREY A C, BANERJEE I, et al. Nearly fatal wild honey intoxication a case report of seven cases[J]. Journal of Clinical and Diagnostic Research, 2009, 3: 1685-1689.
[9] RAMIREZ M, RIVERA E, EREU C.Fifteen cases of atropine poisoning after honey ingestion[J].Vet Hum Toxicol, 1999, 41(1): 19-20.
[10]閆繼紅.蜂產(chǎn)品深加工與配方技術(shù)[M].北京:中國農(nóng)業(yè)科學(xué)技術(shù)出版社, 2005: 65.
[11]郭艷紅,譚墾,宋啟示. HPLC法測定昆明山海棠蜜中雷公藤甲素的含量[J].云南農(nóng)業(yè)大學(xué)學(xué)報(bào), 2007, 22(3): 401-403.
[12]金米聰,馬建明,姚潯平,等.全血中痕量雷公藤紅素的液相色譜/質(zhì)譜聯(lián)用法測定研究[J].中國衛(wèi)生檢驗(yàn)雜志, 2008 , 18(7): 1242-1244.
[13]陳曉紅,歐陽小琨,金米聰.固相萃取純化-高效液相色譜-串聯(lián)質(zhì)譜法測定尿液中痕量雷公藤紅素[J].理化檢驗(yàn):化學(xué)分冊, 2010, 46(8): 948-951.
[14]薛云云,瑪爾江·巴哈·提別克,王彥,等.大鼠血漿中雷公藤紅素的HPLC法測定[J].中國醫(yī)藥工業(yè)雜志, 2011, 42(7): 532-535.
[15]陳列忠,王開金,陳建明,等. RP-HPLC法同時(shí)測定不同產(chǎn)地雷公藤根皮中3種生物堿的含量[J].藥物分析雜志, 2007, 27(2): 191-193.
[17]吳斌,徐錦忠,陳惠蘭,等. GB/T 23408—2009蜂蜜中大環(huán)內(nèi)酯類藥物殘留量測定:液相色譜-質(zhì)譜/質(zhì)譜法[S].北京:中國標(biāo)準(zhǔn)出版社, 2009.
[18]王菲,李彤,馬辰.超高效液相色譜-串聯(lián)質(zhì)譜法測定中藥材中三唑類殺菌劑及三嗪類除草劑的殘留量[J].色譜, 2013, 31(3): 191-199.
[19]鮑曉霞,喬東,章曉氡,等. GB/T 27404—2008實(shí)驗(yàn)室質(zhì)量控制規(guī)范:食品理化檢測[S].北京:中國標(biāo)準(zhǔn)出版社, 2008.
Determination of Triptolide and Wilforine in Honey by Ultra Performance Liquid Chromatography-Tandem Mass Spectrometry
LEI Meikang1, PENG Fang1, ZHU Zitong1, DING Tao2, XU Jiawen1, WU Xiaoqin1
(1. Technology Center of Quzhou Entry-Exit Inspection and Quarantine Bureau, Quzhou 324002, China; 2. Laboratory of Food, Jiangsu Entry-Exit Inspection and Quarantine Bureau, Nanjing 210001, China)
A method based on ultra performance liquid chromatography-tandem mass spectrometry (UPLC-MS-MS) has been proposed for the determination of triptolide and wilforine residues in honey. The samples were dissolved in water and extracted with acetonitril, separated on a Hypersil GOLD C18column (50 mm×2.1 mm, 1.9μm) with gradient elution. The determination was carried out with electrospray ion source under the positive mode and multiple reaction monitoring (SRM) mode. The concentrations of triptolide and wilforine in the range of 0.01-20 ng/mL were linearly correlated to the peak area, with correlation coefficients greater than 0.997. The limits of quantification (RSN> 10)for both triptolide and wilforine were 0.05μg/kg. The recoveries of triptolide and wilforine were 69.9%-101.5%, respectively, at spiked concentrations of 0.05μg/kg and 1.0μg/kg, with relative standard deviations (RSD,n= 6) lower than 10%. Our results indicate that the developed method is rapid, sensitive and accurate for the qualitative and quantitative analysis of triptolide and wilforine in honey.
ultra performance liquid chromatography-tandem mass spectrometry; honey; triptolide; wilforine
S896.8
A
1002-6630(2015)12-0218-03
10.7506/spkx1002-6630-201512041
2014-10-10
浙江省公益性技術(shù)應(yīng)用研究計(jì)劃項(xiàng)目(2013C37101)
雷美康(1982—),男,工程師,碩士,研究方向?yàn)榉治鰴z測及標(biāo)準(zhǔn)化。E-mail:leimeikang@163.com

