血管性認知障礙小鼠腦內少突膠質細胞再生分化障礙特點研究
李海龍,鄭惠文,劉敏,黎佳思,王云霞,趙善民,畢曉瑩(并列第一作者)
血管性癡呆(vascular dementia,VD)是全球導致癡呆的第二位疾病,僅次于阿爾茨海默癥[1]。缺血性腦血管病變所引起的額葉、顳葉、邊緣系統等部位神經元大量死亡是引起其認知障礙重要的病理基礎,但目前針對其認知功能的下降尚無有效的治療。近些年的研究發現,在成年哺乳動物的腦內存在大量的神經干/祖細胞,且這些細胞終身具有產生新生神經元的能力[1-2]。室管膜下區(subventricular zone,SVZ)及海馬齒狀回(dentate gyrus,DG)的顆粒下層(subgranular zone,SGZ)是神經干/祖細胞分化產生新生神經細胞的主要區域。有研究發現,腦缺血可誘發成年沙鼠持續的神經再生[3],且脫髓鞘損傷后少突膠質細胞祖細胞(oligodendrocyte progenitorcells,OPCs)數量反應性增多[4]。促進血管性癡呆中受損神經元的再生修復,從而替代死亡的神經細胞功能可能是未來VD重要的治療靶點。本研究旨在通過建立VD小鼠模型,觀察全腦缺血后室管膜下區和海馬齒狀回神經元再生以及少突膠質細胞再生、分化、成熟的特點,為尋找血管性認知障礙的治療靶點提供理論依據。
1 材料方法
1.1 動物及分組 研究采用健康CD1雄性小鼠48只,8~10周,體重25~30 g,由第二軍醫大學實驗動物中心提供。編號后采用SAS軟件隨機分為模型組和假手術組,每組24只,造模前常規條件下飼養1周。
1.2 血管性癡呆小鼠模型構建 參照通用的反復缺血再灌注法進行血管性癡呆小鼠造模[5]。步驟如下:0.3%戊巴比妥(75 mg/kg)腹腔麻醉,取仰臥位,門齒及四肢固定,分離雙側頸動脈,動脈夾阻斷供血15 min后恢復供血10 min,再次阻斷供血15 min后移除動脈夾,術中觀察小鼠呼吸、心跳,術畢縫合皮膚,置于恒溫板上復蘇,小鼠清醒后放回籠中飼養。假手術組除不阻斷頸動脈供血外,其余手術操作與模型組相同。術后14 d和28 d每組分別隨機取12只小鼠處死后取腦組織進行檢測。
1.3 新生細胞標記及取材 術后第4天起予腹腔注射5-溴脫氧尿嘧啶核苷(bromodeoxyuridine,BrdU,美國Sigma公司)連續3 d(150 mg/kg,1次/日)標記新生細胞。動物生理鹽水灌心處死后,剝離腦組織,4%多聚甲醛固定,30%蔗糖水脫水后,制備冰凍切片,切片厚度30μm,在前囟后1.28 mm到2.12 mm間,自前向后用冰凍切片機切取腦組織冠狀面切片,裱片后-20°冰箱保存。
1.4 免疫組化染色 組織切片經晾片、漂洗、穿膜后分別與一抗4°孵育過夜。一抗包括:小鼠BrdU單克隆抗體(1∶200稀釋,美國Sigma公司)標記細胞增殖;兔神經膠質抗原2(neural/glial antigen2,NG2)抗體(1∶200稀釋,美國Millipore公司)標記少突膠質細胞祖細胞;小鼠少突膠質細胞O4(oligodendrocyte marker O4)單克隆抗體(1∶300稀釋,美國Millipore公司)標記少突膠質細胞前體細胞;兔谷胱甘肽S轉移酶(glutathione-S-transferase pi,GST-pi)抗體(1∶250稀釋,美國Epitomics公司)標記成熟少突膠質細胞。次日加入辣根過氧化物酶標記的羊抗兔或羊抗小鼠的相應二抗(1∶500稀釋),室溫孵育75 min,二氨基聯苯胺顯色,封片后顯微鏡下觀察。
1.5 免疫熒光雙標共聚焦顯像 組織切片脫氧核糖核酸變性后分別與BrdU抗體和兔神經元特異性核蛋白(neuronal specific neucleoprotein,NeuN)抗體(1∶400,美國Abcam公司)或兔膠質纖維酸性蛋白(glial fibrillary acidic protein,GFAP)抗體(1∶2000稀釋,美國Epitomics公司)的混合物4℃共同孵育過夜。再分別用相應的熒光素標記的二抗孵育后,封片在激光共聚焦顯微鏡下觀察神經元的再生分化。
1.6 細胞計數 每只小鼠選取5張切片,通過觀察每張腦切片中SVZ及DG區6個不同視野免疫組化染色為陽性的細胞數進行計數,細胞計數以每mm2的細胞數表示,計算全部視野的平均值作為其對應的細胞數。免疫熒光雙標染色采用激光共聚焦顯微鏡成像,每張切片選5個視野,采用Image-Pro Plus 6.0圖像分析軟件進行雙染細胞數計數,計算全部視野雙染細胞數的平均值。
2 結果
2.1 血管性癡呆小鼠室管膜下區細胞增殖和再生能力增強 免疫組化染色顯示,術后14 d與28 d模型組與假手術組室管膜下區BrdU陽性細胞均有表達(圖1)。術后14 d模型組與假手術組BrdU陽性細胞數分別為161.1±16.9/mm2、85.7±7.3/mm2,術后28 d有所回落,分別為99.2±11.0/mm2、59.5±5.7/mm2,術后2周和4周時模型組較假手術組BrdU陽性細胞數均顯著增多(t=13.64,P<0.001;t=18.79,P<0.001)。鑒于新生神經元形成需要一定時間周期,因此僅對術后28 d的腦組織進行新生神經元的觀察。采用BrdU、NeuN抗體分別標記新生細胞和神經元細胞核,免疫熒光雙標共聚焦顯像,綠色熒光標記新生細胞,紅色熒光標記神經元胞核(圖2A)。BrdU/NeuN雙陽性細胞進行計數后顯示,模型組與假手術組術后28 d的BrdU/NeuN雙陽性細胞數分別為66.3±4.6/mm2、37.9±5.9/mm2,模型組較假手術組新生神經元數量顯著增多(t=13.04,P<0.001)。
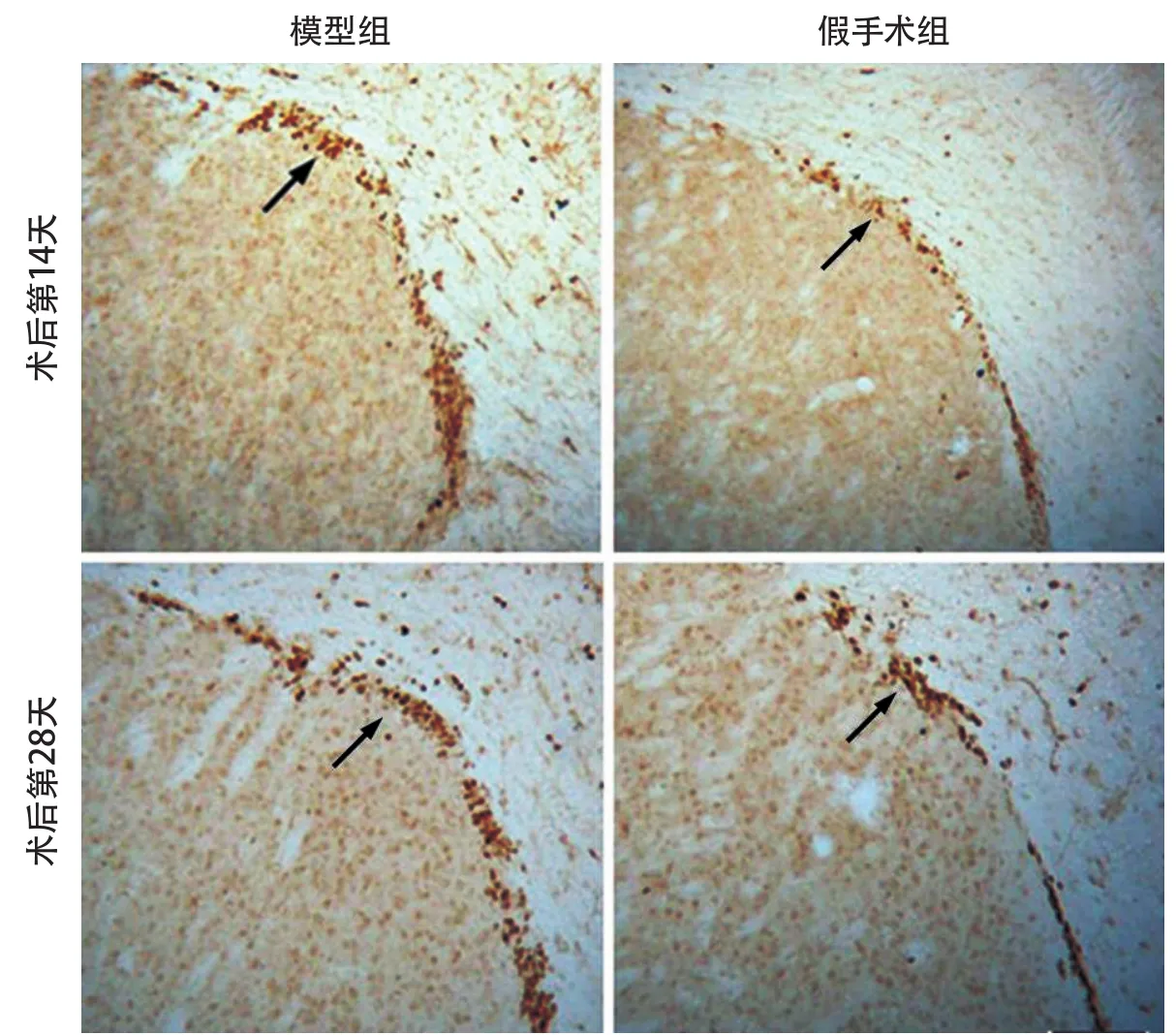
圖1 術后14 d與術后28 d室管膜下區BrdU標記的新生細胞增殖情況對比
2.2 血管性癡呆小鼠海馬齒狀回神經祖細胞向少突膠質細胞再生但進一步分化成熟障礙基于神經祖細胞向少突膠質細胞的再生分化同樣具有一定的周期,故選用術后28 d的組織切片對少突膠質細胞再生過程中不同分化階段的細胞進行觀察。免疫組化顯示,NG2抗體標記的少突膠質細胞祖細胞、O4抗體標記的少突膠質細胞前體細胞、GST-pi抗體標記的成熟少突膠質細胞在兩組均有表達(圖3A、3B、3C)。細胞計數顯示,模型組NG2陽性細胞數為511.0±22.8/mm2,假手術組NG2陽性細胞數為448.8±20.9/mm2,模型組較假手術組NG2陽性細胞數量顯著增多(P<0.001)。模型組O4陽性細胞數為66.8±11.4/mm2,假手術組O4陽性細胞數為80.5±10.5/mm2,模型組較假手術組O4陽性細胞數量減少(P=0.006)。模型組GST-pi陽性細胞數為133.5±11.6/mm2,假手術組GST-pi性細胞數為140.2±10.9/mm2,但兩組無顯著差異(P=0.161)。
2.3 血管性癡呆小鼠海馬齒狀回新生星形膠質細胞增多 對術后28 d的小鼠腦組織海馬齒狀回采用免疫熒光共聚焦成像進行新生星形膠質細胞的觀察。BrdU、GFAP抗體分別標記新生細胞和星形膠質細胞,紅色熒光標記新生細胞,綠色熒光標記星形膠質細胞(圖2B)。細胞計數顯示,模型組與假手術組術后28 d的BrdU/GFAP雙陽性細胞分別為8±2.9/mm2、5.3±2.2/mm2,模型組較假手術組新生的星形膠質細胞數量顯著增多(P=0.015)。

圖2 術后28 d免疫熒光雙標SVZ新生神經細胞與DG新生星形膠質細胞
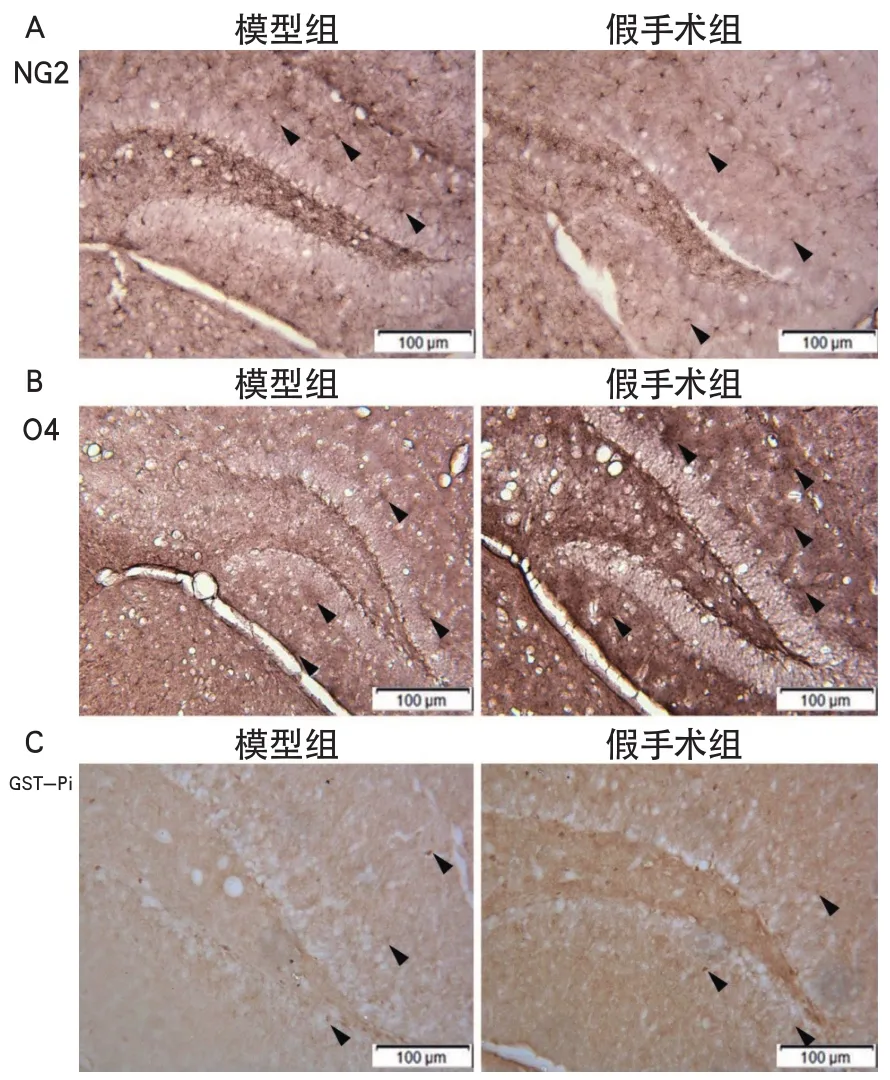
圖3 免疫組織化學顯示海馬齒狀回少突膠質細胞分化和成熟情況
3 討論
目前,多種血管性危險因素所導致的腦血流低灌注而引起的腦深部白質損傷已被認為是血管性認知障礙的重要病理生理基礎[6]。采用反復阻斷雙側頸總動脈模擬腦血流量下降來制備的血管性癡呆模型具有顯著的學習記憶損害[7]。我們先前的研究中發現,該模型動物術后可出現顯著的學習記憶能力下降并伴有海馬椎體神經元的壞死和凋亡及以少突膠質細胞死亡為表現的腦白質損傷[8]。因此,該模型是研究血管性癡呆的可靠動物模型。本研究中,我們在該模型中使用相關的神經標記物對目標細胞進行標記,通過與假手術的對照組動物進行對比,觀察小鼠術后2周及4周2個神經再生區域的細胞增殖及少突膠質細胞分化成熟情況。
室管膜下區是新生兒腦內神經元、少突膠質細胞及星形膠質細胞的重要來源,近年來的研究認為成年哺乳動物腦內室管膜下區同樣存在神經再生且可在多種病理條件下激活[9]。本研究中通過使用BrdU標記新生細胞發現,血管性癡呆小鼠造模后14 d及28 d后室管膜下區BrdU標記的新生細胞較假手術組增多,且術后14 d時最為顯著,且同時伴有新生神經元的顯著增多。表明全腦反復缺血低灌注可誘發室管膜下區新生細胞的增殖及神經元的內源性再生增強。而有關缺血性腦損傷后神經再生的一些研究顯示,在大腦中動脈阻斷(middle cerebral artery occlusion,MCAO)造成腦局部缺血性損傷的動物模型中,阻斷供血后同樣出現了室管膜下區新生細胞的顯著增多,且在1~2周達到高峰[10-11]。這與本研究中室管膜下區新生細胞增殖的特點一致。但與MCAO模型不同的是,本研究僅為短暫性的缺血再灌注,手術并未導致動物出現神經功能缺損。由此可見,盡管未導致局灶性的缺血性損傷,血管性癡呆模型中全腦缺血低灌注條件同樣可誘發室管膜下區內源性細胞增殖及神經元再生。研究發現,卒中導致的神經元死亡可介導內源性神經干/祖細胞分化再生為新生神經元并遷徙至損傷部位修復受損的神經元[12]。同時,室管膜下區的神經祖細胞也可以分化再生為少突膠質細胞進而修復髓鞘損傷[13]。因此,缺血低灌注所導致的以少突膠質細胞死亡及髓鞘脫失為特征性的腦白質損傷可能是誘發室管膜下區細胞增殖增強的重要因素。
有研究認為,缺血所激發的海馬齒狀回神經再生是對短暫全腦缺血導致的海馬椎體神經元死亡的一種反應,而海馬齒狀回神經再生與室管膜下區新生細胞的遷徙并不一致,其在缺血性損傷中可起獨立修復受損神經元的作用[14]。海馬齒狀回神經干/祖細胞向少突膠質細胞分化可促進脫髓鞘損傷的修復[15]。本研究對海馬齒狀回少突膠質細胞再生不同階段的主要細胞進行觀察后發現,模型組少突膠質細胞祖細胞增多,少突膠質細胞前體細胞減少,而成熟少突膠質細胞未見顯著差異,提示海馬齒狀回神經干/祖細胞向少突膠質細胞祖細胞分化增加,但少突膠質細胞祖細胞向少突膠質細胞前體細胞進一步分化成熟障礙。有關血管性癡呆患者腦白質的尸檢研究發現,腦白質中少突膠質細胞祖細胞增多,而成熟少突膠質細胞卻顯著減少,這同樣提示了少突膠質細胞祖細胞向成熟少突膠質細胞分化過程可能受到了抑制[16-17]。鑒于在缺血性白質損傷的修復過程中,少突膠質細胞祖細胞聚集于神經元軸突周圍并向成熟少突膠質細胞分化是髓鞘修復的關鍵環節[18]。因此,盡管以少突膠質細胞死亡為特征的白質損傷可通過釋放多種信號分子促進內源性髓鞘再生,從而發揮自我保護和修復作用,但由于少突膠質細胞再生過程中被抑制,海馬新生的少突膠質細胞祖細胞并不能進一步分化為成熟的少突膠質細胞發揮修復髓鞘損傷的作用。最新的研究發現,神經營養因子可通過促進少突膠質細胞再生來改善缺血后的髓鞘損傷,有望成為未來血管性癡呆新的治療策略[19]。
本研究中,模型組海馬齒狀回新生星形膠質細胞顯著增多。既往研究認為,在缺血性損傷下,血腦屏障破壞可引起星形膠質細胞的反應性增生,釋放炎性因子參與缺血性炎癥反應[20]。而另有研究認為從起源上講,GFAP陽性星形膠質細胞可進一步分化形成少突膠質細胞從而參與髓鞘損傷的修復[13]。據此,我們推測,在該模型中由于海馬神經干/祖細胞向少突膠質細胞再生分化抑制,因而轉為分化為反應性星形膠質細胞的數量增加。因此,本研究中新生反應性星形膠質細胞的增多除了為缺血后的炎性增生外,同樣也可能為機體針對缺血性白質脫髓鞘損傷所表現出的神經再生被異常調控的結果,但目前尚缺乏海馬齒狀回GFAP陽性星形膠質細胞在神經再生中作用的研究,相關機制有待進一步闡明。本研究在血管性癡呆動物模型水平證實了,反復缺血低灌注即可誘發室管膜下區顯著的細胞增殖及神經元再生,海馬齒狀回的少突膠質細胞再生障礙。其中少突膠質細胞的再生障礙可影響白質髓鞘損傷的修復,這可能是血管性癡呆缺乏有效治療的原因之一。神經干/祖細胞分化為少突膠質細胞祖細胞,再分化為少突膠質細胞的調控機制仍然不清,缺氧低灌注條件下細胞因子、酶及信號蛋白變化均可影響神經再生的強度和方向[15,18-19]。這一系列的調節通路中可能存在影響血管性癡呆神經再生修復的治療靶點,如何對可能的靶點進行有效干預,從而促進缺血低灌注條件下白質損傷的修復,有待進一步研究。
1 賈建平,江漢秋.進一步重視血管性癡呆的防治[J].內科理論與實踐,2007,2:67-69.
2 Eriksson PS,Perfilieva E,Bjork-Eriksson T,et al.Neurogenesis in the adult human hippocampus[J].Nat Med,1998,4:1313-1317.
3 Liu J,Solway K,Messing RO,et al.Increased neurogenesis in the dentate gyrus after transient global ischemia in gerbils[J].J Neurosci,1998,18:7768-7778.
4 Nait-Oumesmar B,Picard-Riera N,Kerninon C,et al.Activation of the subventricular zone in multiple sclerosis:evidence for early glial progenitors[J].Proc Natl AcadSci USA,2007,104:4694-4699.
5 Yan B,He J,Xu H,et al.Quetiapine attenuates the depressive and anxiolytic-like behavioural changes induced by global cerebral ischemia in mice[J].Behav Brain Res,2007,182:36-41.
6 Iadecola C.The pathobiology of vascular dementia[J].Neuron,2013,80:844-866.
7 靳瑋.反復缺血再灌注制備小鼠血管性癡呆模型的評價[J].疑難病雜志,2008,7:131-132.
8 Yan B,Bi X,He J,et al.Quetiapine attenuates spatial memory impairment and hippocampal neurodegeneration induced by bilateral common carotid artery occlusion in mice[J].Life Sci,2007,81:353-361.
9 Braun SM,Jessberger S.Adult neurogenesis and its role in neuropsychiatric disease,brain repair and normal brain function[J].Neuropathol Appl Neurobiol,2014,40:3-12.
10 Parent JM,Vexler ZS,Gong C,et al.Rat forebrain neurogenesis and striatal neuron replacement after focal stroke[J].Ann Neurol,2002,52:802-813.
11 Komitova M,Mattsson B,Johansson BB,et al.Enriched environment increases neural stem/progenitor cell proliferation and neurogenesis in the subventricular zone of stroke-lesioned adult rats[J].Stroke,2005,36:1278-1282.
12 Arvidsson A,Collin T,Kirik D,et al.Neuronal replacement from endogenous precursors in the adult brain after stroke[J].Nat Med,2002,8:963-970.
13 Menn B,Garcia-Verdugo JM,Yaschine C,et al.Origin of oligodendrocytes in the subventricular zone of the adult brain[J].J Neurosci,2006,26:7907-7918.
14 Salazar-Colocho P,Lanciego JL,Del Rio J,et al.Ischemia induces cell proliferation and neurogenesis in the gerbil hippocampus in response to neuronal death[J].Neurosci Res,2008,61:27-37.
15 Jessberger S,Toni N,Clemenson GD,et al.Directed differentiation of hippocampal stem/progenitor cells in the adult brain[J].Nat Neurosci,2008,11:888-893.
16 Miyamoto N,Tanaka R,Shimura H,et al.Phosphodiesterase III inhibition promotes differentiation and survival of oligodendrocyte progenitors and enhances regeneration of ischemic white matter lesions in the adult mammalian brain[J].J Cereb Blood Flow Metab,2010,30:299-310.
17 Ekonomou A,Ballard CG,Pathmanaban ON,et al.Increased neural progenitors in vascular dementia[J].Neurobiol Aging,2011,32:2152-2161.
18 Mifsud G,Zammit C,Muscat R,et al.Oligodendrocyte pathophysiology and treatment strategies in cerebral ischemia[J].CNS Neurosci Ther,2014,20:603-612.
19 Ramos-Cejudo J,Gutierrez-Fernandez M,Otero-Ortega L,et al.Brain-derived neurotrophic factor administration mediated oligodendrocyte differentiation and myelin formation in subcortical ischemic stroke[J].Stroke,2015,46:221-228.
20 Simpson JE,Fernando MS,Clark L,et al.White matter lesions in an unselected cohort of the elderly:astrocytic,microglial and oligodendrocyte precursor cell responses[J].Neuropathol Appl Neurobiol,2007,33:410-419.

