重組人神經生長因子治療大鼠糖尿病周圍神經病變的效果
白 羊 章永壘 黃奮飛 陳勝亮 阮 卡 陳 星▲
未名生物醫藥有限公司,福建廈門361009
重組人神經生長因子治療大鼠糖尿病周圍神經病變的效果
白 羊 章永壘 黃奮飛 陳勝亮 阮 卡 陳 星▲
未名生物醫藥有限公司,福建廈門361009
目的觀察重組人神經生長因子(rhNGF)治療大鼠糖尿病周圍神經病變(DPN)效果。方法選用健康成年的雄性SD大鼠,腹腔注射鏈脲霉素(STZ)建立糖尿病(DM)大鼠模型。1個月后檢測大鼠尾部感覺神經傳導速度(SNCV),以SNCV<30m/s為DPN成模標準。將DPN大鼠隨機分為6組,分別為模型對照組、受試藥rhNGFⅠ、Ⅱ、Ⅲ、Ⅳ(劑量分別為0.3、1、3、9μg/kg)4個劑量組,陽性對照組(依帕司他15mg/kg),同時設正常對照組。連續給藥2個月,檢測大鼠體重、血糖、大鼠尾部SNCV、坐骨神經傳導速度(MNCV)以及坐骨神經中果糖及山梨醇含量。結果DM造模1個月后,模型對照組大鼠體重、血糖值、尾部SNCV和坐骨神經MNCV均與正常對照組有明顯差異(P<0.01),表明DPN造模成功。受試藥rhNGF對DPN大鼠體重和血糖值無顯著影響(P>0.05),對大鼠尾部SNCV和坐骨神經MNCV具有明顯改善作用,給藥2個月rhNGF受試組(Ⅲ)大鼠尾部SNCV、rhNGF受試組(Ⅱ、Ⅲ)坐骨神經MNCV較模型對照組高且差異有統計學意義(P<0.05)。DPN大鼠坐骨神經中果糖及山梨醇的含量顯著升高,說明DPN的發生與多元醇代謝紊亂具有相關性。受試藥rhNGF能降低DPN大鼠坐骨神經中果糖及山梨醇的含量,其中果糖含量變化具有一定的劑量相關性,而山梨醇含量變化未發現明顯的劑量效應。結論受試藥rhNGF對DPN大鼠神經具有較好的保護作用,與陽性對照藥依帕司他作用相似,可能與改善DPN大鼠的多元醇代謝相關。
糖尿病;糖尿病周圍神經病變;神經生長因子;神經傳導速度;山梨醇;果糖
糖尿病(diabetesmellitus,DM)是常見的代謝性疾病,據估計我國約有11.6%的成人患有DM[1]。糖尿病周圍神經病變(diabetic peripheral neuropathy,DPN)是DM最常見的慢性并發癥之一[2]。應用外源性神經生長因子(nerve growth factor,NGF)有助于DPN癥狀減輕[3],臨床上可有效地改善DPN的神經癥狀、血清蛋白含量和血液流變學[4-8]。但目前國內使用的NGF主要來源為天然提純,與天然NGF相比,重組人神經生長因子(recombinanthumannervegrowth factor,rhNGF)具有易獲得、高產率、高活性與低成本等特點[9]。本文對DPN大鼠給予rhNGF治療,對治療前后體重、血糖值、大鼠尾部感覺神經傳導速度(sensory nerve con duction velocity,SNCV)和坐骨神經運動神經傳導速度(motor nerve conduction velocity,MNCV)以及大鼠坐骨神經中果糖、山梨醇含量進行了比較,對rhNGF對大鼠DPN的治療效果進行了研究。
1 材料與方法
1.1 實驗材料
體重200~250 g的健康雄性SPF級SD大鼠,由南方醫科大學實驗動物中心提供(動物質量合格證號:44002100003545)。rhNGF(未名生物醫藥有限公司,批號:BW 101),采用E.coli重組表達[10],HPLC檢測純度>98.0%,TF-1細胞法檢測體外生物學活性>500 AU/μg。
1.2 儀器與試劑
T1000Y電子天平(美國雙杰兄弟公司)、BS211D型電子天平(德國Sartorius公司)、BL-420F生物機能實驗系統(成都泰盟科技有限公司)、羅氏卓越血糖儀(羅氏診斷產品有限公司)、GC2010 plus氣相色譜儀(島津企業管理有限公司)、DMT-2500多管渦混合儀(杭州米歐儀器有限公司)、TGL20MW離心機(湖南赫西儀器裝備有限公司)、NDK200-2氮吹儀(杭州米歐儀器有限公司)、懸轉蒸發儀(上海申生科技有限公司)、T18D10G勻漿機(德國IKA有限公司)。
鏈脲霉素,Sigma-Aldrich公司,批號:WXBB2432V;水合氯醛,天津科密歐化學試劑有限公司,批號:20130325;甲醇,色譜純,Honeywell,批號:NAAG3H;三氟乙酸,分析純,上海晶純生化科技股份有限公司,批號:E1421021;吡啶,色譜純,上海晶純生化科技股份有限公司,批號:J1329001;N,N-二甲基乙酰胺,色譜純,上海晶純生化科技股份有限公司,批號:C1425015;乙酸酐,分析純,國藥集團化學試劑有限公司,批號:20141211;山梨醇對照品,Sigma-Aldrich公司,批號:MKBM0921V;果糖對照品,中國藥品生物制品檢定研究院,批號:100231-201305。

表1 給藥方案
1.3 方法
1.3.1 造模方法
選用健康成年的SD大鼠158只,體重200~250 g,腹腔注射鏈脲霉素(STZ 60 mg/kg),1周后測定血糖,以血糖≥16.7mmol/L作為DM成模標準,DM模型成功后大鼠出現多飲多食、多尿、體重增長緩慢或體重減輕的癥狀。待DM模型建立1個月后,檢測大鼠尾部SNCV,以<30 m/s為DPN大鼠成模標準。
1.3.2 分組及給藥方案
1.3.2.1 動物分組選取DPN造模成功的90只大鼠隨機分為6組(n=15),分別為模型對照組、受試藥Ⅰ、Ⅱ、Ⅲ、Ⅳ(rhNGF劑量分別為0.3、1、3、9μg/kg)4個劑量組,陽性對照組,同時設正常對照組。
1.3.2.2 給藥途徑①受試藥組:按上述劑量肌內注射給藥,給藥體積1mL;②正常對照組、模型對照組:給予受試藥組等體積的0.9%氯化鈉注射液,肌內注射給藥;③陽性藥對照組:依帕司他(15 mg/kg),灌胃給藥,給藥體積10 mL。給藥頻率及周期:每天1次,連續給藥2個月,具體見給藥方案見表1。
1.3.3 體重及血糖檢測
每周檢測大鼠體重;給藥后每月測試動物血糖。
1.3.4 大鼠尾部SNCV檢測
給藥后每月檢測1次大鼠尾部SNCV。大鼠用10%水合氯醛麻醉后俯臥位固定,清潔大鼠尾部皮膚,電極放置方式為一對刺激電極(負極位于正極近心側)插入大鼠尾部皮下,然后依次插入記錄電極Ⅰ和記錄電極Ⅱ,記錄電極Ⅰ在刺激電極負極近心側2 cm處,記錄電極Ⅱ在記錄電極I近心側2 cm處,再將參考電極Ⅰ、Ⅱ分別插入距記錄電極Ⅰ、Ⅱ近心側0.5 cm處皮下,最后將接地電極插入刺激電極負極與記錄電極Ⅰ之間。采用BL420F型多道生理信號處理系統測定各組大鼠尾部SNCV,重復刺激3次,間隔30 s,取平均值。尾部SNCV(m/s)=記錄兩電極之間的距離/動作電位潛伏期時間差[6]。
1.3.5 坐骨神經MNCV檢測
末次給藥檢測SNCV后,檢測MNCV(m/s)。將大鼠俯臥位固定,分離右側坐骨神經約20 mm,用兩對并列固定的勾式刺激電極(雙極保護電極)置于坐骨神經上,分為中樞端和外周端,兩對電極之間的距離為15 mm,于腓腸肌處用一對針式電極插到腓腸肌上記錄誘發的復合動作電位(兩電極之間距離約為8mm)。用單脈沖方波刺激,波寬0.1ms,自動增量刺激誘發產生復合動作電位。計算兩對刺激電極之間的距離(D),測量兩點傳導所需要的時間(T2-T1)。MNCV=D/(T2-T1)[11]。
1.3.6 坐骨神經果糖及山梨醇的含量
取大鼠左側坐骨神經,用純水沖洗,稱重,按照1根坐骨神經加1mL純水后勻漿,4℃下2000 r/min離心10 min,取得即勻漿上清液。取混合標準品溶液20μL(果糖3 mg/m L、山梨醇2 mg/mL),在80℃金屬浴中氮氣吹干,加入400μL勻漿上清液復溶后,加入100μL 10%三氟乙酸溶液,在12 000 r/min下離心10 min,取上清液300μL,在80℃水浴中減壓蒸干,依次加入0.5mL吡啶、0.5mLN,N-二甲基乙酰胺,1mL乙酸酐,混勻后在90℃水浴中反應40min,過0.45μm濾膜后注入氣相色譜儀檢測。氣相色譜條件:毛細管柱:Rtx-5(0.25 mm×30 mm;膜厚0.25μm);載氣:氮氣;流速:0.4 mL/min;程序升溫150℃(保留2 min),5℃/min升溫至250℃,再以10℃/min升溫至290℃(保留9min);氣化室溫度:280℃;檢測器:氫火焰檢測器;進樣量1μL[12]。
1.4 統計學方法
采用SPSS 19.0統計學軟件進行數據分析,計量資料數據用均數±標準差(x±s)表示,多組間比較采用單因素方差分析,組間兩兩比較采用Dunnett-t檢驗,以P<0.05為差異有統計學意義。
2 結果
2.1 各組大鼠體重、血糖水平比較
DM造模大鼠體重均低于正常對照組且差異有高度統計學意義(P<0.01),血糖值均大于16mmol/L,高于正常對照組且差異有高度統計學意義(P<0.01),表明DM造模成功。連續給藥2個月DPN大鼠體重、血糖均保持穩定,與模型對照組比較,差異均無統計學意義(P>0.05)。見表2。
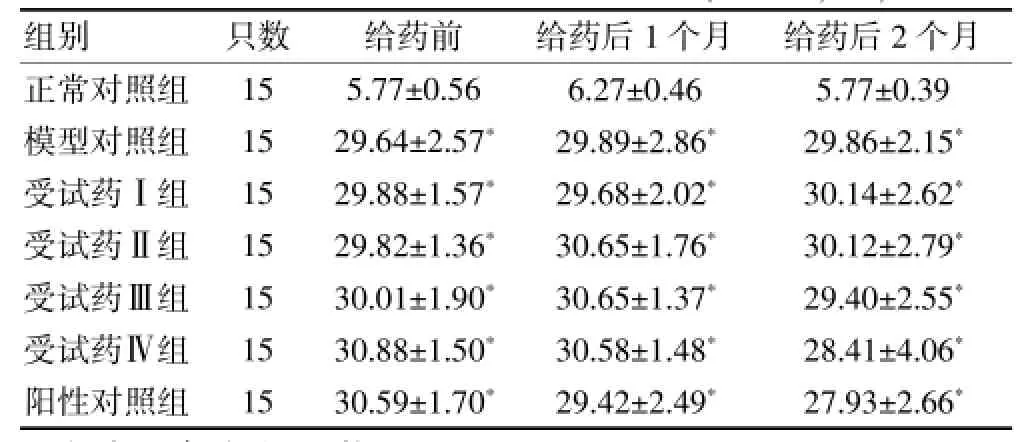
表2 各組大鼠給藥前后血糖水平比較(mmol/L,x±s)
2.2 大鼠尾部SNCV、坐骨神經MNCV
DM大鼠造模1個月后,模型對照組及各給藥組大鼠尾部SNCV(均<30 m/s)低于正常對照組且差異有高度統計學意義(P<0.01),表明DPN造模成功。給藥過程中,模型對照組大鼠尾部SNCV隨時間延長而逐步降低,提示在沒有藥物干預情況下,大鼠DPN癥狀加重。rhNGF各受試組、陽性對照組大鼠尾部SNCV和坐骨神經MNCV均較模型對照組高,其中給藥1個月rhNGF受試組(Ⅱ、Ⅲ、Ⅳ)與陽性對照組大鼠尾部SNCV較模型對照組高且差異有統計學意義(P<0.05);給藥2個月rhNGF受試組(Ⅲ)與陽性對照組大鼠尾部SNCV較模型對照組高且差異有統計學意義(P<0.05);給藥2個月rhNGF受試組(Ⅱ、Ⅲ)與陽性對照組坐骨神經MNCV較模型對照組高且差異有統計學意義(P<0.05);其他各組均有提高但差異無統計學意義(P>0.05)。說明rhNGF與陽性藥物均對DPN大鼠尾部SNCV、坐骨神經MNCV均有較好的改善作用。見表3。
表3 各組大鼠給藥前后SNCV、坐骨神經MNCV比較(m/s,±s)
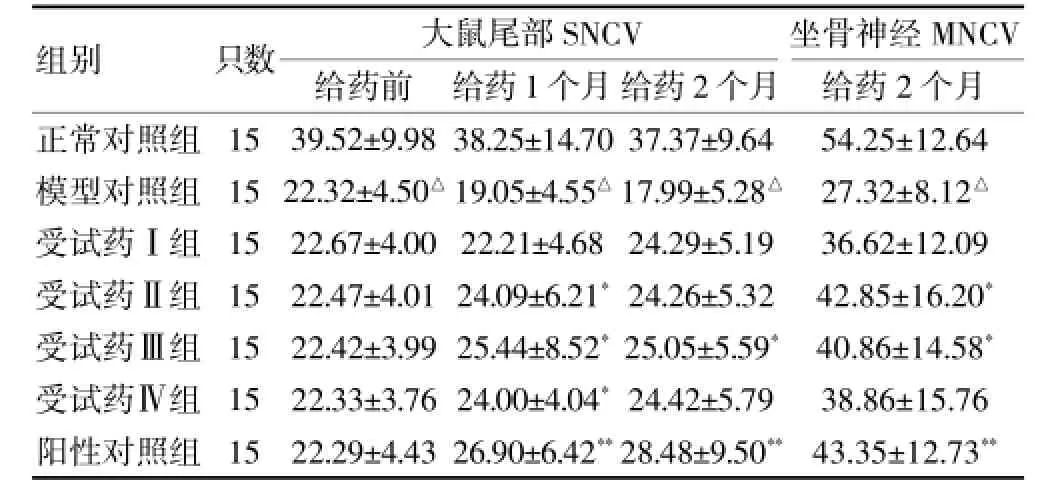
表3 各組大鼠給藥前后SNCV、坐骨神經MNCV比較(m/s,±s)
注:與正常對照組比較,△P<0.01;與模型對照組比較,*P<0.05,**P<0.01;SNCV:感覺神經傳導速度;MNCV:運動神經傳導速度
?
2.3 大鼠坐骨神經中果糖及山梨醇含量
給藥對大鼠坐骨神經中果糖及山梨醇含量的影響模型對照組大鼠坐骨神經中果糖、山梨醇的含量均高于正常對照組且差異有高度統計學意義(P<0.01)。給藥2個月后,rhNGF受試組(Ⅱ、Ⅲ、Ⅳ)和陽性對照組果糖含量低于模型對照組且差異有統計學意義(P<0.05);rhNGF受試組(Ⅰ、Ⅱ、Ⅲ、Ⅳ)和陽性對照組山梨醇含量低于模型對照組且差異有高度統計學意義(P<0.01)。見表4。
表4 各組大鼠給藥后坐骨神經中果糖及山梨醇含量比較(μg/mg,±s)
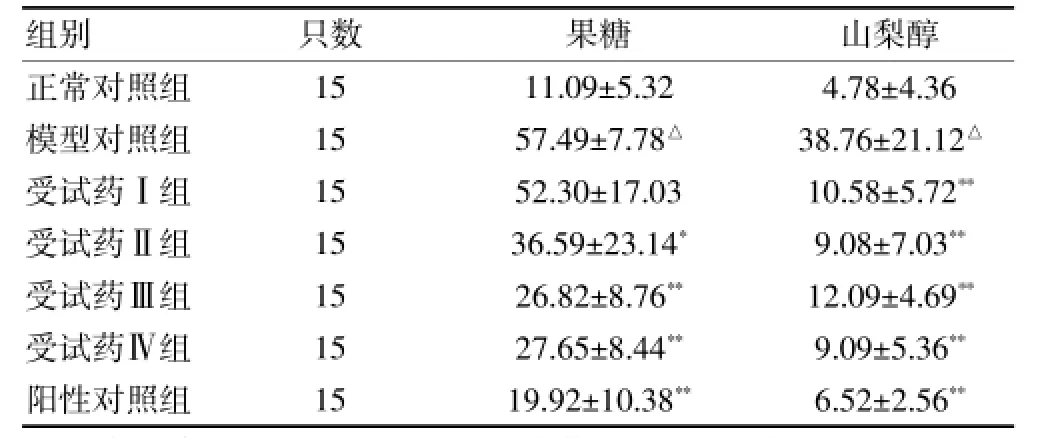
表4 各組大鼠給藥后坐骨神經中果糖及山梨醇含量比較(μg/mg,±s)
注:與正常對照組比較,△P<0.01;與模型對照組比較,*P<0.05,**P<0.01
?
3 討論
DPN是DM主要的慢性并發癥之一,其發病率與DM病程有關,有60%~90%的患者通過神經功能檢查,均有不同程度的神經病變[2,13]。DPN發病率高,受累神經廣泛,臨床癥狀尤其是疼痛持續時間長,嚴重影響DM患者的生活質量,甚至造成嚴重生活障礙,是醫學上急需解決的問題[14]。
DPN的發病機制尚未完全闡明,多數學者認為該病發生是多種因素共同作用的結果。其中多元醇-肌醇途徑學說認為多元醇代謝通路的增強,果糖、山梨醇在神經組織細胞內大量蓄積是DPN的重要發病機制之一[16-17]。研究表明,DPN時神經組織內果糖及山梨醇含量升高,主要與神經細胞外葡萄糖濃度增高有關[18],使用醛糖還原酶抑制劑(ARI)如依帕司他能阻止山梨醇的沉積,也能阻止神經組織內肌醇的減少,從而改善神經傳導速度[19-22]。因此,本研究選擇依帕司他作為陽性對照藥,并選擇DM大鼠造模成功1個月后大鼠尾部SNCV<30m/s的DPN造模成功的大鼠進行試驗。
本研究結果表明,模型對照組大鼠體重、血糖值、尾部SNCV和坐骨神經MNCV均與正常對照組有明顯差異(P<0.01),表明DPN造模成功。受試藥rhNGF對DPN大鼠的體重和血糖值無明顯影響,對DPN大鼠尾部SNCV和坐骨神經MNCV等周圍神經癥狀具有明顯的改善作用(劑量3μg/kg療效最佳)。DPN大鼠坐骨神經中果糖及山梨醇的含量顯著升高,說明DPN的發生與多元醇代謝紊亂具有相關性。受試藥rhNGF能降低DPN大鼠坐骨神經中果糖及山梨醇的含量,其中果糖含量變化具有一定的劑量相關性,而山梨醇含量變化未發現明顯的劑量效應。受試藥rhNGF與陽性對照藥依帕司他對大鼠DPN的作用機制類似,與改善DPN大鼠的多元醇代謝相關。
[1]Xu Y,Wang L,He J,et al.Prevalence and control of diabetes in Chinese adults[J].JAMA,2013,310(9):948-959.
[2]施君,張文川.糖尿病周圍神經病變發病機制的研究進展[J].上海交通大學學報:醫學版,2012,32(1):116-119.
[3]柳川.糖尿病周圍神經病與神經生長因子[J].國外醫學:藥學分冊,1998,25(4):224-227.
[4]王建法,陳清漢.神經生長因子與尼莫地平對糖尿病周圍神經病變預處理的影響[J].中華實驗外科雜志,2015,32(1):139-141.
[5]沈巍.鼠神經生長因子、丹紅注射液聯合治療對糖尿病周圍神經病變患者血液流變學,神經傳導速度的改善效果[J].中國老年學雜志,2013,33(12):2749-2750.
[6]衛重娟,程焱,梁浩,等.神經生長因子對糖尿病神經病變大鼠神經肽和神經傳導速度的影響[J].中華神經醫學雜志,2013,12(8):779-782.
[7]韓紅,李燕.鼠神經生長因子對糖尿病周圍神經病變患者神經傳導速度和血清IGF-1的影響[J].中國實用醫刊,2014,41(20):85-87.
[8]黃昭瑄,尹秀英,黃昭穗,等.外源性神經生長因子對糖尿病周圍神經病變的療效觀察[J].臨床軍醫雜志,2010,28(4):573.
[9]徐莉,饒春明.神經生長因子的研究進展[J].中國生物制品學雜志,2014,27(1):131-134.
[10]未名生物工程有限公司.一種目的蛋白制備方法及其用途[P].CN201210467001.8
[11]穆曉紅,劉銅華,秦靈靈,等.從血液流變學和坐骨神經傳導速度評價中藥糖痹康對大鼠糖尿病周圍神經病變的影響[J].中華中醫藥雜志,2012,27(2):378-381.
[12]封衛毅,侯家玉,王晶,等.甲鈷胺,格列齊特及其聯合用藥對糖尿病周圍神經病變大鼠坐骨神經功能和多元醇代謝通路的影響[J].中國藥學雜志,2004,39(1):27-30.
[13]Li G,Sun C,Wang Y,et al.A Clinical and Neuropathological study of Chinese patients with diabetic peripheral neuropathy[J].PloSOne,2014,9(3):e91772.
[14]Vinik AI,Shapiro DY,Rauschkolb C,et al.A randomized withdrawal,placebo-controlled study evaluating the efficacy and tolerability of tapentadol extended release in patientswith chronic painful diabetic peripheral neuropathy[J].Diabetes Care,2014,37(8):2302-2309.
[15]Stavniichuk R,Shevalye H,Hirooka H,et al.Interplay of sorbitol pathway of glucose metabolism,12/15-lipoxygenase,and mitogen-activated protein kinases in the pathogenesis of diabetic peripheral neuropathy[J].Biochemical Pharmacology,2012,83(7):932-940.
[16]Van Dam PS,Cotter MA,Bravenboer B,et al.Pathogenesis of diabetic neuropathy:focus on neurovascularmechanisms[J].European journal of Pharmacology,2013,719(1):180-186.
[17]Sima A,Zhang W.Mechanisms of diabetic neuropathy:axon dysfunction[J].Handbook of Clinical Neurology,2013,126:429-442.
[18]Snedecor SJ,Sudharshan L,Cappelleri JC,et al.Systematic review and reta-analysis of pharmacological therapies for painful diabetic peripheral neuropathy[J].Pain Practice,2014,14(2):167-184.
[19]賈全心.依帕司他治療糖尿病周圍神經病變療效觀察[J].中國醫藥,2012,7(z1):79-80.
[20]鄔磊,劉鵬鷹.依帕司他治療糖尿病周圍神經病變大鼠的療效評價[J].實用臨床醫藥雜志,2013,17(13):4-8.
[21]Hotta N,Akanuma Y,KawamoriR,et al.Long-term clinical effects of Epalrestat,an aldose reductase inhibitor,on diabetic peripheral neuropathy:the 3-year,multicenter,comparative aldose reductase inhibitor-diabetes complications trial[J].Diabetes Care,2006,29(7):1538-1544.
[22]鄭海燕,程長明.依帕司他片聯合甲鈷胺穴位注射治療糖尿病周圍神經病變[J].中國醫藥,2012,7(12):1608.
Therapeutic effect of recombinant human nerve grow th factor on rats w ith diabetic peripheral neuropathy
BAIYang ZHANG Yonglei HUANG Fenfei CHEN Shengliang RUAN Ka CHEN Xing▲
SinoBioway Biomedicine Co.,Ltd.,Fujian Province,Xiamen 361009,China
Ob jective To observe the therapeutic effect of recombinant human nerve growth factor(rhNGF)on diabetic peripheral neuropathy(DPN)rats.Methods Healthy adultmale SD rats were induced to diabetes rats by intramuscular injection of streptozotocin.After amonth,rats with the tail sensory nerve conduction velocity(SNCV)<30 m/s were confirmed as DPN model rats.DPN ratswere random ly divided into six groups,including themodel control group,the investigational drug rhNGFⅠ,Ⅱ,Ⅲ,Ⅳ(doses of 0.3,1,3,9μg/kg)4 dose groups and the positive control group (epalrestat 15mg/kg),concomitantly with the normal control group.During the administration of 2 months,body weight of ratswere detected weekly,blood glucose and SNCV monthly,sciatic nerve conduction velocity(MNCV)was detected after the last administration,and levels of sorbitol and fructose in sciatic nerve were last measured.Resu lts Body weight,blood glucose,SNCV and MNCV of themodel control group were significantly different with the normal control group after amonth(P<0.01),showed that the successfulmodeling of DPN.The investigated drug rhNGF and the positive drug epalrestat had no significant effect on body weight and blood glucose of DPN rats(P>0.05),but improved SNCV and MNCV.At 2 month,SNCV in rhNGF group(Ⅲ)and MNCV in rhNGF group(Ⅱ,Ⅲ)were significantly higher than themodel control group(P<0.05).Levels of fructose and sorbitol in sciatic nerve raised in DPN rats,indicated the relationship between DPN and polyolmetabolism.rhNGF reduced fructose and sorbitol in sciatic nerve,with dose effect in fructose but not in sorbitol.Conclusion rhNGF has a significant protective effect on nerve of DPN rats, whichmay be associated with improvement of polyolmetabolism similar with epalrestat.
Diabetes mellitus;Diabetic peripheral neuropathy;Recombinant human nerve growth factor; Nerve conduction velocity;Sorbitol;Fructose
R745
A[文獻標識碼]1673-7210(2015)06(c)-0004-05
2015-03-23本文編輯:任念)
國家“重大新藥創制”科技重大專項(2011ZX09 401-017)。
▲通訊作者

