煙酰胺腺嘌呤二核苷酸磷酸氧化酶對血管疾病病理過程的影響
孫 濤 楊蒙蒙 朱寶義 張 琰▲
1.第四軍醫(yī)大學唐都醫(yī)院藥學部,陜西西安 710038;2.第四軍醫(yī)大學唐都醫(yī)院眼科,陜西西安 710038
活性氧(ROS)是細胞中調控許多生理和病理過程的重要分子。ROS 涉及正常細胞功能和疾病發(fā)展的機制, 消除ROS 的策略必須考慮到它們對器官正常功能的關鍵性影響。 然而,過量的產生ROS 涉及到很多疾病。動物模型和臨床研究均證實血管壁中過量產生的ROS 與動脈粥樣硬化、心衰、高血壓和斑塊的穩(wěn)定性密切相關[1]。 一般而言,有兩種清除自由基的方式:①給予抗氧化劑或刺激內源性抗氧化系統(tǒng)消除自由基; ②通過抑制產生ROS 的酶干擾氧化應急激的發(fā)生。 第一種方式已被廣泛用于基礎和臨床研究,然而卻沒有獲得預期的對心血管系統(tǒng)的保護作用;而后一種方式被認為可提高血管功能,但需進一步明確潛在的機制和氧化應激的本質。
1 氧化應激的損傷作用
ROS 對心血管系統(tǒng)的病理作用源于其對血管細胞功能的影響,及其可消除某些血管保護性成分。 內皮釋放的舒張因子(EDRF)和超氧陰離子(O2-·)之間的相互作用發(fā)生非常迅速,這使得一氧化氮(NO)沒有機會發(fā)揮生物作用。目前認為這種相互作用是內皮功能異常的最常見機制,該機制使血管內皮細胞不能為血管壁提供血管保護性因子[2-3]。ROS 對血管平滑肌細胞和纖維母細胞的直接作用在心血管疾病的早期階段也發(fā)揮重要作用。 一些ROS 對血管可發(fā)揮直接調節(jié)作用,另一些ROS 通過對蛋白、脂質和DNA 的毒性氧化而發(fā)揮調節(jié)作用。 過量產生的ROS 導致血管再生和細胞增殖,同時激活大量的前炎癥基因[4]。此外,ROS 也在關鍵的信號通路中發(fā)揮作用。 在生理濃度時ROS 激活受體酪氨酸激酶和轉錄因子誘導抗氧化基因的表達,伴隨著其他氧化還原敏感性轉錄因子的活化,影響細胞和組織的功能[5]。
2 抗氧化維生素缺乏臨床有效性
離體和動物研究均證明維生素E、維生素C 和維生素A 具有抗氧化活性[6-7],同時考慮到ROS 在心血管系統(tǒng)疾病中的作用。 因此,引入抗氧化維生素用于血管藥理學研究是合理的。 然而,隨機臨床研究所得數據卻具有爭議性。糖尿病、高膽脂醇血癥、高同型半胱氨酸血癥患者和吸煙者給予抗氧化劑可以改善血流介導的舒張(FMD)和血管內皮功能異常[8]。但是,進一步研究顯示單一消除ROS 不能有效地阻止心血管疾病的病理過程[9]。 多中心臨床研究沒有證實維生素E 在動脈粥樣硬化病理過程或主要心血管事件中的保護作用。 事實上,Meta 分析揭示給予維生素E 的劑量超過400 IU/d 可能增加心血管疾病患者的死亡風險[10]。
抗氧化劑清除ROS 缺乏臨床有效性的可能原因。 抗氧化劑可消除部分ROS,但不能消除過量產生的ROS,因此整個病理過程依然可以繼續(xù)。此外,抗氧化劑,包括維生素,與O2-·之間的相互作用比NO 慢一百萬倍。 結果,超氧自由基與NO 的相互作用是一個熱力學的過程,導致了NO 生物活性的喪失。 也有研究顯示維生素不能充分滲入血管壁,因此它們可能在血漿中達到治療水平,但在組織中不能達到治療水平。最后,維生素E 和O2-·相互作用可以形成自由基。這種自由基分子在給予維生素C 或輔酶Q 的情況下可轉變?yōu)榫S生素E。 然而,研究證實聯(lián)合使用維生素E 和C 不能增強臨床有效性。
由于臨床研究沒有證實抗氧化維生素治療心血管疾病的有效性,這使人們意識到現有關于氧化應激的理解可能并不完全正確。 然而,在考慮治療心血管疾病時依然不能忽視它們[11]。
3 氧化應激發(fā)生的復雜分子機制——煙酰胺腺嘌呤二核苷酸磷酸(NADPH)氧化酶的中心作用
ROS 主要來源于氧化還原酶,如NADPH(nicotinamide adenine dinucleotide phosphate)氧化酶、黃嘌呤氧化酶、脂氧化酶和環(huán)氧合酶。同時,應該注意到這些來源(酶)之間的相互影響。 目前認為NADPH 氧化酶和黃素氧化酶將O2轉化為O2-·是這些事件的中心環(huán)節(jié)。 產生ROS 的氧化酶可以被其他來源的ROS 修飾。 一些氧化酶結構的變化導致NADPH 氧化酶產生過量的ROS,而過量的ROS 導致它們功能的異常,并進一步促進ROS 的生成, 形成氧化應激的惡性循環(huán)(圖1)。 例如,巰基可逆的氧化隨后發(fā)生不可逆的蛋白水解修飾,轉換黃嘌呤脫氫酶(參與嘌呤代謝)轉變?yōu)楫a生ROS 的黃嘌呤氧化酶。 這種轉變導致了分子量明顯的變化 (圖1)。 這種現象在許多血管疾病狀態(tài)、糖尿病、動脈粥樣硬化中被發(fā)現[3,12]。
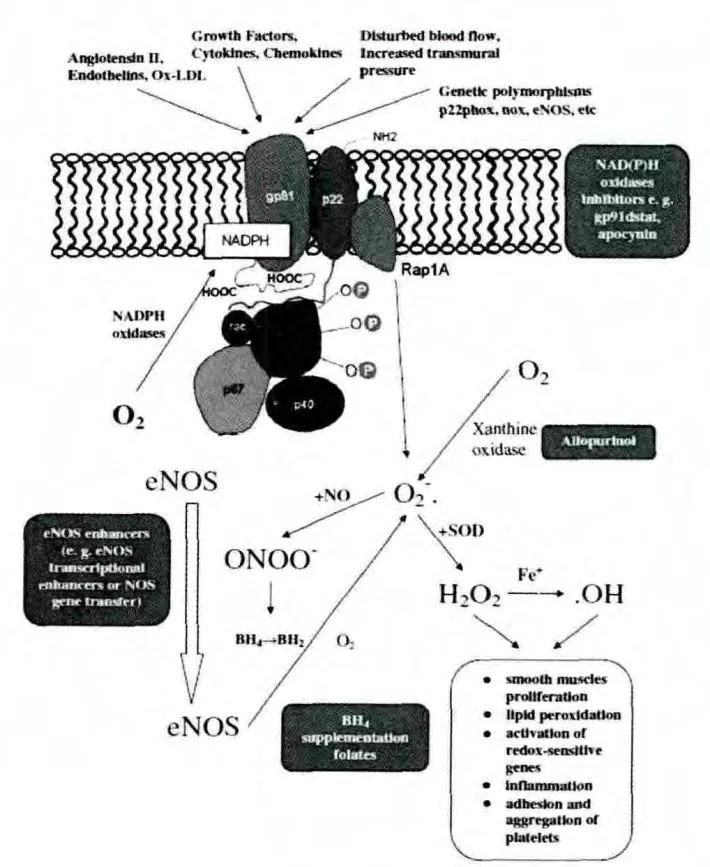
圖1 NADPH 氧化酶在血管氧化應激和內皮功能異常發(fā)病機制中的中心作用
ROS 具有平行雙向活性,Nox 蛋白可以發(fā)揮保護和損傷作用。 ROS 是調節(jié)血管張力、基因表達、增殖、遷移和分化的重要信號分子。 另一個方面,心血管危險因素和血管疾病促進ROS 的產生而加快動脈粥樣硬化、血管功能異常、高血壓、血管肥大和血栓的病理過程。 因此,有效地抑制NADPH 氧化酶對于理解其結構、活性和功能非常重要[13]。
4 NADPH 氧化酶結構和激活
NADPH 氧化酶家族包括多個同源物, 它們的表達、結構和功能各異。 簡要來說,這些同源物包括Nox1、Nox2、Nox3、Nox4、Nox5、Duox1 和Duox2。 Nox 亞型包含一個FAD 和NADPH 結合位點, 兩個血紅素分子和6 個跨膜結構域。Duox 亞型也包含同樣的結構域;然而, 有一個7 次跨膜的結構域并具有過氧化物酶同源性[14]。
NADPH 氧化酶在不同的血管細胞中的表達各異。Nox1 和Nox5 分別主要表達于血管平滑肌細胞和內皮細胞[15]。 Nox2 在內皮細胞、外膜纖維細胞和血管平滑肌細胞中被發(fā)現。 而上述所有細胞中均有Nox4的表達。 重要的是在特定情況下,不同的類型細胞中一種以上的Nox 亞型被激活, 而促進氧化應激的發(fā)生, 并且在一些情況下不同的Nox 亞基可能相互作用。 Nox3 主要表達于內耳,包括螺旋神經節(jié)、耳庭和耳蝸上皮細胞。 Duox1 和Duox2 表達水平很高,特別是在甲狀腺,參與了甲狀腺激素的氧化[14]。 同系物分布部位的不同可能與它們在健康和疾病中發(fā)揮的作用不同相關。血管NADPH 氧化酶,特別是Nox1、Nox2和Nox5, 通過單一電子轉移產生ROS 而主要產生O2-·。 Nox4 是一個例外,因為它的E 環(huán)有一個特殊的改變,可以產生過氧化氫H2O2,盡管Nox4 的生物學特征依然有爭議。 H2O2是一個重要的血管擴張劑,它可以產生內皮依賴性舒張反應, 并可降低小鼠的血壓。H2O2可增加內皮細胞NOS 的表達和活性,并可直接氧化蛋白激酶Giα 亞基,產生血管舒張作用[15]。 此外,目前認為Nox 不同亞型在動脈粥樣硬化的發(fā)展過程中表達的部位不同。 Nox4 可以增加動脈粥樣硬化斑塊的穩(wěn)定性, 在斑塊發(fā)展的早期階段Nox2 似乎對動脈粥樣硬化的進展起關鍵作用, 而Nox5 也可表達于人類動脈粥樣硬化斑塊不穩(wěn)定的位置[16]。
5 NADPH 氧化酶信號通路和調節(jié)的復雜性
NADPH 氧化酶的活性可被因子、激素、剪切應力、血流停止、凝血酶、5-羥色胺、內皮素-1、血管緊張素Ⅱ、組胺、緩激肽、溶血磷脂酸、佛波醇(PMA)、前列腺素F2α(PGF2α)和鞘氨醇1-磷酸等所影響。近期的研究重點是葡萄糖的刺激作用、 高級糖化產物(AGE)、非酯化脂肪酸(NEFAs)、腫瘤壞死因子和氧化低密度脂蛋白(ox-LDL)對NADPH 氧化酶活性和表達的影響[17-18]。
刺激細胞膜表面的受體, 如血管緊張素Ⅱ受體,可激活NADPH 氧化酶。血管緊張素Ⅱ結合AT1 受體后導致磷脂酶C(PLC)和磷脂酶D(PLD)的激活。 兩者都可以產生二酰甘油(DAG),而PLC 還可以產生三磷酸肌醇(IP3)。DAG 和IP3 誘導了鈣離子的釋放,而激活蛋白激酶C(PKC)。 PKC 磷酸化p47phox 亞基需要其他因子與該亞基的結合,而激活NADPH 氧化酶。 NADPH 氧化酶同樣也可以通過脂性第二信使激活氧化酶[17]。
同樣有一些反饋機制使NADPH 氧化酶的調節(jié)更加復雜。例如,過氧化氫激活c-Src(酪氨酸激酶,分子伴侶v-Src),這可能通過激活c-Abl 或導致表皮生長因子受體(EGFR)反式激活(激活PI3-激酶產生PIP3)增強NADPH 氧化酶活性,而對ROS 的產生起正反饋作用。 值得注意的是雖然NADPH 氧化酶影響其他氧化酶產生的ROS,而它們自身的活性也可以被其他氧化酶產生ROS 所影響[19]。
6 NADPH 氧化酶激活的分子后果
超氧陰離子,NADPH 氧化酶主要的產物, 與NO反應產生過氧硝酸鹽,這是內皮功能異常的主要特征性機制[20]。 超氧陰離子可自發(fā)或酶促變?yōu)楦€(wěn)定的H2O2。過氧化氫可被轉化為活性氮和活性氯而攻擊LDL 和HDL,促進斑塊的形成[21]。 H2O2可影響蛋白激酶和磷酸酶。H2O2通過鈍化磷酸酶和激活一些蛋白激酶調節(jié)蛋白的磷酸化。 一個公認的例子是細胞內ROS 的增加可能抑制酪氨酸磷酸酶, 并增加酪氨酸激酶活性。這可能導致絲裂原激活蛋白激酶(MAPKs)磷酸化。而Akt 激酶(IP3-激酶下游)和半胱天冬酶-3 激活涉及細胞凋亡過程,并被ROS 調控[22]。
ROS 主要通過在DNA 結合域的關鍵氨基酸殘基上形成二硫鍵調控轉率因子活性或間接通過調節(jié)氧化還原信號通路(磷酸化/去磷酸化)而發(fā)揮作用。 激活的蛋白-1(AP-1)通過MAPKs 和NF-κB 通路發(fā)揮作用, 特別是通過ERK1/2 和c-jun N-端蛋白激酶(JNKs)導致前-炎癥基因的表達,伴隨細胞因子和趨化因子的生產[23]。而NF-κB 可誘導E-選擇素、細胞間黏附分子-1 (ICAM-1) 和血管細胞黏附分子-1(VCAM-1) 的表達而涉及單核細胞黏附到內皮細胞和它們的激活[24]。
除了調節(jié)細胞內的信號通路之外,ROS 促進了DNS、 脂質和蛋白的損傷。 ROS 誘導DNA 損傷激活poly(ADP-核糖)聚合酶(PARP),導致PKC 激活和進一步增強NF-κB 的活性[25]。
在上面描述的信號通路, 涉及其他中間蛋白,如細胞內還原因子(谷胱甘肽、過氧化氫酶、氧化酵素和SOD)[26]。
通過這些分子機制,ROS 影響血小板聚集、 單核細胞遷移、 脂質過氧化和氧化還原敏感性基因的表達。 ROS 也涉及調節(jié)內皮功能異常、血管平滑肌細胞(VSMC)生長、增殖、分化、凋亡、遷移和免疫反應。 說明這些潛在的機制是發(fā)展新型治療動脈粥樣硬化和血管功能異常藥物最重要的第一步。
7 NADPH 氧化酶靶點
激活NADPH 氧化酶涉及復雜的機制,這些酶以不同活性水平被激活。首先,降低NADPH 氧化酶的表達可以抑制其活性。通過阻斷其細胞溶質亞單位轉移到細胞膜也可以降低NADPH 氧化酶的活性。 其他方式可能為通過使用PKC 抑制劑阻止p47phox 亞單位磷酸化,或通過阻止p47phox 亞單位結合到其他亞單位。此外,通過減少信號傳導和抑制Rac1 移位已經被證實可以減少ROS 的產生[5]。 最后,需要特別重視的是策略目標不應該是抑制所有已知的氧化酶,而是抑制特定的NADPH 氧化酶亞型。 這些靶點可以幫助指導研究新型的NADPH 氧化酶抑制劑。
ROS 在調控血管組織的許多生理和病理過程中發(fā)揮重要作用。 近年隨著對氧化應激本質認識的深入, 對ROS 在血管疾病中的意義也有了進一步的理解。 NADPH 氧化酶是血管中ROS 的主要來源,因此對NADPH 氧化酶的研究,將揭示血管疾病新的病理生理機制和防治途徑。
[1] Guzik B,Chwala M,Matusik P,et al.Mechanisms of increased vascular superoxide production in human varicose veins[J].Pol Arch Med Wewn,2011,121(9):279-286.
[2] Gryglewski RJ,Palmer RM,Moncada S. Superoxide anion is involved in the breakdown of endothelium-derived vascular relaxing factor [J]. Nature,1986,320 (6061):454-456.
[3] Cahill-Smith S,Li JM. Oxidative stress,Redox signalling and endothelial dysfunction in ageing-related neurodegenerative diseases:a role of nadph oxidase 2 [J]. Br J Clin Pharmacol,2014,78(3):441-453.
[4] Gao L,Mann GE. Vascular NAD (P)H oxidase activation in diabetes: a double-edged sword in redox signalling [J].Cardiovasc Res,2009,82(1):9-20.
[5] Guzik TJ,Harrison DG. Vascular nadph oxidases as drug targets for novel antioxidant strategies [J]. Drug Discov Today,2006,11(11-12):524-533.
[6] Anderson D,Phillips BJ. Comparative in vitro and in vivo effects of antioxidants [J]. Food Chem Toxicol,1999,37(9-10):1015-1025.
[7] Kim H,Bae S,Kim Y,et al. Vitamin C prevents stress-induced damage on the heart caused by the death of cardiomyocytes,through down-regulation of the excessive production of catecholamine,TNF-alpha,and ROS production in Gulo (-/-)Vit C-insufficient mice [J]. Free Radic Biol Med,2013,65:573-583.
[8] Heitzer T,Schlinzig T,Krohn K,et al. Endothelial dysfunction,oxidative stress,and risk of cardiovascular events in patients with coronary artery disease [J]. Circulation,2001,104(22):2673-2678.
[9] Harrison DG,Gongora MC,Guzik TJ,et al. Oxidative stress and hypertension [J]. J Am Soc Hypertens,2007,1(1):30-44.
[10] Miller ER3rd,Pastor-Barriuso R,Dalal D,et al. Metaanalysis: high-dosage vitamin e supplementation may increase all-cause mortality[J].Ann Intern Med,2005,142(1):37-46.
[11] Micheletta F,Natoli S,Misuraca M,et al. Vitamin E supplementation in patients with carotid atherosclerosis: reversal of altered oxidative stress status in plasma but not in plaque [J]. Arterioscler Thromb Vasc Biol,2004,24(1):136-140.
[12] Cai H,Harrison DG. Endothelial dysfunction in cardiovascular diseases: The role of oxidant stress [J]. Circ Res,2000,87(10):840-844.
[13] Du Z,Yang Q,Liu L,et al. NADPH oxidase 2-dependent oxidative stress,mitochondrial damage and apoptosis in the ventral cochlear nucleus of D-galactose-induced aging rats [J]. Neuroscience,2015,286:281-292.
[14] Bedard K,Krause KH. The nox family of ROS-generating NADPH oxidases: physiology and pathophysiology [J].Physiol Rev,2007,87(1):245-313.
[15] Takac I,Schroder K,Brandes RP.The nox family of NADPH oxidases:friend or foe of the vascular system?[J].Curr Hypertens Rep,2012,14(1):70-78.
[16] Guzik TJ,Chen W,Gongora MC,et al. Calcium-dependent Nox5 nicotinamide adenine dinucleotide phosphate oxidase contributes to vascular oxidative stress in human coronary artery disease [J]. J Am Coll Cardiol,2008,52(22):1803-1809.
[17] Ray R,Shah AM. NADPH oxidase and endothelial cell function [J]. Clin Sci(Lond),2005,109(3):217-226.
[18] Mouzaoui S,Djerdjouri B,Makhezer N,et al.Tumor necrosis factor-alpha-induced colitis increases NADPH oxidase 1 expression,oxidative stress,and neutrophil recruitment in the colon: preventive effect of apocynin [J]. Mediators Inflamm,2014,2014:312484.
[19] Rouaud F,Romero-Perez M,Wang H,et al. Regulation of NADPH-dependent nitric oxide and reactive oxygen species signalling in endothelial and melanoma cells by a photoactive nadph analogue [J].Oncotarget,2014,5(21):10650-10664.
[20] Guzik TJ,West NE,Pillai R,et al. Nitric oxide modulates superoxide release and peroxynitrite formation in human blood vessels [J]. Hypertension,2002,39(6):1088-1094.
[21] Lyle AN,Griendling KK. Modulation of vascular smooth muscle signaling by reactive oxygen species [J]. Physiology(Bethesda),2006,21:269-280.
[22] Irani K. Oxidant signaling in vascular cell growth,death,and survival:a review of the roles of reactive oxygen species in smooth muscle and endothe lial cell mitogenic and apoptotic signaling [J]. Circ Res,2000,87(3):179-183.
[23] Sato A,Okada M,Shibuya K,et al. Pivotal role for ros activation of p38 MAPK in the control of differentiation and tumor-initiating capacity of glioma-initiating cells [J].Stem Cell Res,2014,12(1):119-131.
[24] Abe J,Berk BC. Reactive oxygen species as mediators of signal transduction in cardiovascular disease [J]. Trends Cardiovasc Med,1998,8(2):59-64.
[25] Brownlee M. The pathobiology of diabetic complications:a unifying mechanism [J]. Diabetes,2005,54(6):1615-1625.
[26] Guzik TJ,Olszanecki R,Sadowski J,et al. Superoxide dismutase activity and expression in human venous and arterial bypass graft vessels[J].J Physiol Pharmacol,2005,56(2):313-323.

