Nrf2—ARE通路在帕金森病大鼠黑質中的表達改變
蘇軍紅 祁秀峰 申向輝 趙麗香 胡彥峰 王偉
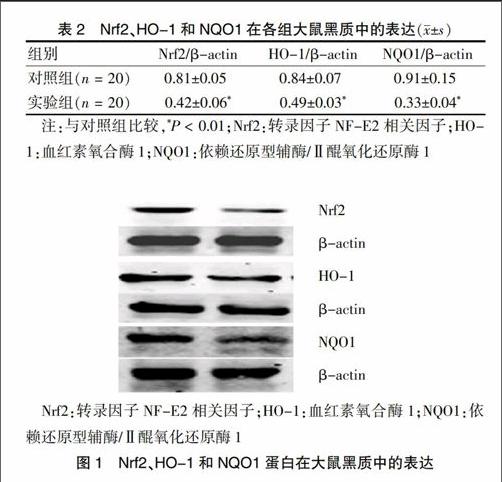

[摘要] 目的 觀察由魚藤酮制備的帕金森病(PD)大鼠模型黑質多巴胺能神經元中氧化應激參數、轉錄因子NF-E2相關因子(Nrf2)及其基因產物血紅素氧合酶1(HO-1)和依賴還原型輔酶/Ⅱ醌氧化還原酶1(NQO1)的表達變化情況。 方法 將健康成年雄性Wistar大鼠40只隨機分為對照組和實驗組,20只對照組大鼠給予背部皮下注射葵花油[1 mL/(kg·d)],20只實驗組大鼠,按照2.0 mg/(kg·d)背部皮下注射魚藤酮(魚藤酮溶解在葵花籽油中)制備PD大鼠模型,共30 d。最后一次注射結束后實驗大鼠迅速斷頭取材,采用分光光度法檢測大鼠腦內紋狀體中丙二醛(MDA)和還原型谷胱甘肽(GSH)含量變化,采用Western blot檢測兩組大鼠中腦黑質中Nrf2、HO-1和NQO1的表達。 結果 對照組和實驗組腦內紋狀體中MDA含量分別為(6.51±1.45)、(18.13±2.14)nmol/mgprot,與對照組比較,實驗組大鼠紋狀體中MDA升高了64.09%(P < 0.01)。對照組和實驗組紋腦內狀體中GSH含量分別為(44.53±4.71)、(26.41±2.52)mg/gprot,與對照組比較,實驗組大鼠紋狀體中GSH降低了40.69%(P < 0.01)。對照組大鼠中腦黑質中Nrf2、HO-1和NQO1與β-actin免疫印跡條帶相對吸光度比值分別為(0.81±0.05)、(0.84±0.07)和(0.91±0.15),實驗組大鼠中腦黑質中Nrf2、HO-1和NQO1與β-actin免疫印跡條帶相對吸光度比值分別為(0.42±0.06)、(0.49±0.03)和(0.33±0.04)。與對照組比較,實驗組大鼠黑質神經元中Nrf2、HO-1和NQO1表達分別降低了48.15%、41.67%和63.74%(P < 0.01)。 結論 氧化應激在PD發病中起著非常重要的作用,內源性抗氧化損傷通路Nrf2-ARE與PD的發病關系密切,可能是PD新的治療靶點。
[關鍵詞] 帕金森病;氧化應激;轉錄因子NF-E2相關因子-抗氧化反應元件;血紅素氧合酶1;依賴還原型輔酶/Ⅱ醌氧化還原酶1
[中圖分類號] R742.1 [文獻標識碼] A [文章編號] 1673-7210(2014)12(b)-0008-04
帕金森病(Parkinson's disease,PD)是中老年人群中較為常見的中樞神經系統變性疾病,其主要的特征性病理變化是中腦黑質多巴胺能神經元變性壞死及Lewy小體形成,導致腦內多巴胺神經遞質含量減少,主要臨床癥狀為運動障礙,表現為靜止性震顫、肌張力增高、運動遲緩等。既往研究結果表明,許多慢性疾病都與人體內發生氧化應激導致體內累積過多的氧自由基有關,氧自由基在PD中腦黑質多巴胺能神經元死亡過程中起著非常至關重要的作用,抗氧化治療PD已成為新療法中的重要研究方向[1-2]。
轉錄因子NF-E2相關因子(NF-E2-related factor 2,Nrf2)是細胞氧化應激反應中的關鍵因子,通過與抗氧化反應元件(antioxidant response element,ARE)相互作用調節抗氧化蛋白和Ⅱ相解毒酶的表達。Nrf2是機體調節抗氧化反應的重要轉錄因子,正常情況位于細胞漿中,在細胞漿中與Keapl結合形成復合體,且被泛素蛋白酶迅速降解,從而保持其低活性的生理狀態。當機體受到氧自由基和內源性毒素等攻擊后Nrf2與Keapl解離,其半衰期明顯延長,然后轉位進入細胞核,與抗氧化反應元件ARE結合后誘導抗氧化蛋白和Ⅱ相解毒酶基因的表達。Nrf2-ARE通路是目前發現的最為重要的內源性抗氧化損傷通路之一。
血紅素氧合酶1(heme oxygenase-1,HO-1)和依賴還原型輔酶/Ⅱ醌氧化還原酶1[NAD(P)H:quinone oxidoreductase-1,NQO1]是Nrf2-ARE通路編碼的內源性保護基因,在抗氧化損傷方面起著重要作用。在中樞神經系統上調HO-1和NQO1的表達,能夠減少氧自由基和內源性毒素對神經元的毒性作用。既往研究證實,激活Nrf2-ARE信號通路上調其基因產物的表達對神經系統疾病如癲癇、腦出血、腦梗死和腦外傷等,具有很強的神經保護功能[2]。但是,Nrf2-ARE信號通路在PD發病中表達改變還未見明確相關報道。本研究利用魚藤酮制備PD大鼠模型,觀察大鼠腦內黑質中Nrf2及其基因產物HO-1和NQO1的表達改變。
1 材料與方法
1.1 實驗動物分組和動物模型的制備
雄性Witstar大鼠40只,體重250~300 g,由河北醫科大學實驗動物中心提供。將40只Witstar大鼠隨機分為對照組和實驗組;20只對照組大鼠給予背部皮下注射葵花油1 mL/(kg·d),20只實驗組大鼠,按照2.0 mg/(kg·d)背部皮下注射魚藤酮(魚藤酮溶解在葵花籽油中,充分震蕩混勻后4℃避光保存),共30 d。大鼠飼養于晝夜交替的環境中,期間自由進食進水。
1.2 實驗動物腦內紋狀體中氧化應激參數丙二醛(MDA)和谷胱甘肽(GSH)含量測定
最后1次藥物注射結束后24 h,大鼠直接斷頭取腦,在冰盤上迅速分離紋狀體,4℃生理鹽水沖洗血液,液氮速凍,于-80℃低溫冰箱保存用于測量氧化應激參數(MDA和GSH)。具體實驗方法按所購試劑盒說明書進行。
1.3 Western blott檢測兩組大鼠中腦黑質中Nrf2、HO-1和NQO1的表達
最后1次藥物注射結束后24 h,大鼠直接斷頭取腦,在冰盤上迅速分離黑質所在腦塊,4℃生理鹽水沖洗血液,入液氮速凍后置-80℃低溫冰箱保存備用。取所需腦組織入4℃裂解液勻漿5 min,冰浴靜置1 h,4℃ 2000 r/min離心5 min,取上清,Bradford法測定蛋白濃度。相關樣品取50 μg總蛋白經10% SDS-PAGE凝膠電泳分離,電轉移至PVDF膜上,用5%脫脂奶粉室溫封閉2 h后,依照實驗目的分別加入5%脫脂奶粉稀釋的兔Nrf2、HO-1和NQO1單克隆抗體(1∶1000),4℃過夜。PVDF膜以TTBS洗3次。山羊抗兔IgG 熒光抗體(1∶10000,Rocland公司)室溫避光1 h,漂洗5次,遠紅外熒光掃描成像系統(Odyssey公司) 掃描并測定目標蛋白單位光密度值,與β-actin(1∶5000,Santa Cruz)比值后,做統計學分析。
1.4 統計學方法
采用SPSS 13.0統計學軟件進行數據分析,計量資料數據用均數±標準差(x±s)表示,兩組間比較采用t檢驗,以P < 0.05為差異有統計學意義。
2 結果
2.1 一般狀況
與對照組相比,實驗組大鼠毛色變黃、變臟,體態呈弓背狀,行為上表現為主動活動減少、動作遲緩、步態不穩、行走時多向一側旋轉。兩組在第10、13、15、19 d時各死亡1只大鼠。
2.2 實驗大鼠紋狀體中氧化應激參數的改變
實驗組腦內紋狀體中MDA含量與對照組比較,實驗組大鼠紋狀體中MDA升高了64.09%(P < 0.01)。實驗組紋腦內狀體中GSH含量與對照組比較,實驗組大鼠紋狀體中GSH降低了40.69%,差異均有高度統計學意義(P < 0.01)。見表1。
2.3 Nrf2、HO-1和NQO1在實驗大鼠黑質中的表達
與對照組比較,實驗組大鼠黑質神經元中Nrf2、HO-1和NQO1表達分別降低了48.15%、41.67%和63.74%,差異均有高度統計學意義(P < 0.01)。見表2、圖1。
3 討論
PD是中老年人群中比較常見的神經系統變性疾病,其主要的病理改變是中腦黑質內多巴胺能神經元漸進性受損,導致腦內多巴胺神經遞質含量減少,從而出現一系列以運動障礙為主要表現的臨床綜合征。基礎醫學和生命科學領域近年的研究結果表明,許多慢性疾病都與人體內累積過多的自由基有關,PD與自由基及氧化應激之間的關系日益成為人們研究的熱點。目前大量的研究證實氧化應激產生的氧自由基損傷為PD發病的重要病理機制[3-4]。機體生理狀態下,體內自由基的產生和清除處于平衡狀態,當這種平衡被打破,自由基蓄積過多,就會導致氧化損傷,即所謂氧化應激。氧化損傷使脂質、蛋白質和DNA過氧化,最終導致細胞死亡[5-6]。眾所周知,中樞神經系統含有豐富的脂質成分,耗氧量最高且抗氧化酶相對缺乏,所以對自由基損傷特別敏感[7]。綜上所述,本研究組有理由認為抗氧化、清除氧自由基的治療方法能為PD的藥物治療提供新的靶點。
魚藤酮是來源于自然界中某些植物根莖的天然殺蟲劑,近年被廣泛應用于果蔬和池塘殺蟲等農業生產。最近研究發現,魚藤酮對中腦黑質多巴胺能神經元具有明顯的神經毒性作用[8],大鼠長期接觸魚藤酮可出現PD樣癥狀及帕金森病理性改變[9]。本次實驗結果發現魚藤酮處理后實驗大鼠出現毛色變臟、自主活動減少、弓背屈曲姿勢、行走時向一側旋轉等PD樣癥狀,前期的研究已經證實,大鼠腦內黑質多巴胺能神經元數量明顯較少[10]。進一步研究發現,實驗大鼠腦內紋狀體中脂質代謝產物MDA含量明顯增高,自由基清除劑GSH含量明顯降低,表明大鼠腦內氧化平衡被破壞,發生了氧化應激損傷。
Nrf2是細胞氧化應激反應中的關鍵因子,在氧化應激狀態下,轉錄因子Nrf2從細胞質轉移入細胞核,與ARE結合調節抗氧化蛋白和Ⅱ相解毒酶的表達,從而增強細胞對氧化應激的抵抗能力,即Nrf2-ARE通路在這些機體防御機制中起著非常重要的作用[11-12]。Nrf2-ARE通路在抗感染、抗凋亡、抗腫瘤、抗動脈粥樣硬化、抗缺血再灌注損傷、肺纖維化和神經保護等方面發揮著廣泛的細胞保護功能。到目前為止,已證實經Nrf2-ARE信號路徑調節的可編碼內源性保護基因超過200個[13-14]。這些保護性基因包括抗氧化蛋白類基因、Ⅱ相解毒酶基因、分子伴侶類和抗炎因子類基因等。他們在增強組織抗氧化能力、保護組織免受毒物損傷、抗腫瘤、抗感染、抗凋亡中起著重要的作用。其中Nrf2-ARE通路的基因產物HO-1和NQO1在神經保護方面的作用尤其重要。近年研究證實,在脊髓側索硬化、癲癇、腦梗死、腦出血等神經系統疾病中上調Nrf2、HO-1或者NQO1的表達能起到神經保護作用[15-17],但是在PD大鼠模型中Nrf2、HO-1和NQO1的表達改變還未見明確報道。
綜上所述,本研究證實,在PD大鼠模型腦內氧化平衡狀態被破壞,脂質代謝產物MDA生成增加,自由基清除劑GSH含量減少。同時發現中腦黑質中Nrf2、HO-1和NQO1的表達明顯降低,這表明該抗氧化防御體系受到破壞,這可能是加重黑質多巴胺能神經元損傷的原因之一。Nrf2-ARE通路與PD的發病密切相關,激活該通路,誘導其基因產物的表達能夠保護中腦黑質多巴胺能神經元,從而延緩PD的病情進展,后期將會進一步研究證實該推斷。
[參考文獻]
[1] Taylor JM,Main BS,Crack PJ. Neuroinflammation and oxidative stress:co-conspirators in the pathology of Parkinson's disease [J]. Neurochem Int,2013,62(5):803-819.
[2] Lu C,Zhang J,Shi X,et al. Neuroprotective effects of tetramethylpyrazine against dopaminergic neuron injury in a rat model of Parkinson's disease induced by MPTP [J]. Int J Biol Sci,2014,10(4):350-357.
[3] Sanders LH,Timothy GJ. Oxidative damage to macromolecules in human Parkinson disease and the rotenone model [J]. Free Radic Biol Med,2013,62(9):111-120.
[4] Miklya I,Goltl P,Hafenscher F,et al. The role of parkin in Parkinson's disease [J]. Neuropsychopharmacol Hung,2014, 16(2):67-76.
[5] González J,Valls N,Brito R,et al. Essential hypertension and oxidative stress:new insights [J]. World J Cardiol,2014, 6(6):353-366.
[6] Chege PM,McColl G. Caenorhabditis elegans:a model to investigate oxidative stress and metal dyshomeostasis in Parkinson's disease [J]. Front Aging Neurosci,2014,6(5):89.
[7] Davis J,Moylan S,Harvey BH,et al. Neuroprogression in schizophrenia:pathways underpinning clinical staging and therapeutic corollaries [J]. Aust N Z J Psychiatry,2014,48(6):512-529.
[8] Cannon JR,Tapias V,Na HM,et al. A highly reproducible rotenone model of Parkinson's disease [J]. Neurobiol Dis,2009,34(2):279-290.
[9] Xiong N,Huang J,Zhang Z,et al. Stereotaxical infusion of rotenone:a reliable rodent model for Parkinson's disease [J]. PLoS One,2009,18,4(11):e7878.
[10] 吳艷芬,王永春,蘇軍紅,等.魚藤酮對大鼠腦內多巴胺能神經元損傷的機制研究[J].腦與神經疾病雜志,2014,(2):124-126.
[11] Lee JM,Johnson JA. An important role of Nrf2-ARE pathway in the cellular defense mechanism [J]. J Biochem Mol Biol,2004,37(2):139-143.
[12] Zhang DD. Mechanistic studies of the Nrf2-Keap1 signaling pathway [J]. Drug Metab Rev,2006,38(4):769-789.
[13] Zhang M,An C,Gao Y,et al. Emerging roles of Nrf2 and phase Ⅱ antioxidant enzymes in neuroprotection [J]. Prog Neurobiol,2013,100(1):30-47.
[14] Gan L,Johnson JA. Oxidative damage and the Nrf2-ARE pathway in neurodegenerative diseases [J]. Biochim Biophys Acta,2014,1842(8):1208-1218.
[15] Petri S,Krner S,Kiaei M. Nrf2/ARE signaling pathway:key mediator in oxidative stress and potential therapeutic target in ALS [J]. Neurol Res Int,2012,2012:878030.
[16] Zhao J,Kobori N,Aronowski J,et al. Sulforaphane reduces infarct volume following focal cerebral ischemia in rodents [J]. Neurosci Lett,2006,393(2-3):108-112.
[17] Wang W,Wu Y,Zhang G,et al. Activation of Nrf2-ARE signal pathway protects the brain from damage induced by epileptic seizure [J]. Brain Res,2014,1544(1),54-61.
(收稿日期:2014-09-12 本文編輯:任 念)

