Nesfatin-1在抑郁癥發病中的作用研究進展
徐亞運,葛金芳,陳飛虎
(安徽醫科大學藥學院,安徽合肥 230032)
Nesfatin-1在抑郁癥發病中的作用研究進展
徐亞運,葛金芳,陳飛虎
(安徽醫科大學藥學院,安徽合肥 230032)
摘要:攝食抑制因子Nesfatin-1是由核組蛋白NUCB2的N端水解產生的由82個氨基酸組成的肽段。自2006年日本Oh-I教授首次報道Nesfatin-1廣泛表達于下丘腦以來,關于其生理功能的研究不斷深入。近期研究表明,除了參與攝食及能量代謝的調節之外,Nesfatin-1還參與情緒反應的中樞調控,與抑郁癥的發生密切相關。該文就Nesfatin-1的分布及其在抑郁癥發病機制的作用做一綜述,旨在明確Nesfatin-1的生理功能,也為進一步揭示抑郁癥的發病機制提供依據。
關鍵詞:Nesfatin-1;攝食行為調節;應激反應;下丘腦-垂體-腎上腺軸;抑郁;快感缺失;胰島素信號通路
網絡出版時間:2015-7-22 10:42 網絡出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20150727.0901.006.html
Nesfatin-1是新近發現的攝食抑制因子,是由nucleo-bindin2(NUCB2)N端水解產生的由82個氨基酸組成的肽段,2006年日本教授Oh-I最先報道其廣泛表達于下丘腦[1]。眾所周知,下丘腦是調節攝食、能量代謝和情緒反應的主要中樞結構之一,關于Nesfatin-1生物學活性的早期研究也多聚焦于攝食及能量代謝的調節。近期研究表明,Nesfatin-1可參與情緒反應的中樞調控,與抑郁癥的發病密切相關。本文主要就Nesfatin-1在抑郁癥發病中的作用綜述如下。
1 Nesfatin-1的發現和體內分布
Oh-I等[1]利用PPAR-γ激動劑曲格列酮作用于Q-5細胞株,發現9種基因可以被激活,其中編碼NEFA(DNA-bind-ing/EF-hand/acidic protein)/核組蛋白2(nucleobindin-2,NU-CB2)5’端非翻譯區的基因序列受其調節最為明顯。隨后將NUCB2蛋白注入大鼠側腦室,發現可以劑量和時間依賴性減少大鼠攝食量,遂將其命名為核組蛋白NUCB2。在轉化酶的作用下,NUCB2可以裂解為3個片段,將其N段82個氨基酸片段命名為Nesfatin-1。Nesfatin-1又可以分為3個片段,其中中間片段M30是Nesfatin-1發揮厭食作用的核心部位。
下丘腦室旁核(paraventricular nucleus,PVN)、弓狀核(arcuate nucleus,ARC)、室上核(supraoptic nucleus,SON)和下丘腦外側區(lateral hypothalamic area,LHA)被首先證明是Nesfatin-1產生的主要部位[1],而且Nesfatin-1在PVN和SON神經元中與抗利尿激素、促腎上腺皮質激素釋放激素(corticotropin releasing hormone,CRH)以及催產素共表達,在ARC神經元中與可卡因-苯丙胺調節轉錄肽(cocaine-and amphetamine-regulated transcript,CART)及酪氨酸羥化酶共表達,在LHA神經元與CART及黑素細胞凝集素(melanin-concentrating hormone,MCH)共表達[2]。隨后的研究表明[2-3],Nesfatin-1還廣泛存在于中腦等其他腦區,包括丘腦背內側、迷走神經運動背核(dorsal vagal complex,DVC)、動眼神經副核(Edinger-Westphal nucleus,E-W核)等。隨后,Stengel等[3]通過免疫組化發現大鼠的島葉皮質、中央杏仁核、延髓腹外側、小腦浦肯野細胞、腦的副交感神經和交感神經節前神經元以及腰椎和骶骨的脊髓中亦廣泛表達Nesfa-tin-1。并且在腦干的E-W核和DVC核Nesfatin-1與乙酰膽堿轉移酶共表達,在腦干的孤束核(nucleus of the solitary tract,NTS)與酪氨酸羥化酶共表達,在中縫核則與5-羥色胺(5-hydroxytryptamine,5-HT)共表達[2]。
除了廣泛表達于中樞神經系統之外,Nesfatin-1還被證明在胃腸道、脂肪組織、胰腺、睪丸和心臟等外周組織中表達,并且Nesfatin-1可以通過血腦屏障[4],提示了Nesfatin-1具有廣泛的生理作用。
2 Nesfatin-1與抑郁癥
抑郁癥是一種常見的情感障礙性疾病,主要表現為情緒低落、攝食行為改變、活動減少以及高度的自殺傾向。世界衛生組織的全球疾病負擔(global burden of disease,GBD)合作研究預測在2020年抑郁癥將成為全球首位疾病負擔。抑郁癥發病機制的“單胺神經遞質學說”認為包括5-HT在內的單胺類神經遞質的耗竭是導致抑郁癥發生的主要原因[5]。但以提高突觸間隙的單胺類神經遞質為目標的治療措施并非對所有的抑郁癥患者有效,而且存在治療潛伏期長、副作用大等缺陷[6]。因而,深入探索抑郁癥發病的機制成為神經科學重點關注的領域之一。
現代神經生物學研究結果表明,伴隨下丘腦-垂體-腎上腺軸(hypothalamic-pituitary-adrenal axis,HPA軸)過度激活的下丘腦多受體平衡紊亂是導致抑郁癥發病的主要原因之一[7],參與攝食調節的下丘腦相關信號分子可直接或通過調節HPA軸的活性參與抑郁癥的發病機制。研究表明,促黑素(melanocyte stimulating hormone,MSH)等攝食抑制因子與焦慮抑郁行為的產生密切相關,而促食素(orexin)等促進攝食因子則可改善焦慮抑郁相關行為。鑒于攝食抑制因子Nesfatin-1的主要生理學功能是參與攝食和代謝調控,近年來針對其與抑郁癥相互關系的研究逐漸增多。
2.1Nesfatin-1與攝食行為調節 攝食行為改變及其引發的體重改變及代謝紊亂是抑郁癥的主要臨床表現之一。研究發現[1],側腦室注射Nesfatin-1可劑量依賴性抑制大鼠對食物的攝取并導致體重減輕,且這一效應可被Nesfatin-1的抗體阻斷。Stengel等[8]的研究也證實,第4腦室以及腦池內注射Nesfatin-1可在較長時間內持續抑制大鼠夜間攝食行為。Shimizu等[9]的研究結果則表明,長期外周注射(腹腔注射或皮下注射)Nesfatin-1也可以劑量依賴性抑制自由飲食的ICR小鼠夜間攝食并減少體重增長。這些研究結果表明,無論是中樞還是外周注射Nesfatin-1都可抑制攝食行為,而且中樞效應遠遠強于外周[10]。
研究表明,Nesfatin-1可以在瘦素受體突變的Zurker大鼠中[1]以及瘦素抵抗的高脂肪飲食導致肥胖的大鼠[9]中發揮厭食效應,提示Nesfatin-1的攝食抑制作用可能不依賴瘦素信號途徑。進一步研究發現,Nesfatin-1的抑制攝食作用與應激反應以及情緒調控因子存在關聯。Oh-I等[1]通過中樞注射a-MSH發現PVN中NUCB2基因表達增加,并且該過程能夠被黑皮質素3/4受體特異性拮抗劑SHU9119抑制,提示Nesfatin-1可能通過中樞黑皮質素系統發揮其抑制攝食的作用。形態學研究結果證實,Nesfatin-1在下丘腦與MCH共定位表達,80%Nesfatin-1神經元分泌MCH,提示Nesfatin-1的抑制攝食效應可能通過抑制MCH的促進攝食行為實現[11]。然而,黑皮質素系統介導的厭食效應可以被CRH受體拮抗劑所阻斷,而且CRH的受體拮抗劑astressin-B2可以解除側腦室注射Nesfatin-1引起的飽腹感。因而,CRH可能作為中樞黑皮質素系統的下游因子來介導Nesfatin-1的抑制攝食行為[8]。
新近研究表明[12],Nesfatin-1可以增加下丘腦中CRH和促甲狀腺激素釋放激素(thyrotropin-releasing hormone,TRH)的水平,Nesfatin-1的厭食效應在使用CRH受體拮抗劑、TRH抗體以及敲除組胺受體的小鼠明顯減弱,而且在結節乳頭核(tuberomammillary nucleus,TMN)組胺神經元細胞膜上存在CRH受體1和TRH受體2,提示Nesfatin-1對攝食行為的抑制作用可能與其對CRH神經元、TRH神經元及TMN組胺神經元的調控有關。
2.2Nesfatin-1與抑郁相關行為
2.2.1應激刺激與Nesfatin-1表達 動物實驗及臨床研究[13]證實,應激性生活事件及其引發的HPA軸過度激活是抑郁癥發生的主要原因之一。研究表明,Nesfatin-1在中樞和外周均不同程度地參與了應激反應。束縛應激可導致大鼠SON、PVN、藍斑核(locus coeruleus,LC)、延髓中縫核(ros-tral raphe pallidus,rRPa)、NTS、延髓腹外側(ventrolateral me-dulla,VLM)中Nesfatin-1陽性神經元c-FOS表達上調,提示Nesfatin-1可能是應激反應中的響應因子[14]。急性束縛應激還能夠促進E-W核神經元共表達的尿皮質素、CART、Nes-fatin-1明顯升高。Konczol等[14]的研究結果則證實,Nesfatin-1在延髓可通過NA和催產素等信號傳遞分子與應激反應中心PVN產生聯系。其他幾種急性應激反應如強迫游泳[3]、腹部手術、腹腔注射脂多糖也能夠增加Nesfatin-1在中樞系統的表達(Tab 1)。這些研究結果表明,Nesfatin-1參與應激反應的中樞調節。
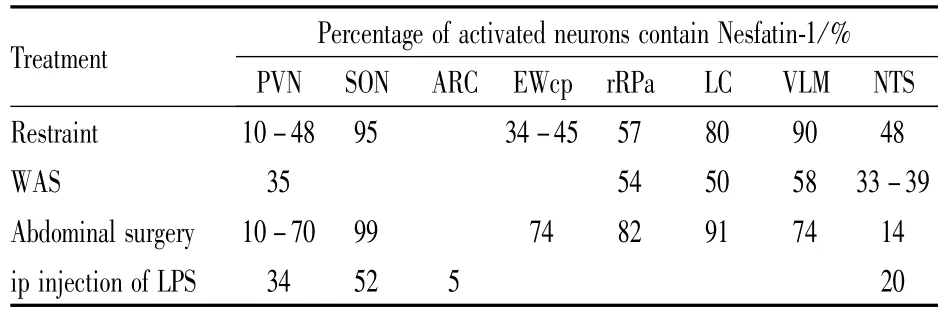
Tab 1 Activation of Nesfatin-1 containing neurons in brain induced by different stressors
慢性溫和不可預知應激模型(chronic unpredictable mild stress,CUMS)能夠較好地模擬人類抑郁癥發病的病理生理機制,再現抑郁相關行為,是研究抑郁癥發病機制和治療藥物篩選的主要動物模型之一。Xu等[15]采用冷水游泳、潮濕鼠籠、禁食禁水等慢性溫和應激刺激構建了大鼠CUMS模型,并且發現中腦E-W核中Nesfatin-1和CART神經元活動性增強,提示可能通過CART參與了慢性應激反應過程。
Albayrak等[16]的研究表明,燒傷感染的應激患者血漿中Nesfatin-1水平較對照組明顯降低,但隨燒傷治療后逐漸回升。Yoshida等[17]的研究則表明,急性束縛應激可導致下丘腦PVN、SON及中縫核、藍斑核等腦區Nesfatin-1表達上調,但血漿Nesfatin-1水平則無明顯改變。新近研究發現[18]腹腔注射Nesfatin-1可減少強迫游泳和束縛應激導致的胃酸分泌以及胃黏膜損傷。提示Nesfatin-1在外周也參與應激反應的病理生理過程。
以上研究結果表明,急性和慢性應激反應均可導致Nes-fatin-1的表達改變,而且Nesfatin-1參與應激反應的中樞和外周機制可能存在差異。
2.2.2Nesfatin-1干預與抑郁相關行為 行為學實驗研究證實,Nesfatin-1可誘導焦慮抑郁樣行為改變。Merali等[19]觀察了腦室內注射Nesfatin-1后大鼠在高架十字迷宮和新環境攝食抑制實驗中的表現,結果表明,中樞注射Nesfatin-1后大鼠在開放臂的逗留時間明顯減少,在新環境中對食物探索的潛伏期明顯升高,對食物的攝取量也明顯減少。提示中樞注射Nesfatin-1可誘導大鼠焦慮抑郁樣行為改變。
研究人員通過給大鼠側腦室注射Nesfatin-1發現可以激活CRH、去甲腎上腺素(noradrenaline,NA)和5-HT神經元,并且血漿ACTH和糖皮質激素的水平明顯升高,雙側腎上腺切除后PVN中NUCB2表達升高[17]。結果顯示Nesfatin-1激活了HPA軸,而HPA軸亢進作為目前抑郁癥發病機制中公認的機制之一,提示Nesfatin-1可能通過激活HPA軸來誘導抑郁行為的產生。
2.3Nesfatin-1與抑郁癥的臨床研究 臨床研究進一步探討了Nesfatin-1與抑郁癥之間的聯系。Ari等[20]的研究發現,與健康對照組比較,重癥抑郁癥患者血漿Nesfatin-1升高至接近2倍水平,而且血漿Nesfatin-1水平與患者在漢密頓抑郁量表(hamilton depression scale,HAMD)中的得分呈正相關。提示Nesfatin-1與抑郁存在聯系。
采用患者健康問卷(patient health questionnaire,PHQ-9)、廣泛性焦慮量表(generalized anxiety disorder question-naire,GAD-7)和感知應激量表(perceived stress question-naire,PSQ-20),Hofmann等[21]的研究表明,在焦慮和抑郁評價中得分高的患者其血漿NUCB2/Nesfatin水平明顯升高,血漿NUCB2/Nesfatin水平與PHQ-9、GAD-7和PSQ-20量表中的得分呈正相關,而與體質指數(body mass index,BMI)無關。進一步提示Nesfatin-1參與情緒反應的調節,可能參與抑郁癥的發病。
由于實驗對象的限制,并沒有大量資料對人類中樞的Nesfatin-1改變進行研究,所以這種現象的機制還不是很清楚。然而,最近一項研究發現[22],抑郁癥自殺患者的中樞Nesfatin-1水平發生了明顯改變,并表現出性別差異。與對照組比較,抑郁自殺的男性患者E-W核Nesfatin-1升高了2倍,而女性患者則降低了3倍。與動物實驗結果相一致的是,抑郁癥患者E-W核中Nesfatin-1與CART存在共表達,進一步證實Nesfatin-1可能參與了抑郁癥的發病,且其機制可能與CART相關。
2.4Nesfatin-1參與抑郁癥發病的可能機制 無論是Nes-fatin-1注射產生抑郁相關行為,還是抑郁癥患者體內Nesfa-tin-1含量的升高都顯示出Nesfatin-1與抑郁癥發病的密切聯系,針對其可能涉及的神經生物學機制的研究也逐漸深入。
CRH、CART、Urocortin-1、NPY、oxytocin等神經肽的表達改變被證明是參與應激反應,并導致攝食行為改變及抑郁癥發生的可能機制之一。大量研究證實[2,15,23],應激刺激后Nesfatin-1與上述神經肽存在共定位表達(Tab 2),這為Nes-fatin-1參與抑郁癥發病的機制研究提供了思路。

Tab 2 Co-localization of Nesfatin-1 with stress sensitive substances in the brain
2.4.1Nesfatin-1通過調節HPA軸參與抑郁癥發病 如前所述,側腦室注射Nesfatin-1可導致HPA軸過度激活[17],誘發大鼠焦慮恐懼行為[19],形態學研究結果也證實Nesfatin-1 與CRH能神經元等共表達,CRH還被證明是Nesfatin-1的下游信號分子[17]。因而,調節HPA軸的活性可能是Nesfatin-1參與抑郁癥的主要機制之一。
2.4.2Nesfatin-1通過中樞獎賞通路參與抑郁癥發病 中樞獎賞通路,尤其是腹側被蓋區(ventral tegmental area,VTA)投射至伏隔核(nucleus accumbens,NAc)的多巴胺能神經元功能障礙是導致抑郁癥患者快感缺失的主要神經生物學機制之一[24]。下丘腦攝食相關信號因子瘦素、胃饑餓素等可以通過調控中樞獎賞通路多巴胺能神經元的活性,影響攝食及快感缺失行為[25],多巴胺受體激動劑也可調節下丘腦攝食相關信號分子的表達[26]。新近研究表明[24],下丘腦弓狀核的POMC能神經元可直接投射至伏隔核,α-MSH信號通過Melanocortin 4受體(MCR4)參與獎賞通路多巴胺能神經元活性的調控,更進一步地證實了下丘腦攝食調節因子與中樞獎賞通路之間的緊密聯系。
研究表明,Nesfatin-1引起的攝食行為障礙可通過激活黑皮質素系統介導[1],側腦室注射α-MSH可導致下丘腦Nesfatin-1表達上調,形態學研究結果也證實Nesfatin-1與POMC/CART能神經元的共表達。這些研究結果表明Nesfa-tin-1與黑皮質素系統之間存在密切的內在聯系。另外,在ARC中,Nesfatin-1可以通過超極化來抑制NPY神經元,而促進攝食因子NPY被證明可以改善焦慮抑郁相關行為[27]。2.4.3 Nesfatin-1通過調節下丘腦胰島素信號通路參與抑郁癥發病 動物實驗和臨床研究結果表明,下丘腦攝食與代謝調節的穩態失衡,尤其是糖代謝調節紊亂與抑郁相關行為密切相關。胰島素信號通路功能障礙導致的胰島素抵抗被認為是導致抑郁癥患者糖代謝紊亂及神經功能障礙的主要機制之一。研究表明,胰島素信號通路參與突觸結構及功能可塑性的調節,下調下丘腦胰島素受體的表達可誘導大鼠抑郁相關行為的發生,慢性應激可導致大鼠下丘腦弓狀核的胰島素信號通路功能障礙,并與抑郁相關行為和HPA軸過度激活密切相關[28]。而且,與抑郁癥密切相關的5-HT等單胺類神經遞質也參與胰島素分泌及糖代謝的調控,胰島素可劑量依賴性降低中腦腹外側被蓋區突觸內多巴胺濃度,降低享樂感覺,胰島素抵抗可改變多巴胺受體及5-HT受體的敏感性,氟西汀等選擇性5-HT再攝取抑制劑可抑制胰島素分泌并改善抑郁大鼠的抑郁相關行為和HPA軸過度激活[28]。
近期研究表明,Nesfatin-1可與胰島素共定位表達于胰島β細胞[29],下丘腦靶向性Nesfatin-1敲除可調控胰島素受體與胰島素信號通路關鍵分子的表達,應用胰島素信號通路關鍵分子的拮抗劑可以阻斷Nesfatin-1對血糖的調控效應,提示Nesfatin-1的作用機制與胰島素信號通路密切相關。另有研究表明,Nesfatin-1血漿濃度與糖尿病患者的胰島素抵抗狀態及血糖水平呈正相關[30],而胰島素抵抗與高血糖都是導致快感缺失等抑郁表現的重要因素。因此,有理由相信,應激導致的下丘腦Nesfatin-1水平增高可能通過影響下丘腦胰島素信號通路的活性,誘發并加重胰島素抵抗,繼而參與抑郁癥的發生。
3 結語與展望
綜上所述,Nesfatin-1的改變與抑郁癥的攝食行為調節、快感缺失、行為絕望及糖代謝紊亂密切相關,Nesfatin-1可能參與抑郁癥的發生。然而,由于Nesfatin-1的特異性受體至今仍未發現,Nesfatin-1作用的具體機制有待進一步明確。
參考文獻:
[1] Oh-I S,Shimizu H,Satoh T,et al.Identification of nesfatin-1 as a satiety molecule in the hypothalamus[J].Nature,2006,443 (7112):709-12.
[2] Foo K S,Brismar H,Broberger C.Distribution and neuropeptide coexistence of nucleobindin-2 mRNA/nesfatin-like immunoreactiv-ity in the rat CNS[J].Neuroscience,2008,156(3):563-79.
[3] Goebel-Stengel M,Wang L,Stengel A,Tache Y.Localization of nesfatin-1 neurons in the mouse brain and functional implication [J].Brain Res,2011,1396:20-34.
[4] Pan W,Hsuchou H,Kastin A J.Nesfatin-1 crosses the blood-brain barrier without saturation[J].Peptides,2007,28(11):2223-8.
[5] 張亭亭,薛 瑞,李云峰,等.單胺轉運蛋白與單胺重攝取抑制劑研究進展[J].中國藥理學通報,2013,29(6):741-4.
[5] Zhang T T,Xue R,Li Y F,et al.Research progress in monoamine transporters and monoamine transmitter reuptake inhibitors[J].Chin Pharmacol Bull,2013,29(6):741-4.
[6] 劉佳莉,苑玉和,陳乃宏.抑郁癥的治療研究進展[J].中國藥理學通報,2011,27(9):1193-6.
[6] Liu J L,Yuan Y H,Chen N H.Research progress in treatment of depression[J].Chin Pharmacol Bull,2011,27(9):1193-6.
[7] Ge J F,Peng L,Cheng J Q.et al.Antidepressanlike effect of res-veratrol:involvement of antioxidant effect and peripheral regulation on HPA axis[J].Pharmacol Biochem Behav,2013,114-115:64-9.
[8] Stengel A,Goebel M,Wang L,et al.Central nesfatin-1 reduces dark-phase food intake and gastric emptying in rats:differential role of corticotropin-releasing factor 2 receptor[J].Endocrinology,2009,150(11):4911-9.
[9] Shimizu H,Oh I S,Hashimoto K.et al.Peripheral administration of nesfatin-1 reduces food intake in mice:the leptin-independent mechanism[J].Endocrinology,2009,150(2):662-71.
[10]Stengel A,Tache Y.Minireview:nesfatin-1-an emerging new play-er in the brain-gut,endocrine,and metabolic axis[J].Endocri-nology,2011,152(11):4033-8.
[11]Fort P,Salvert D,Hanriot L,et al.The satiety molecule nesfatin-1 is co-expressed with melanin concentrating hormone in tuberal hypothalamic neurons of the rat[J].Neuroscience,2008,155(1):174-81.
[12]Gotoh K,Masaki T,Chiba S,et al.Nesfatin-1,corticotropin-re-leasing hormone,thyrotropin-releasing hormone,and neuronal his-tamine interact in the hypothalamus to regulate feeding behavior [J].J Neurochem,2013,124(1):90-9.
[13]Swaab D F,Bao A M,Lucassen P J.The stress system in the hu-man brain in depression and neurodegeneration[J].Ageing Res Rev,2005,4(2):141-94.
[14]Konczol K,Bodnar I,Zelena D,et al.Nesfatin-1/NUCB2 may participate in the activation of the hypothalamic-pituitary-adrenal axis in rats[J].Neurochem Int,2010,57(3):189-97.
[15]Xu L,Bloem B,Gaszner B,et al.Stress-related changes in the activity of cocaine-and amphetamine-regulated transcript and nes-fatin neurons in the midbrain non-preganglionic Edinger-Westphal nucleus in the rat[J].Neuroscience,2010,170(2):478-88.
[16]Albayrak A,Demiryilmaz I,Albayrak Y,et al.The role of dimin-ishing appetite and serum nesfatin-1 level in patients with burn wound infection[J].Iran Red Crescent Med J,2013,15(5):389 -92.
[17]Yoshida N,Maejima Y,Sedbazar U,et al.Stressor-responsive central nesfatin-1 activates corticotropin-releasing hormone,nora-drenaline and serotonin neurons and evokes hypothalamic-pituitary-adrenal axis[J].Aging(Albany NY),2010,2(11):775-84.
[18]Szlachcic A,Sliwowski Z,Krzysiek-Maczka G,et al.New satiety hormone nesfatin-1 protects gastric mucosa against stress-induced injury:mechanistic roles of prostaglandins,nitric oxide,sensory nerves and vanilloid receptors[J].Peptides,2013,49:9-20.
[19]Merali Z,Cayer C,Kent P,Anisman H.Nesfatin-1 increases anx-iety-and fear-related behaviors in the rat[J].Psychopharmacology (Berl),2008,201(1):115-23.
[20]Ari M,Ozturk O H,Bez Y,et al.High plasma nesfatin-1 level in patients with major depressive disorder[J].Prog Neuropsycho-pharmacol Biol Psychiatry,2011,35(2):497-500.
[21]Hofmann T,Stengel A,Ahnis A,et al.NUCB2/nesfatin-1 is as-sociated with elevated scores of anxiety in female obese patients [J].Psychoneuroendocrinology,2013,38(11):2502-10.
[22]Bloem B,Xu L,Morava E,et al.Sex-specific differences in the dynamics of cocaine-and amphetamine-regulated transcript and nesfatin-1 expressions in the midbrain of depressed suicide victims vs.controls[J].Neuropharmacology,2012,62(1):297-303.
[23]Brailoiu G C,Dun S L,Brailoiu E,et al.Nesfatin-1:distribution and interaction with a G protein-coupled receptor in the rat brain [J].Endocrinology,2007,148(10):5088-94.
[24]Lim B K,Huang K W,Grueter B A,et al.Anhedonia requires MC4R-mediated synaptic adaptations in nucleus accumbens[J].Nature,2012,487(7406):183-9.
[25]Chuang J C,Perello M,Sakata I,et al.Ghrelin mediates stress-induced food-reward behavior in mice[J].J Clin Invest,2011,121(7):2684-92.
[26]van Zessen R,van der Plasse G,Adan R A.Contribution of the mesolimbic dopamine system in mediating the effects of leptin and ghrelin on feeding[J].Proc Nutr Soc,2012,71(4):435-45.
[27]Bjornebekk A,Mathe A A,Brene S.The antidepressant effects of running and escitalopram are associated with levels of hippocampal NPY and Y1 receptor but not cell proliferation in a rat model of de-pression[J].Hippocampus,2010,20(7):820-8.
[28]Pan Y,Hong Y,Zhang Q Y,Kong L D.Impaired hypothalamic insulin signaling in CUMS rats:restored by icariin and fluoxetine through inhibiting CRF system[J].Psychoneuroendocrinology,2013,38(1):122-34.
[29]Gonzalez R,Tiwari A,Unniappan S.Pancreatic beta cells colocal-ize insulin and pronesfatin immunoreactivity in rodents[J].Bio-chem Biophys Res Commun,2009,381(4):643-8.
[30]Zhang Z,Li L,Yang M,et al.Increased plasma levels of nesfatin-1 in patients with newly diagnosed type 2 diabetes mellitus[J].Exp Clin Endocrinol Diabetes,2012,120(2):91-5.
Advances in studies on role of Nesfatin-1 in depression
XU Ya-yun,GE Jin-fang,CHEN Fei-hu
(School of Pharmacy,Anhui Medical University,Hefei 230032,China)
Abstract:Nesfatin-1,discovered in 2006 by Oh-I as an 82-ami-no-acid peptide derived from the precursor protein nucleobindin2 (NUCB2),has been identified to play an important role in the regulation of food intake and energy metabolism.Recently,it has also been found that Nesfatin-1 might be associated with the pathogenesis of depression.This article reviewed the advances in related studies on Nesfatin-1 at home and abroad,which should throw light in expliciting the physiological function of Nesfatin-1 and understanding the neurobiological mechanism of depression.
Key words:Nesfatin-1;feeding behavior;stress;hypothalamic-pituitary-adrenal axis;depression;anhedonia;insulin signaling
作者簡介:徐亞運(1990-),男,碩士生,研究方向:分子藥理學,E-mail:413271974@qq.com;葛金芳(1975-),女,副教授,研究方向:神經藥理學,通訊作者,Tel:0551-65161115,E-mail:aygjf@mail.ustc.edu.cn;陳飛虎(1962-),男,博士,教授,博士生導師,研究方向:分子藥理學、基因工程藥物的表達與活性、中藥藥理學,通訊作者,Tel:0551-65161116,E-mail:cfhchina@sohu.com
基金項目:教育部高等學校博士點基金資助項目(No 20133420120005);安徽省自然科學基金資助項目(No 1408085MH154)
收稿日期:2015-06-10,修回日期:2015-07-08
文獻標志碼:A
文章編號:1001-1978(2015)08-1044-05中國圖書分類號:R-05;R341.6;R749.41;R977.6
doi:10.3969/j.issn.1001-1978.2015.08.003