以核受體為靶標的膽汁淤積治療藥物研究進展
陳 攀,李晶潔,陳 杰
(1.中山大學附屬第一醫院藥學部臨床藥學室,廣東廣州 510080;2.中山大學附屬第六醫院,廣東廣州 510655)
以核受體為靶標的膽汁淤積治療藥物研究進展
陳 攀1,李晶潔2,陳 杰1
(1.中山大學附屬第一醫院藥學部臨床藥學室,廣東廣州 510080;2.中山大學附屬第六醫院,廣東廣州 510655)
中國圖書分類號:R-05;R392.11;R575.05
摘要:膽汁淤積的治療藥物匱乏,熊去氧膽酸是目前唯一被FDA通過的治療原發性膽汁性肝硬化的藥物,但其藥效卻限于疾病早期,因此迫切需要開發新的膽汁淤積治療藥物。核受體能調控膽汁酸穩態,它作為膽汁淤積治療的靶標是目前研究的熱點。該綜述對目前報道最多的核受體進行總結,分析其作為膽汁淤積藥物治療靶標的利弊及應用前景。
關鍵詞:膽汁淤積;法尼酯X受體;孕烷X受體;組成性雄烷受體;1,25-二羥基維生素D3受體;糖皮激素受體;肝臟X受體;過氧化物酶體增殖物活化受體;轉錄因子-E2-相關因子2
網絡出版時間:2015-8-10 14:37 網絡出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20150810.1437.003.html
膽汁淤積以膽汁分泌和流動障礙為特征,能導致腸道中膽汁的缺乏以及過多潛在毒性膽汁成分在肝臟和體循環中的蓄積。臨床上長期膽汁淤積得不到改善,可出現黃疸、瘙癢和疲勞等癥狀,并發展為原發性膽汁性肝硬化(primary biliary cirrhosis,PBC)、原發性硬化性膽管炎(primary scleros-ing cholangitis,PSC)、甚至是肝衰竭等疾病。熊去氧膽酸(ursodeoxycholic acid,UDCA)是目前FDA唯一批準的PBC治療藥物,但是它的效能僅僅局限于PBC的治療早期[1]。開發新的膽汁淤積治療藥物迫在眉睫,而核受體便是一類關鍵的藥物靶標,它能調控膽汁酸的攝入、合成、外排、代謝與轉運。本綜述就現有報道最多的幾種核受體進行總結與評價。
1 法尼醇X受體(farnesoid X receptor,FXR)
FXR是第一個被鑒定的能感應膽汁酸的核受體,并以它的弱激動劑法尼醇來命名[2]。目前FXR被認為是膽汁淤積治療的最有前景的靶標。如Tab 1所示,FXR被激活后,能減少膽汁成分的攝入、減少肝臟中膽汁酸的合成,增加其親水性代謝及轉運外排。具體機制體現在FXR能下調肝細胞基底側的鈉離子/牛磺膽酸共轉運體(Na+/taurocholate co-transporter,NTCP)和有機陰離子轉運體(organic anion transporter,OATP)1B1表達,上調細胞色素P450(cytochrome P450,CYP)3A4、磺酸基轉移酶(sulfotransferase,SULT)2A1和葡萄糖醛酸轉移酶(UDP-glucuronyl transferases,UGT)2B4的表達,能上調膽小管側膽鹽外排泵(bile salt export pump,BSEP)以及基底側有機溶質轉運體(organic solute transport-er,OST)α/β和多藥耐藥相關蛋白(multidrug resistance-asso-ciated protein,MRP)2,此外,還能上調多藥耐藥性蛋白(mul-tidrug resistance protein,MDR)3的表達來增加膽小管側的磷脂外排[3]。Fiorucci等[4]的研究發現,FXR激動劑6-ECDCA能對抗雌激素誘導的大鼠肝內膽汁淤積,使膽汁流速恢復至正常水平,并明顯降低堿性磷酸酶(alkaline phosphatase,ALP)活性;此外,研究還發現6-ECDCA能減輕大鼠膽總管結扎導致的肝纖維化病理改變,并減少人及大鼠肝星狀細胞的過度分化[5]。
FXR的基礎研究推進了FXR激動劑應用于臨床的進程,目前6-ECDCA作為PBC治療藥物,在歐洲、加拿大和美國正處于Ⅲ期臨床試驗中(http://clinicaltrials.gov,identifi-er:NCT01473524)。Ⅱ期臨床試驗數據已證明,6-ECDCA與UDCA聯合應用能治療UDCA單用效果不佳的PBC病人。與單用UDCA相比,6-ECDCA與UDCA聯合用藥能使PBC患者血中ALP降低20%以上;6-ECDCA單用也能使PBC患者血中ALP降低40%。但是Ⅱ期臨床試驗卻發現6-ECDCA在中、高劑量(25mg與50mg)下出現明顯的瘙癢加重癥狀,這說明FXR可能參與了膽汁淤積誘發的瘙癢病癥。另外值得注意的是,FXR的激活能使經由膽管的膽汁流速增加,一方面膽汁流速的增加對于那些有轉運障礙的膽汁淤積性疾病是有益的,例如遺傳性轉運體基因突變、敗血癥誘導型膽汁淤積導致的轉運體表達下調,以及性激素或者藥物導致的功能性轉運體活性障礙等。但是在另一方面,FXR的激活不利于有膽管阻塞患者的治療,例如腫瘤或者結石導致的機械性膽管阻塞、膽管變窄的PSC以及PBC晚期,因為膽汁流速增加協同流動障礙會導致膽管破裂或者膽梗死的發生[6],所以在開發FXR激動劑的同時,需要進一步的注意并闡明其對膽管阻塞病人的危害。
2 孕烷X受體(pregnane X receptor,PXR)和組成性雄烷受體(constitutive androstane receptor,CAR)
PXR和CAR作為藥物代謝的感受器,也能夠介導內源性物質的代謝。如Tab 1所示,當PXR和CAR被激活后,能夠誘導包括CYP3A4、CYP2B6、SULT2A1、UGT1A1、MRP2、MRP3和MRP4的表達,而這些酶及轉運體的表達水平升高均能減少膽汁酸導致的肝損傷,以及增加膽汁酸經由尿液的外排[7]。
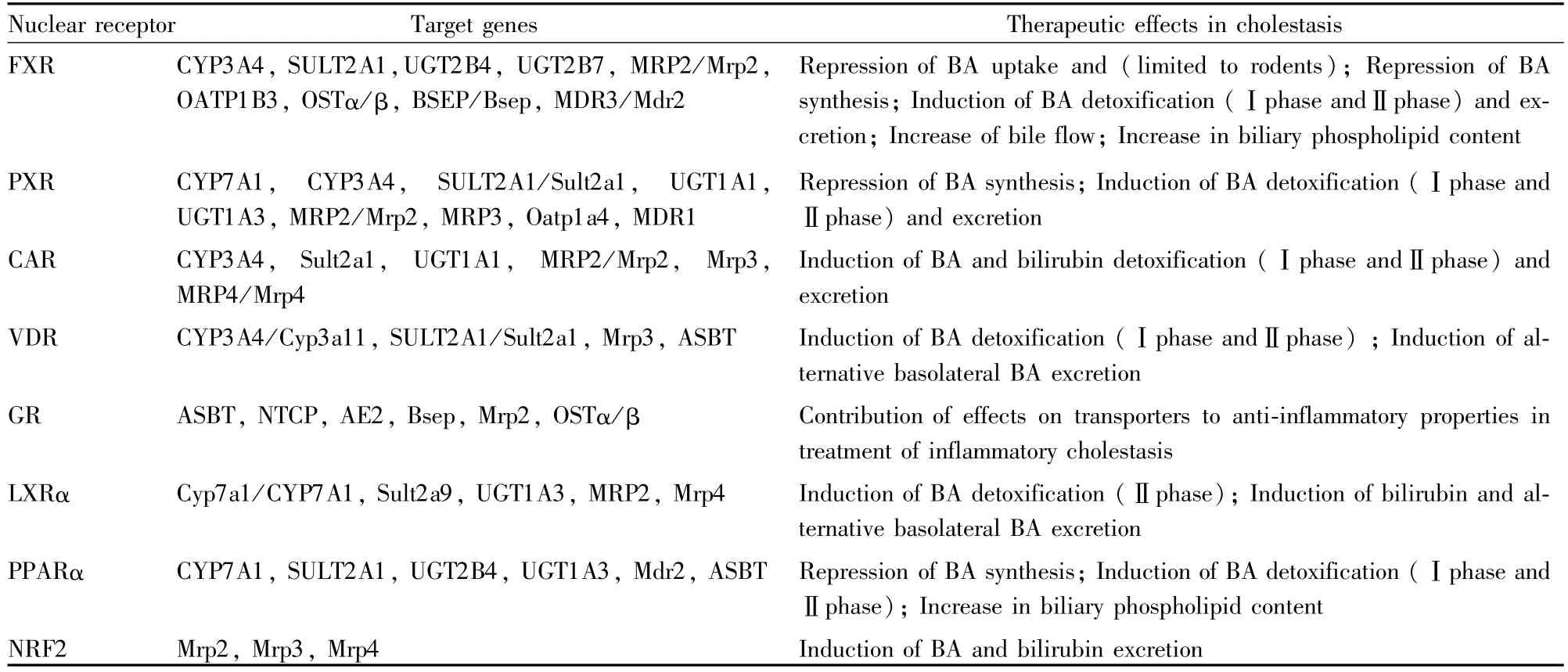
Tab 1 Nuclear receptors as drug targets in cholestasis
PXR和CAR的配體在其作用機制被發現之前就已經被應用于臨床了,其中包括PXR的配體利福平以及CAR的配體苯巴比妥和中藥湯劑成分之一的茵陳。利福平和苯巴比妥不但能夠用于減輕膽汁淤積引起的瘙癢癥狀,還能降低一些肝功指標的過度升高以及血清中膽汁酸水平[8-9]。包含茵陳的很多湯劑在亞洲已經被用于預防和治療新生兒黃疸[10]。但是這些配體也帶來了相應的副作用,例如利福平和苯巴比妥能夠引起疲勞、嗜睡以及肝毒性,其中利福平還能導致肝衰竭[11];在動物實驗中還發現CAR激動劑能夠促進肝腫瘤的發生[12]。此外,PXR和CAR激動劑在與其它藥物合用的同時還應該注意藥物相互作用的發生。
3 1,25-二羥基維生素D3受體(1,25-dihydroxyvitamin D3 receptor,VDR)
VDR能夠調控鈣穩態、細胞增殖與分化、抗微生物和免疫功能[13]。骨化三醇是目前發現的天然VDR配體,它能激活VDR而介導鈣穩態的調節效應。如Tab 1所示,VDR也能調控膽汁酸的合成、代謝以及外排,使它成為膽汁淤積治療的另外一個潛在藥物靶標。有報道內源性膽汁酸成分之一的石膽酸能激活腸道中的VDR,從而誘導CYP3A4的表達來增加自身的代謝[14]。VDR在膽汁淤積治療中發揮作用的觀點不一,首先VDR在肝臟中的基準表達很低并只局限于非實質細胞中[15],因此它對肝細胞特異性基因的調控作用受到質疑,雖然已有研究發現VDR能激活HepG2細胞以及小鼠中的Cyp3a11、Mrp2、SULT2A1/Sult2a1表達,同時,VDR還能抑制CYP7A1、Bsep和Ostα/β的表達,其它還被報道的VDR靶基因還包括Mrp3和頂膜鈉依賴性膽汁酸轉運體(ap-ical sodium dependent bile acid transporter,ASBT),但是VDR的一些調控中作用在人體中并未觀察到,這說明存在VDR調控的種屬差異性。在膽管阻塞小鼠中,VDR被激活后還能抑制促炎癥因子的表達以及調控肝纖維化的進程[16]。
總體來講,VDR不失為一個有應用前景的膽汁淤積治療藥物靶標,但我們應該警惕因VDR激活而帶來的一系列副作用的發生,如高劑量的VDR配體會影響鈣穩態。
4 糖皮質激素受體(glucocorticoid receptor,GR)
糖皮質激素在通過被動擴散進入細胞后能與胞質中的GR結合而發揮作用。如Tab 1所示,糖皮質激素能夠調控人膽汁酸轉運體,如NTCP、ASBT和OSTα/β的表達[17]。此外糖皮質激素在調控轉運體中的一個重要效應是激活陰離子交換蛋白(anion exchanger,AE)2的表達,從而增加膽管上皮細胞碳酸氫鹽的分泌,而這對于AE2表達本已就減少的PBC患者顯得尤為重要[18]。GR被激活后,還能調控其它核受體的功能,例如GR能上調PXR和類視黃醇X受體(retin-oid X receptor,RXR)α的mRNA以及蛋白的表達[19]。
糖皮質激素已經在臨床上用于治療包括PBC在內的各種膽汁淤積性疾病,其中布地奈德等糖皮質激素類藥物通常與UDCA聯合應用,降低膽汁淤積患者的血清生化指標以及減輕肝臟組織化學病理變化[20],而UDCA也被發現能夠激活GR[21],這也在機制水平上支持了UDCA與糖皮質激素聯合用藥治療PBC等膽汁淤積的作用。但是,應用糖皮質激素治療PBC患者,能引起骨質疏松,此外,布地奈德用于晚期PBC患者治療時,可導致潛在的致命性門靜脈血栓發生,這些也限制了糖皮質激素類藥物在這些患者中的應用[22]。
5 肝臟X受體(liver X receptor,LXR)α和LXRβ
LXRα和LXRβ是氧化固醇類的感受器,對于整個機體膽固醇的穩態起到了關鍵的調節作用。LXRα對于膽汁淤積所致肝損傷具有保護作用,在石膽酸以及膽管結扎的小鼠膽汁淤積模型中,LXR配體處理或者LXRα轉基因的小鼠出現的肝損傷明顯減少,同時LXRα/β敲除小鼠則出現更加嚴重的肝損傷現象,機制涉及LXR的激活能誘導Sult2a9、UGT1A3、Mrp4的表達[23](Tab 1)。應注意的是,該種對抗膽汁淤積性肝損傷的作用僅僅存在于♀小鼠中[23]。LXR激活后還能上調MRP2的表達而發揮對抗膽汁淤積的作用[24]。
因此,LXR配體有潛力被用于治療膽汁淤積,機制包括減少膽汁酸的合成、增加膽汁酸的葡萄糖醛酸化、硫酸化以及膽汁酸的外排。對于LXR的治療膽汁淤積的效應需要進一步的確認,同時LXR作用的性別差異性也亟待闡明,此外
還應注意的是,LXR激活后存在的致血管粥樣硬化和高甘油三酯血癥,這些副作用會在很大程度上限制LXR配體在治療膽汁淤積方面的臨床應用。
6 過氧化物酶體增殖物活化受體(peroxisome proliferator activated receptor,PPAR)α和PPARγ
PPARα激動劑治療膽汁淤積的機制涉及誘導代謝酶以及抑制膽汁酸的合成(Tab 1)。貝特類藥物作為PPARα的激動劑,能誘導膽管上皮細胞和腸上皮細胞中Ⅱ相代謝酶如SULT2A1、UGT2B4和UGT1A3以及ASBT/Asbt的表達,并抑制CYP7A1的活性[25]。貝特類藥物以及其它的PPARα激動劑還能直接的誘導膽管側Mdr2的表達以此來增加膽汁中磷脂的外排[26]。目前一項Ⅱ期臨床試驗研究非諾貝特治療對UDCA效果不佳的PBC患者(http://www.clinicaltrials.gov,identifier:NCT00575042),臨床數據顯示非諾貝特能明顯降低膽汁淤積患者的血清生化指標。最近一項在有血脂異常的PBC患者中的前瞻性試驗發現,長期聯合應用苯扎貝特和UDCA能改善ALP水平,但是對生存率無影響,還能升高血清肌酐水平,提示需監測不良反應的發生[27]。
目前還沒有直接的PPARγ對膽汁酸代謝的調控作用研究,PPARγ發揮的作用主要與有膽汁淤積引發的炎癥水平有關,例如在LPS小鼠模型中,羅格列酮預防給藥能通過減少LPS介導的RXRα外排出胞核從而減少炎癥對Ntcp、Bsep和Cyp3a11的抑制作用[28]。PPARγ激動劑能抑制HSC的激活從而減輕膽汁淤積導致的肝纖維化[29]。鑒于格列酮類的肝毒性副作用極大的限制它們的應用,同時存在格列酮類藥物能劑量依賴性的抑制鈉離子和ATP依賴性的膽汁酸轉運[30]的報道,格列酮類藥物用于治療膽汁淤積時應該格外的謹慎。
7 轉錄因子-E2-相關因子2(nuclear factor-E2-related fac-tor 2,Nrf2)
嚴格上來講,Nrf2并非傳統意義上的核受體,但近年來開始被發現在膽汁淤積治療方面發揮了調控作用,其中主要涉及膽汁酸代謝酶和轉運體、抗氧化系統的調控(Tab 1)。Nrf2能啟動抗氧化基因的轉錄,包括NAD(P)H醌氧化還原酶-1(NAD(P)H quinone oxidoreductase 1,NQO-1)、血紅素氧合酶-1(heme oxygenase-1,HO-1)和UGT1A6等[31],這對于膽汁淤積帶來的肝損傷具有保護作用。還有研究發現UDCA治療膽汁淤積的機制就包括上調Nrf2介導的Mrp2、Mrp3、Mrp4表達[32]。本課題組也發現齊墩果酸作為Nrf2的激動劑,能激活Nrf2-Mrps通路,從而對抗石膽酸誘導的膽汁淤積性肝損傷[33]。
因此,上述研究提示在膽汁淤積患者中,Nrf2的激活不僅能起到抗氧化應激保護肝細胞的作用,還能增加膽汁酸的外排,這使得Nrf2也成為一個膽汁淤積藥物治療的潛在靶標。此外,Nrf2對基底側Mrp3和Mrp4的上調程度較膽管側Mrp2更為明顯,這提示Nrf2激動劑可能更適用于膽管阻塞性膽汁淤積的治療。
8 結論
核受體對膽汁酸穩態的調控研究不僅闡明了越來越多的膽汁酸合成、代謝與轉運方面的分子調控機制,同時也使得一些核受體成為有應用前景的膽汁淤積治療藥物靶標。其中的代表性核受體就是FXR,它作為膽汁酸的一個主要感應受體,已經成為很多實驗性藥物研究的重點,并且有些藥物如6-ECDCA已經處于膽汁淤積治療的Ⅲ期臨床實驗階段。其它的核受體如PXR、CAR、VDR、LXRα、PPARα等也成為了膽汁淤積治療的潛在靶標。此外,還值得注意的是,因為膽汁酸調控的核受體網絡較為復雜,因此容易出現相應的副作用,在開發藥物的時候需要給予足夠關注。綜上所述,核受體作為膽汁淤積藥物治療靶標的研究已經取得了肯定的效果,此后的研究重點除了更多更深的闡明核受體調控膽汁酸穩態的分子機制之外,還應開發更多具有組織特異性以及較少副作用的核受體配體。
參考文獻:
[1] Corpechot C,Chazouilleres O,Poupon R.Early primary biliary cirrhosis:biochemical response to treatment and prediction of long-term outcome[J].J Hepatol,2011,55(6):1361-7.
[2] Makishima M,Okamoto A Y,Repa J J,et al.Identification of a nuclear receptor for bile acids[J].Science,1999,284(5418):1362-5.
[3] Jonker J W,Liddle C,Downes M.FXR and PXR:potential thera-peutic targets in cholestasis[J].J Steroid Biochem Mol Biol,2012,130(3-5):147-58.
[4] Fiorucci S,Clerici C,Antonelli E,et al.Protective effects of 6-ethyl chenodeoxycholic acid,a farnesoid X receptor ligand,in es-trogen-induced cholestasis[J].J Pharmacol Exp Ther,2005,313 (2):604-12.
[5] Fiorucci S,Antonelli E,Rizzo G,et al.The nuclear receptor SHP mediates inhibition of hepatic stellate cells by FXR and protects a-gainst liver fibrosis[J].Gastroenterol,2004,127(5):1497-512.
[6] Fickert P,Zollner G,Fuchsbichler A,et al.Ursodeoxycholic acid aggravates bile infarcts in bile duct-ligated and Mdr2 knockout mice via disruption of cholangioles[J].Gastroenterol,2002,123(4):1238-51.
[7] Chai X,Zeng S,Xie W.Nuclear receptors PXR and CAR:impli-cations for drug metabolism regulation,pharmacogenomics and be-yond[J].Expert Opin Drug Metab Toxicol,2013,9(3):253-66.
[8] Stiehl A,Thaler M M,Admirand W H.The effects of phenobarbi-tal on bile salts and bilirubin in patients with intrahepatic and ex-trahepatic cholestasis[J].N Engl J Med,1972,286(16):858-61.
[9] Bachs L,Pares A,Elena M,et al.Comparison of rifampicin with phenobarbitone for treatment of pruritus in biliary cirrhosis[J].Lancet,1989,1(8638):574-76.
[10]王曉鳴,陶 鈞,裴 宇,徐彩飛.茵陳退黃方治療新生兒高膽紅素血癥的臨床研究[J].中華中醫藥雜志,2014,29(2):456 -8.
[10]Wang X M,Tao J,Fei Y,Xu C F.Clinical study of Virgate Wormwood Herb Suppository(Soup)on the treatment of neonatal
hyperbilirubinemia[J].China J Tradit Chin Med Pharm,2014,29(2):456-8.
[11]Bachs L,Pares A,Elena M,et al.Effects of long-term rifampi-cin administration in primary biliary cirrhosis[J].Gastroenterol,1992,102(6):2077-80.
[12]Yamamoto Y,Moore R,Goldsworthy T L,et al.The orphan nu-clear receptor constitutive active/androstane receptor is essential for liver tumor promotion by phenobarbital in mice[J].Cancer Res,2004,64(20):7197-200.
[13]Carlberg C,Molnar F.Vitamin D receptor signaling and its thera-peutic implications:Genome-wide and structural view[J].Can J Physiol Pharmacol,2015,93(5):311-8.
[14]Makishima M,Lu T T,Xie W,et al.Vitamin D receptor as an in-testinal bile acid sensor[J].Science,2002,296(5571):1313-6.
[15]Gascon-Barre M,Demers C,Mirshahi A,et al.The normal liver harbors the vitamin D nuclear receptor in nonparenchymal and bili-ary epithelial cells[J].Hepatol,2003,37(5):1034-42.
[16]Ogura M,Nishida S,Ishizawa M,et al.Vitamin D3 modulates the expression of bile acid regulatory genes and represses inflammation in bile duct-ligated mice[J].J Pharmacol Exp Ther,2009,328 (2):564-70.
[17]Rose A J,Berriel D M,Reimann A,et al.Molecular control of systemic bile acid homeostasis by the liver glucocorticoid receptor [J].Cell Met,2011,14(1):123-30.
[18]Alvaro D,Gigliozzi A,Marucci L,et al.Corticosteroids modulate the secretory processes of the rat intrahepatic biliary epithelium [J].Gastroenterol,2002,122(4):1058-69.
[19]Pascussi J M,Drocourt L,Fabre J M,et al.Dexamethasone in-duces pregnane X receptor and retinoid X receptor-alpha expression in human hepatocytes:synergistic increase of CYP3A4 induction by pregnane X receptor activators[J].Mol Pharmacol,2000,58 (2):361-72.
[20]Mitchison H C,Palmer J M,Bassendine M F,et al.A controlled trial of prednisolone treatment in primary biliary cirrhosis.Three-year results[J].J Hepatol,1992,15(3):336-44.
[21]Tanaka H,Makino I.Ursodeoxycholic acid-dependent activation of the glucocorticoid receptor[J].Biochem Biophys Res Commun,1992,188(2):942-8.
[22]Hempfling W,Grunhage F,Dilger K,et al.Pharmacokinetics and pharmacodynamic action of budesonide in early-and late-stage pri- mary biliary cirrhosis[J].Hepatol,2003,38(1):196-202.
[23]Uppal H,Saini S P,Moschetta A,et al.Activation of LXRs pre-vents bile acid toxicity and cholestasis in female mice[J].Hepatol,2007,45(2):422-32.
[24]Adachi T,Nakagawa H,Hagiya Y,et al.Transport-metabolism interplay:LXRalpha-mediated induction of human ABC transporter ABCC2(cMOAT/MRP2)in HepG2 cells[J].Mol Pharm,2009,6(6):1678-88.
[25]Ghonem N S,Assis D N,Boyer J L.Fibrates and cholestasis[J].Hepatology,2015,62(2):635-43.
[26]Chianale J,Vollrath V,Wielandt A M,et al.Fibrates induce mdr2 gene expression and biliary phospholipid secretion in the mouse[J].Biochem J,1996,314(Pt 3):781-6.
[27]Hosonuma K,Sato K,Yamazaki Y,et al.A prospective random-ized controlled study of long-term combination therapy using ur-sodeoxycholic acid and bezafibrate in patients with primary biliary cirrhosis and dyslipidemia[J].Am J Gastroenterol,2015,110 (3):423-31.
[28]Ghose R,Mulder J,von Furstenberg R J,et al.Rosiglitazone at-tenuates suppression of RXRalpha-dependent gene expression in in-flamed liver[J].J Hepatol,2007,46(1):115-23.
[29]Dubuquoy L,Dharancy S,Nutten S,et al.Role of peroxisome proliferator-activated receptor gamma and retinoid X receptor het-erodimer in hepatogastroenterological diseases[J].Lancet,2002,360(9343):1410-8.
[30]Snow K L,Moseley R H.Effect of thiazolidinediones on bile acid transport in rat liver[J].Life Sci,2007,80(8):732-40.
[31]李 航,段惠軍.Nrf2/ARE信號通路及其調控的抗氧化蛋白[J].中國藥理學通報,2011,27(3):300-3.
[31]Li H,Duan H J.Nrf2/ARE signaling pathway and its regulation of antioxidant proteins[J].Chin Pharmacol Bull,2011,27(3):300-3.
[32]Okada K,Shoda J,Taguchi K,et al.Ursodeoxycholic acid stimu-lates Nrf2-mediated hepatocellular transport,detoxification,and antioxidative stress systems in mice[J].Am J Physiol Gastrointest Liver Physiol,2008,295(4):G735-47.
[33]Chen P,Zeng H,Wang Y,et al.Low dose of oleanolic acid pro-tects against lithocholic acid-induced cholestasis in mice:potential involvement of nuclear factor-E2-related factor 2-mediated upregu-lation of multidrug resistance-associated proteins[J].Drug Metab Dispos,2014,42(5):844-52.
Nuclear receptors as drug targets in cholestasis
CHEN Pan1,LI Jing-jie2,CHEN Jie1
(1.Dept of Pharmacy,the First Affiliated Hospital of Sun Yat-sen University,Guangzhou 510080,China;2.The Sixth Affiliated Hospital of Sun Yat-sen University,Guangzhou 510655,China)
Abstract:Drug for cholestasis therapy is extremely limited.Ur-sodeoxycholic acid is currently the only FDA approved drug to treat primary biliary cirrhosis,whereas its efficacy is limited to early stage of the disease.Therefore,developing novel drugs re-presents a major goal for both pharmaceutical industry and aca-demic researchers.Targeting nuclear receptors in cholestasis is an intriguing approach since these receptors are critically in-volved in the regulation of bile acid homeostasis.This review summarizes the roles of individual nuclear receptors in cholestasis and evaluates their potential clinical application.
Key words:cholestasis;FXR;PXR;CAR;VDR;GR;LXR;PPAR
作者簡介:陳 攀(1985-),男,博士,主管藥師,研究方向:臨床藥理學,E-mail:cepa1@163.com;李晶潔(1985-),女,博士,醫師,研究方向:生殖醫學,并列第一作者,E-mail:comic12@163.com;陳 杰(1973-),男,博士,副主任藥師,研究方向:臨床藥理學,通訊作者,E-mail:chenjiezs@163.com
基金項目:廣東省自然科學基金博士啟動項目(No 2014A030310096)
收稿日期:2015-05-13,修回日期:2015-06-21
文獻標志碼:A
文章編號:1001-1978(2015)09-1195-04
doi:10.3969/j.issn.1001-1978.2015.09.003