蜂毒素對人肝癌HepG2細胞增殖和凋亡的影響及其部分機制研究
沈文文,趙 斌,黃 成,孟曉明,陳昭琳,吳小琴,李 俊
(安徽醫(yī)科大學(xué)藥學(xué)院,安徽醫(yī)科大學(xué)肝病研究所,安徽省創(chuàng)新藥物產(chǎn)業(yè)共性技術(shù)研究院,安徽合肥 230032)
蜂毒素對人肝癌HepG2細胞增殖和凋亡的影響及其部分機制研究
沈文文,趙 斌,黃 成,孟曉明,陳昭琳,吳小琴,李 俊
(安徽醫(yī)科大學(xué)藥學(xué)院,安徽醫(yī)科大學(xué)肝病研究所,安徽省創(chuàng)新藥物產(chǎn)業(yè)共性技術(shù)研究院,安徽合肥 230032)
中國圖書分類號:R329.24;R329.25;R735.702.2;R996.3
摘要:目的 研究蜂毒素對人肝癌HepG2細胞增殖和凋亡的影響,并探討其作用和HDAC2及Hedgehog信號通路的關(guān)系。方法 給予不同濃度蜂毒素,四甲基偶氮唑鹽(MTT)法檢測HepG2細胞的增殖變化,Hoechst33258染色和流式細胞術(shù)檢測HepG2細胞凋亡變化;qRT-PCR檢測SHH、PTCH1、SMO、Gli1、HDAC2 mRNA的表達;Western blot檢測SHH、PTCH1、SMO、Gli1、HDAC2蛋白的表達。結(jié)果 不同濃度的蜂毒素在作用48 h后,能明顯抑制HepG2細胞的增殖,促進其凋亡;Hedgehog信號通路中SHH、PTCH1、SMO、Gli1 mR-NA及蛋白水平均明顯降低,并與蜂毒素濃度呈負相關(guān)。同時檢測到細胞內(nèi)HDAC2 mRNA及蛋白水平均降低,與蜂毒素劑量呈負相關(guān)。結(jié)論 蜂毒素可明顯抑制人肝癌HepG2細胞增殖,促進其凋亡,其作用與抑制HDAC2,下調(diào)Hedge-hog信號通路密切相關(guān)。
關(guān)鍵詞:蜂毒素;HDAC2;Hedgehog信號通路;細胞增殖;細胞凋亡;HepG2細胞
網(wǎng)絡(luò)出版時間:2015-8-10 14:37 網(wǎng)絡(luò)出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20150810.1437.009.html
原發(fā)性肝癌(HCC)是臨床上最常見的惡性腫瘤之一,其發(fā)生發(fā)展過程復(fù)雜,多種因素共同參與,具體機制目前仍不清楚[1]。世界衛(wèi)生組織發(fā)表的《全球癌癥報告2014》顯示,我國肝癌的新增病例和死亡人數(shù)均居世界首位。大量的研究表明,Hedge-hog(Hh)信號通路的異常與多種腫瘤的發(fā)生發(fā)展密切相關(guān),且其作用可能受組蛋白去乙酰化酶(HDACs)的調(diào)節(jié)。在人原發(fā)性肝癌中,Hh信號通路異常表達,并通過調(diào)節(jié)自噬參與到HCC的發(fā)生發(fā)展中;在胰腺導(dǎo)管腺癌小鼠模型中發(fā)現(xiàn),SHH信號使骨髓細胞中血管生成素Ang-1和胰島素樣生長因子IGF-1表達增加,促進腫瘤組織血管生成;在神經(jīng)前體細胞和成神經(jīng)管細胞瘤中,高表達的HDAC1和低表達REN能夠影響Hedgehog信號通路;在胰腺癌和胃癌的發(fā)生發(fā)展中,SHH/Gli信號通路能影響包括TGF-β、Ras、Wnt、Smads、生長因子、整合素等多種信號通路,增強腫瘤細胞的侵襲遷移能力。Hedgehog信號通路參與了腫瘤細胞的增殖、凋亡,并促進血管形成,影響腫瘤細胞的侵襲及遷移過程。因此針對Hh信號通路的靶向抑制為我們抗腫瘤治療提供了新的研究方向。
蜂毒是工蜂毒腺和副腺分泌的具有芳香氣味的一種透明液體。我國有著悠久的利用蜂毒治療疾病的歷史。近年來隨著分離、純化技術(shù)水平的不斷提高,作為蜂毒主要組分及重要的活性成分,蜂毒素被不斷開發(fā)并廣泛應(yīng)用于風(fēng)濕性關(guān)節(jié)炎、類風(fēng)濕性關(guān)節(jié)炎、三叉神經(jīng)痛、偏頭痛等疾病的治療[2-3]。其能夠通過多種途徑影響細胞的信號傳導(dǎo),誘導(dǎo)神經(jīng)酰胺合成及細胞凋亡,由此引發(fā)抗菌、抗病毒、抗腫瘤等生物效應(yīng),引起廣泛關(guān)注。蜂毒素具有的抗腫瘤作用,呈多靶點性,可能與其直接殺傷細胞,誘導(dǎo)細胞凋亡,調(diào)節(jié)免疫及非特異性免疫功能有關(guān),但其具體機制未明。本實驗觀察蜂毒素對肝癌HepG2細胞增殖的抑制作用和其促進凋亡作用,并探討該作用與HDAC2及Hedgehog信號通路的關(guān)系。
1 材料
1.1細胞株 HepG2細胞由安徽醫(yī)科大學(xué)基礎(chǔ)醫(yī)學(xué)院神經(jīng)藥理學(xué)研究所提供。
1.2試劑和儀器 RPMI 1640培養(yǎng)基由Hyclone公司提供,胎牛血清購于杭州四季青公司,MTT和DMSO,PTCH1、SMO、Gli1抗體均由Sigma公司提供,Hoechst 33258染色試劑盒及Annexin V-FITC凋亡檢測試劑盒購自上海貝博生物,逆轉(zhuǎn)錄試劑盒購自MBI Fermentas公司,QuantiFast SYBR-Green RT-PCR試劑盒由QIAGEN公司提供,TRIzol Reagent及
引物合成由上海Invitrogen公司提供,β-actin抗體購自美國Cell Signaling Technology,SHH抗體由北京博奧森生物有限公司提供,羊抗小鼠和羊抗兔IgG購于北京中杉金橋生物技術(shù)有限公司。二氧化碳培養(yǎng)箱(Thermoforma),熒光倒置顯微鏡(日本O-LYMPUS公司),酶標(biāo)儀(biotekEL),流式細胞儀(FACSVERSE),qRT-PCR儀(Thermo Fisher Scientif-ic),Western blot儀器(Bio-Rad)。
2 方法
2.1HepG2細胞的培養(yǎng) 采用含10%胎牛血清的RPMI-1640培養(yǎng)液(105U·L-1青霉素和100 g· L-1鏈霉素),在37℃、5%CO2飽和濕度條件下培養(yǎng),細胞為貼壁生長,胰酶消化液消化后傳代培養(yǎng),實驗取用對數(shù)生長期細胞。
2.2細胞增殖實驗 以MTT比色法檢測HepG2細胞的增殖。實驗分為4組:空白對照組,低、中、高3個濃度組。將培養(yǎng)的HepG2細胞胰酶消化制備成細胞混懸液,每孔以細胞數(shù)4 000接種于96孔板中。細胞貼壁后,分別給予0、1、2、4 mg·L-1蜂毒素,作用48 h后,每孔加入MTT(5 g·L-1)20 μL,繼續(xù)孵育培養(yǎng)4 h后,棄上清,每孔加入DMSO 150 μL,振蕩10 min,使結(jié)晶充分溶解后,酶標(biāo)儀492 nm波長處檢測各孔吸光度,按公式計算蜂毒素對細胞的生長抑制率,生長抑制率/%=(1-OD給藥組/OD對照組)×100%。
2.3細胞凋亡實驗
2.3.1Hoechst 33258染色法觀察細胞核的形態(tài)變化 實驗分為4組:空白對照組,蜂青素低、中、高3個濃度組。將培養(yǎng)的HepG2細胞胰酶消化后,制備成細胞混懸液,每孔以細胞數(shù)4 000接種于6孔板中。細胞貼壁后,分別給予0、1、2、4 mg·L-1蜂毒素,作用48 h后,將1/10細胞培養(yǎng)基體積的染料加入細胞培養(yǎng)物中,37℃繼續(xù)培養(yǎng)細胞15 min,PBS洗2遍,熒光倒置顯微鏡下,隨機選取4個視野,觀察細胞核的形態(tài)變化并計數(shù),計算凋亡率,凋亡率/%=(凋亡細胞/細胞總數(shù))×100%。
2.3.2AnnexinV-FITC細胞凋亡檢測試劑盒檢測細胞凋亡 實驗分為4組:空白對照組,蜂毒素低、中、高3個濃度組。細胞制備成懸浮液后,以細胞數(shù)4 ×105接種至細胞培養(yǎng)瓶中,待細胞貼壁后,換液,實驗組分別給予1、2、4 mg·L-1蜂毒素,48 h后,用不含EDTA的胰酶消化,離心收集懸浮細胞。離心機300×g,2℃~8℃,5 min,棄培養(yǎng)基,PBS洗滌2次,重新離心收集細胞。用400 μL 1×Annexin V結(jié)合液懸浮細胞,濃度大約為1×109cells·L-1。在細胞懸液中加入5 μL Annexin V-FITC染色液,輕輕混勻后于2℃~8℃避光孵育15 min;加入10 μL PI染色液后輕輕混勻于2℃~8℃避光孵育5 min;處理結(jié)束后,使用Beckmann流式細胞儀,488 nm激發(fā)波長,按照常規(guī)流式凋亡檢測。
2.4qRT-PCR檢測SHH、PTCH1、SMO、Gli1、HDAC2mRNA的表達 實驗分為4組:空白對照組,蜂毒素低、中、高3個濃度組。給藥刺激48 h后,按TRIzol試劑盒操作說明,提取細胞總RNA。提取的總RNA按Fermentas逆轉(zhuǎn)錄試劑盒操作說明,將9 μL總RNA逆轉(zhuǎn)錄為cDNA。本實驗qRT-PCR引物序列見Tab 1。采用QuantiFast SYBR-Green RT-PCR試劑盒,按2 μL cDNA、3 μL引物、5 μL SYB體系檢測SHH、PTCH1、SMO、Gli1、HDAC2mRNA的表達,以β-actin做內(nèi)參,使用Piko-Real 96 Real-Time PCR系統(tǒng)軟件對實驗結(jié)果進行分析。重復(fù)3次獨立實驗。
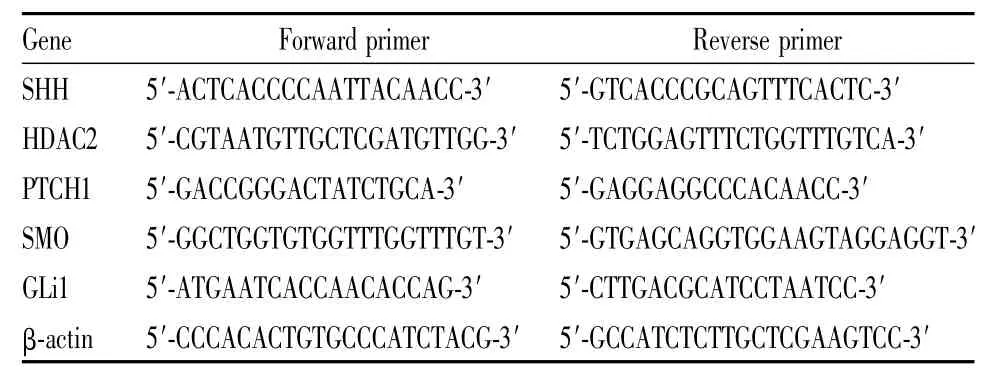
Tab 1 Primer sequence used for Real-time Quantitative PCR
2.5Western blot檢測SHH、PTCH1、SMO、Gli1、HDAC2蛋白的表達 實驗分組同上,給藥刺激48 h后,用預(yù)冷的PBS洗3次,每組加入400 μL RIPA蛋白裂解液(含PMSF 10 mL·L-1),冰上裂解30 min。4℃離心30 min,留取上清液。加入1/4體積上清液的蛋白上樣緩沖液,100℃水浴10 min,-20℃保存。配制SDS-聚丙烯酰胺凝膠,每組上樣15 μL總蛋白,80V電泳30 min后,120V電泳90 min。按蛋白marker位置切膠,200mA,BioRAD濕轉(zhuǎn)儀器將蛋白轉(zhuǎn)到激活后的PVDF膜上,根據(jù)蛋白分子量大小不同,SHH、PTCH1、SMO、Gli1、HDAC2蛋白轉(zhuǎn)膜時間依次為55、220、110、150、75 min;室溫5%脫脂奶粉,1×TBS,0.1%吐溫-20封閉3 h,1× TBS,0.1%吐溫洗膜后孵育一抗,一抗?jié)舛葹镾HH (1∶200)、PTCH1(1∶250)、SMO(1∶500)、Gli1(1 ∶500)、HDAC2(1∶1 000),4℃過夜。1×TBS,0.1%吐溫洗膜4次,每次10 min,放入與一抗匹配的二抗(1∶7 500)中孵育,室溫1 h,1×TBS,0.1%吐溫洗膜4次,每次10 min,ECL發(fā)光試劑盒顯影,
以β-actin做內(nèi)參,分析條帶吸光度值。
2.6統(tǒng)計學(xué)分析 采用SPSS 17.0統(tǒng)計軟件對實驗所得數(shù)據(jù)進行分析。結(jié)果以±s表示,兩組間比較采用t檢驗,3組及以上比較采用方差分析。
3 結(jié)果
3.1蜂毒素對HepG2細胞增殖的影響 在給予不同濃度的蜂毒素分別作用24、48、72 h后,MTT比色法檢測結(jié)果顯示:給予HepG2細胞1,2,4 mg·L-1蜂毒素作用24 h后,各劑量組細胞生長的抑制率分別為28.7%,29.4%,38.4%;作用48 h后各劑量組抑制率為29.3%,37.5%,49.8%;作用72 h后各劑量組抑制率為17.8%,27.0%,36.1%(Fig 1)。實驗結(jié)果表明,蜂毒素對HepG2細胞的增長有明顯的抑制作用,且隨給藥劑量遞增,抑制作用越明顯。因為各劑量組抑制率在作用48 h后最高,所以后續(xù)實驗均采用給藥后48 h進行檢測。以上實驗結(jié)果至少重復(fù)3次。
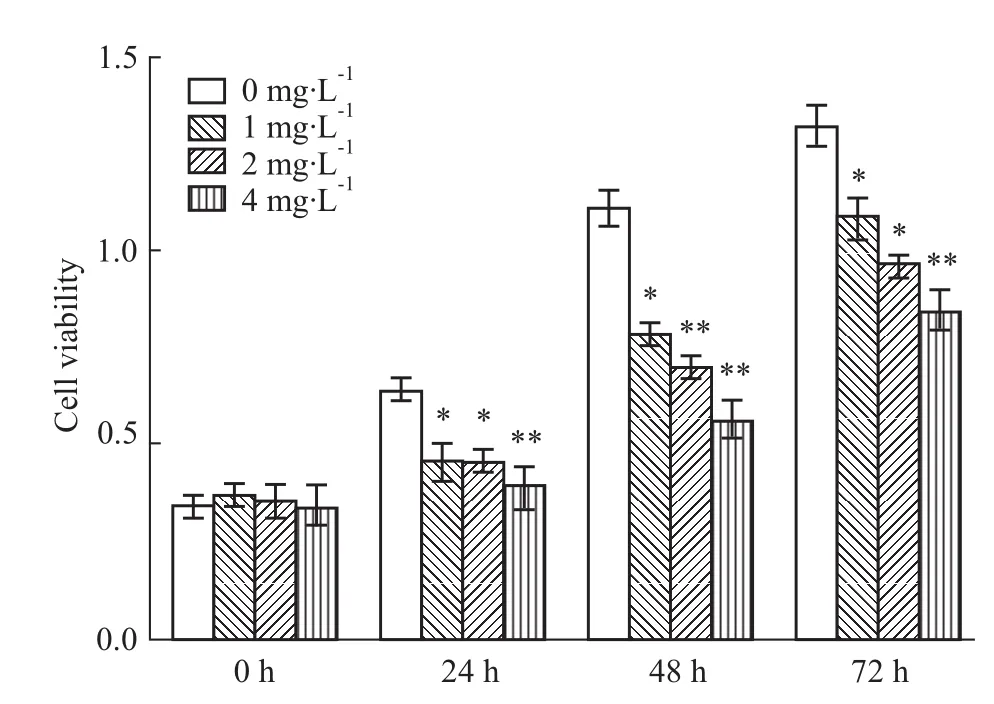
Fig 1 Inhibitory effect of Melittin on HepG2 cells protiferation
3.2蜂毒素對HepG2細胞凋亡的影響 在給予不同濃度的蜂毒素作用48 h后,Hoechst 33258染色結(jié)果顯示:見Fig 2(A),蜂毒素中、高劑量組(2、4 mg ·L-1)Hoechst 33258染色陽性細胞數(shù)均較空白對照組增多,其差異均有顯著性(P<0.01);同時流式細胞儀檢測不同濃度給藥組HepG2細胞凋亡的結(jié)果顯示:見Fig 2(B),給藥組細胞凋亡明顯增多,且與蜂毒素給藥濃度呈正相關(guān),同空白對照組相比較,蜂毒素中、高劑量組(2、4 mg·L-1)差異有顯著性(P<0.01),同Hoechst 33258染色結(jié)果相一致。實驗結(jié)果表明,蜂毒素能夠明顯促進HepG2細胞的凋亡。以上實驗結(jié)果至少重復(fù)3次。
3.3qRT-PCR檢測SHH、PTCH1、SMO及GLi1 mRNA的表達 在給予不同濃度的蜂毒素作用48 h后,采用qRT-PCR的方法檢測Hedgehog信號通路SHH、PTCH1、SMO及GLi1 mRNA的表達,結(jié)果顯示:與空白對照組相比,PTCH1 mRNA表達降低,并且蜂毒素高濃度組(4 mg·L-1)差異有顯著性(P<0.01),同時,SHH、SMO、Gli1 mRNA的表達均降低,且蜂毒素中、高濃度組(2、4 mg·L-1)差異均具有顯著性(P<0.01)。實驗結(jié)果表明,蜂毒素能明顯抑制SHH、PTCH1、SMO、Gli1 mRNA的表達,見Fig 3。所有實驗結(jié)果至少重復(fù)3~4次。
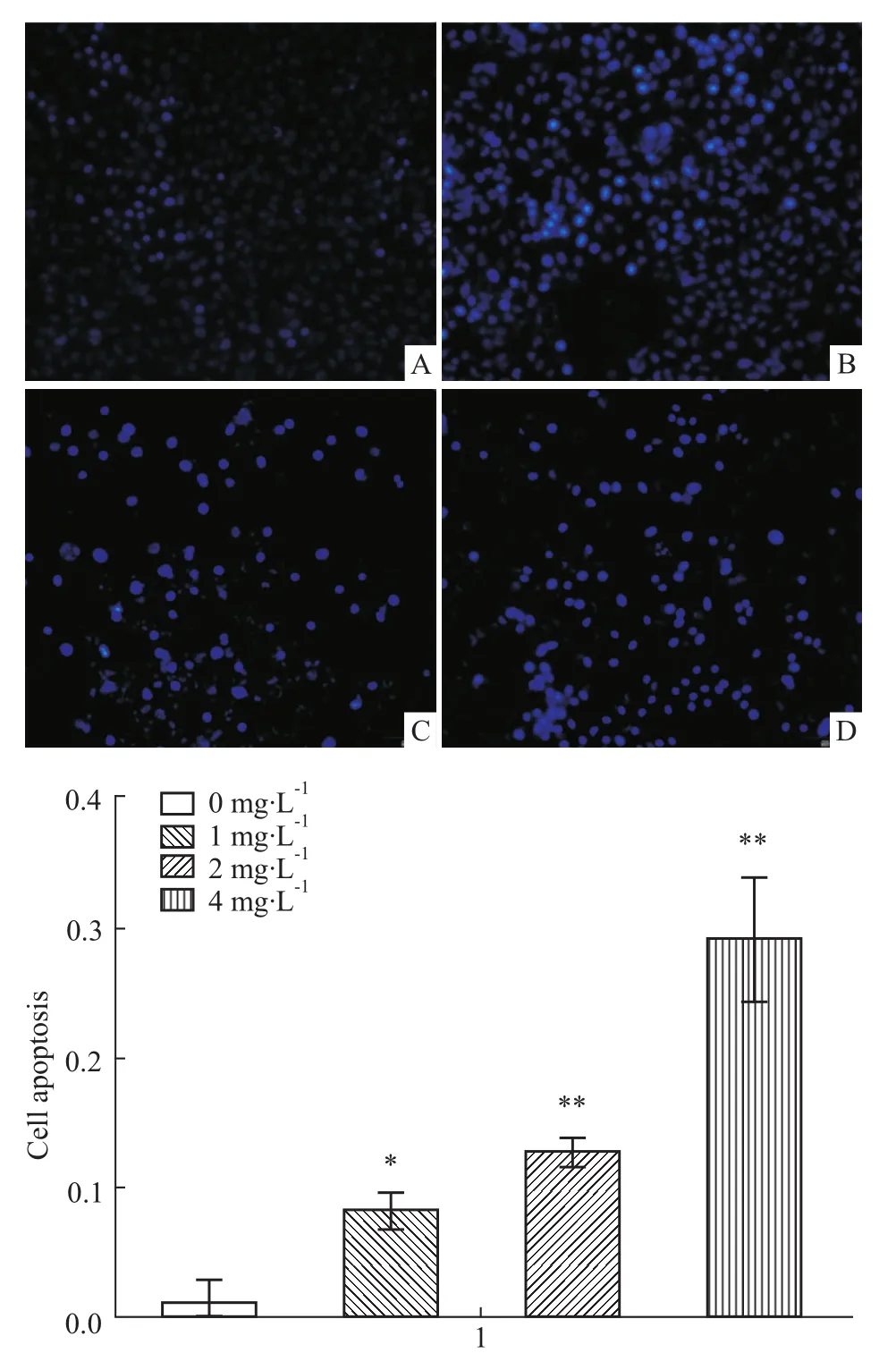
Fig 2 (A)Hoechst 33258 staining results of HepG2 cells(200×)
3.4Western blot檢測SHH、PTCH1、SMO及GLi1蛋白的表達 在給予不同濃度的蜂毒素作用48 h后,Western blot檢測Hedgehog信號通路相關(guān)蛋白表達,結(jié)果顯示:與空白對照組相比,PTCH1蛋白表達降低,并且蜂毒素高濃度組(4 mg·L-1)差異有顯著性(P<0.05),同時,SHH、SMO、Gli1蛋白表達均降低,且蜂毒素中、高濃度組(2、4 mg·L-1)差異均具有顯著性(P<0.01),這一結(jié)果同qRT-PCR結(jié)果相符。實驗結(jié)果表明,蜂毒素能明顯抑制
SHH、PTCH1、SMO、Gli1蛋白的表達。見Fig 4。所有實驗結(jié)果至少重復(fù)3~4次。
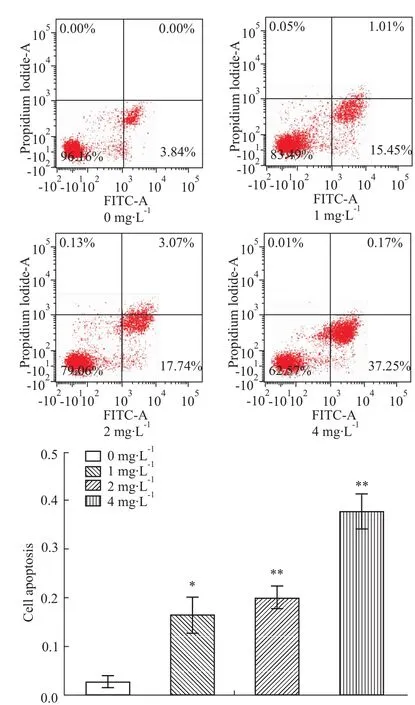
Fig 2(B) Effect of apoptosis on HepG2 cells
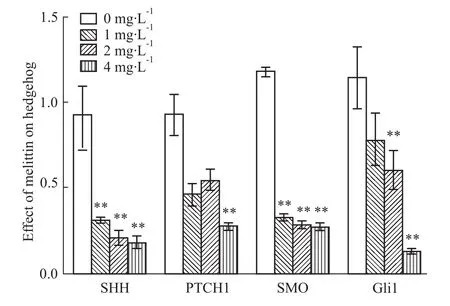
Fig 3 mRNA expression of SHH,PTCH1,SMO and GLi1 in HepG2 cells
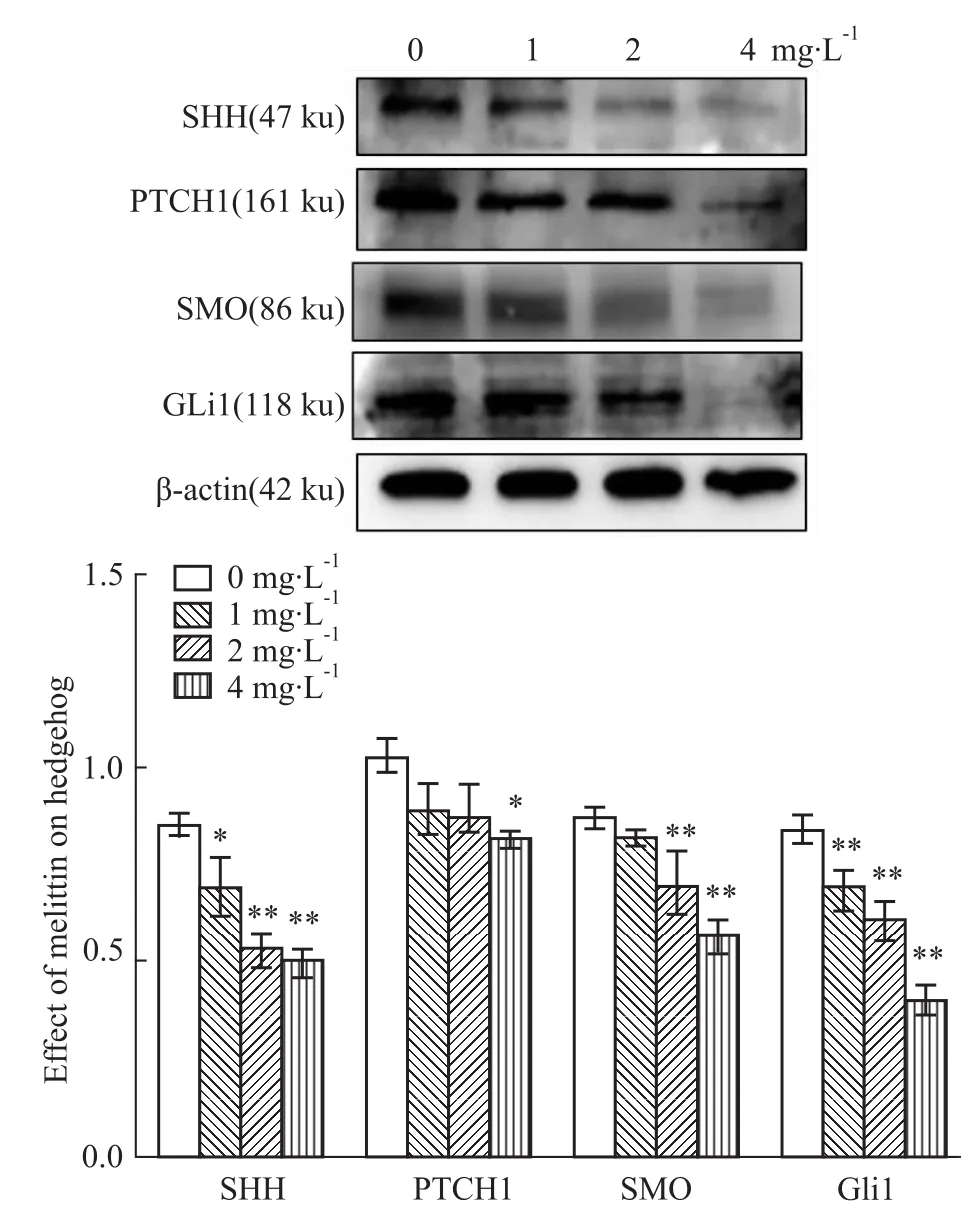
Fig 4 Protein expression levels of SHH,PTCH1,SMO and GLi1 in HepG2 cells
3.5qRT-PCR及Western blot檢測HDAC2 mR-NA和蛋白的表達 在給予不同濃度的蜂毒素作用48 h后,qRT-PCR及Western blot檢測HDAC2 mR-NA和蛋白的表達,結(jié)果顯示:與空白對照組比較,HDAC2 mRNA表達降低,且同給藥濃度呈負相關(guān),差異具有顯著性(P<0.01);Western blot也得到了相類似的結(jié)果(P<0.05)。實驗結(jié)果表明,蜂毒素能明顯抑制HDAC2的表達。見Fig 5、6。以上實驗結(jié)果至少重復(fù)3~4次。
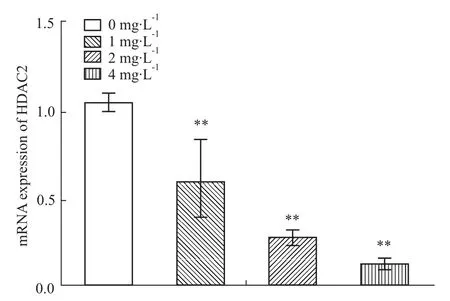
Fig 5 mRNA expression levels of HDAC2 in HepG2 cells
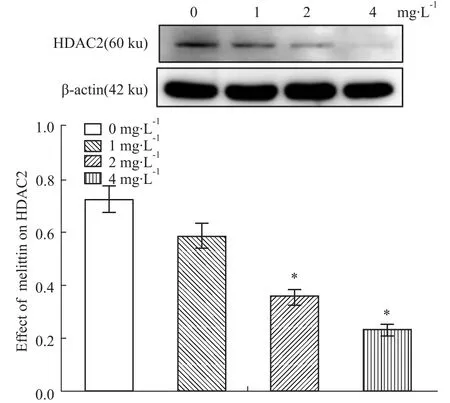
Fig 6 Protein expression levels of HDAC2 in HepG2 cells
4 討論
Hedgehog信號通路主要由Hh配體、Patched (Ptc)受體、Smoothened(SMO)跨膜蛋白、核轉(zhuǎn)錄因子Gli(glioma-association oncogene homoglog)構(gòu)成。其中Hh配體有3種,SHH、IHH和DHH,目前研究發(fā)現(xiàn)在原發(fā)性肝癌中發(fā)揮主要作用的是SHH[4]。Ptc受體有兩種,分別為Ptch1和Ptch2,二者均能同Hh配體結(jié)合,負調(diào)控Hedgehog信號通路。當(dāng)Hh配體未被激活時,Pth同SMO結(jié)合,抑制SMO活性,但是當(dāng)Hh同Ptc結(jié)合后,解除了后者對SMO的抑制作用,SMO信號傳達到胞內(nèi),激活GLi。Chung等[5]研究發(fā)現(xiàn)過表達與PTCH1同源的PTCH53能夠通過抑制SMO抑制Hh信號通路。Jeng等[6]在HCC小鼠模型上證實抑制SHH能夠抑制腫瘤的生長,降低Gli1 mRNA的表達。GLi是一個具有鋅指結(jié)構(gòu)的轉(zhuǎn)錄因子,目前發(fā)現(xiàn),Gli包括Gli1、Gli2和Gli3,其中Gli1是轉(zhuǎn)錄激活因子,其活化能夠誘導(dǎo)靶基因的轉(zhuǎn)錄,是Hh信號通路激活的重要標(biāo)志。Hedgehog信號通路在肝癌中異常表達,Che等[7]發(fā)現(xiàn)Hedge-hog信號通路中GLi1在HCC的發(fā)生發(fā)展中扮演重要角色,Huang等[8]發(fā)現(xiàn),使用環(huán)靶明或KAAD-環(huán)靶明抑制SMO,能抑制Hep3B、Huh7以及PLC/PRF/5細胞的增殖,促進其凋亡。
雖然Hedgehog信號通路與HCC的發(fā)生密切相關(guān),但該通路到底通過何種機制促進腫瘤的發(fā)生發(fā)展仍不清楚。Chen等[9]發(fā)現(xiàn)抑制Gli1后,MMP-2、9上調(diào),并阻斷EMT、VEGF從而抑制肝癌細胞的轉(zhuǎn)移和侵襲;同樣沉默GLi2后,能夠下調(diào)cyclinD1、cy- clinE2,上調(diào)p21-WAF1,從而抑制細胞增殖;同時降低c-FLIP和Bcl-2,激活Caspase-8/9和Caspase-3,誘導(dǎo)核糖聚合酶(PARP)裂解,促進凋亡[10]。最新研究發(fā)現(xiàn),丙酮酸激酶同工酶M2(PKM2)、腺苷酸活化蛋白激酶(AMPK)及激酶蛋白CK2α能夠調(diào)節(jié)GLi1,共同參與了肝癌的發(fā)展進程[11-12]。Hedgehog信號通路在HCC中的作用已被廣泛證實,其與其它信號通路的關(guān)聯(lián)值得我們進一步探討,同時也為我們提供了新的抗腫瘤藥物研發(fā)方向。
近年來,人們越來越多的將抗腫瘤藥物著眼于天然藥物的開發(fā)。自蜂毒素被發(fā)現(xiàn)具有抗腫瘤作用以來,其作用機制一直在不斷探索。蜂毒素能夠通過抑制NF-κB和AP-1依賴的MMP-9的表達抑制腫瘤的侵襲,并通過阻斷VEGFR2/COX-2介導(dǎo)的MAPK信號通路和抑制ERK和mTOR通路抑制HIF-1α/VEGF表達抑制腫瘤生長[13]。蜂毒素對肝癌也有明確的作用,蜂毒素能明顯抑制人肝癌細胞裸鼠移植瘤的生長,其作用機制可能與下調(diào)IL-8和VEGF的表達,抑制腫瘤血管生成有關(guān);蜂毒素還可通過激活CaMKII-TAK1-JUK/P38和抑制NF-κB誘導(dǎo)HCC的凋亡[14]。本實驗通過不同給藥濃度的蜂毒素對SHH、PTCH1、SMO、GLi1的作用證實,蜂毒素可能通過Hedgehog信號通路抑制人肝癌HepG2細胞增殖,促進其凋亡。
HDACs為組蛋白去乙酰化酶,其主要的功能是從N-乙酰賴氨酸中刪除乙酰基團。研究顯示異常表達的HDAC2能夠調(diào)節(jié)人肝癌細胞增殖,并影響腫瘤細胞周期。Gianluca等[15]證實Gli1和Gli2是被乙酰化了的蛋白,HDACs介導(dǎo)的去乙酰化作用能夠促進GLi1和GLi2的激活,沉默HDAC能抑制Hedgehog信號通路誘導(dǎo)的腫瘤細胞增殖。Noh等[16]發(fā)現(xiàn)異常表達的HDAC2能調(diào)節(jié)G1/S期細胞周期蛋白,影響HCC的增殖;同時研究發(fā)現(xiàn)在腫瘤遷移侵襲過程中調(diào)節(jié)細胞分化的脫乙酞酶的抑制劑(HDACi)帕比司他在HepG2、HPe3B細胞中的劑量與SHH、SMO、Pct.、GLi1的表達負相關(guān)[17]。本研究中Western blot及qRT-PCR結(jié)果顯示,與空白對照組比較,蜂毒素能降低HDAC2的表達水平,同時實驗結(jié)果顯示Hedgehog信號通路中GLi1水平明顯降低,與Gianluca結(jié)果一致,提示蜂毒素可能是通過調(diào)控HDAC2影響Hedgehog信號通路。
本實驗從細胞分子水平證實蜂毒素對人肝癌細胞HepG2的增殖和凋亡具有調(diào)控作用,其作用可能和抑制Hedgehog信號通路相關(guān),并且發(fā)現(xiàn)蜂毒素能夠抑制組蛋白去乙酰化酶2(HDAC2),且呈劑量負
相關(guān),提示Hedgehog信號通路可能受乙酰化影響,蜂毒素對HDAC2作用及后者對Hedgehog信號通路的調(diào)控和具體機制,后期將進一步深入研究。
參考文獻:
[1] Feng G S.Conflicting roles of molecules in hepatocarcinogenesis:paradigm or paradox[J].Cancer Cell,2012,21(2):150-4.
[2] Han S M,Kim J M,Park K K,et al.Neuroprotective effects of melittin on hydrogen peroxide-induced apoptotic cell death in neu-roblastoma SH-SY5Y cells[J].BMC Complement Alternat Med,2014,14:286.
[3] Lee W R,Kim K H,An H J,et al.The protective effects of melit-tin on Propionibacterium acnes-induced inflammatory responses in vitro and in vivo[J].J Invest Dermatol,2014,134(7),1922-30.
[4] Zheng X,Zeng W,Gai X,et al.Role of the Hedgehog pathway in hepatocellular carcinoma(review)[J].Oncol Rep,2013,30(5):2020-6.
[5] Chung J H,Larsen A R,Chen E,et al.A PTCH1 homolog tran-scriptionally activated by p53 suppresses hedgehog signaling[J].J Biol Chem,2014,289(47):33020-31.
[6] Jeng K S,Sheen I S,Jeng W J,et al.Blockade of the sonic Hedgehog pathway effectively inhibits the growth of hepatoma in mice:An in vivo study[J].Oncol Lett,2012,4(6):1158-62.
[7] Che L,Yuan Y H,Jia J,Ren J.Activation of sonic Hedgehog signaling pathway is an independent potential prognosis predictor in human hepatocellular carcinoma patients[J].Chin J Cancer Res,2012,24(4):323-31.
[8] Huang S,He J,Zhang X,et al.Activation of the Hedgehog path-way in human hepatocellular carcinomas[J].Carcinogenesis,2006,27(7):1334-40.
[9] Chen J S,Li H S,Huang J Q,et al.Down-regulation of Gli-1 in-hibits hepatocellular carcinoma cell migration and invasion[J].Mol Cell,2014,393(1-2),283-91.
[10]Zhang D,Liu J,Wang Y,et al.shRNA-mediated silencing of Gli2 gene inhibits proliferation and sensitizes human hepatocellular carcinoma cells towards TRAIL-induced apoptosis[J].J Cell Bio-chem,2011,112(11),3140-50.
[11]Wu D,Sui C,Meng F,et al.Stable knockdown of protein kinase CK2-alpha(CK2alpha)inhibits migration and invasion and in-duces inactivation of Hedgehog signaling pathway in hepatocellular carcinoma HepG2 cells[J].Acta Histochemica,2014,116(8):1501-8.
[12]Xu Q,Liu X,Zheng X,et al.PKM2 regulates Gli1 expression in hepatocellular carcinoma[J].Oncol Lett,2014,8(5):1973-9.
[13]Shin J M,Jeong Y J,Cho H J,et al.Melittin suppresses HIF-1alpha/VEGF expression through inhibition of ERK and mTOR/p70S6K pathway in human cervical carcinoma cells[J].PloS One,2013,8(7):e69380.
[14]Wang C,Chen T,Zhang N,et al.Melittin,a major component of bee venom,sensitizes human hepatocellular carcinoma cells to tumor necrosis factor-related apoptosis-inducing ligand(TRAIL)-induced apoptosis by activating CaMKII-TAK1-JNK/p38 and in-hibiting IkappaBalpha kinase-NFkappaB[J].J Biol Chem,2009,284(6):3804-13.
[15]Canettieri G,Di Marcotullio L,Greco A,et al.Histone deacety-lase and Cullin3-REN(KCTD11)ubiquitin ligase interplay regu-lates Hedgehog signalling through Gli acetylation[J].Nat Cell Bi-ol,2010,12(2):132-42.
[16]Noh J H,Jung K H,Kim J K,et al.Aberrant regulation of HDAC2 mediates proliferation of hepatocellular carcinoma cells by deregulating expression of G1/S cell cycle proteins[J].PloS One,2011,6(11):e28103.
[17]黃繼錦,李長福.Hedgehog信號通路在肝癌中的研究進展[J].中醫(yī)藥現(xiàn)代遠程教育,2014,12(7):156-8.
[17]Huang J J,Li C C.Hedgehog pathway in human hepatocellular carcinomas[J].Chin Med Mod Distance Educat China,2014,12 (7):156-8.
Effect of melittin on proliferation and apoptosis of human HepG2 cells
SHEN Wen-wen,ZHAO Bin,HUANG Cheng,MENG Xiao-ming,CHEN Zhao-lin,WU Xiao-qin,LI Jun
(School of Pharmacy,Anhui Medical University,Institute of Liver Diseases of Anhui Medical University,Anhui Institute of Innovative Drugs,Hefei 230032,China)
Abstract:Aim To observe the effect of melittin on human hepatocelluar carcinoma HepG2 cell prolifera-tion in vitro and its further mechanisms.Methods The capacity of cellular proliferation and apoptosis was measured with the 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide(MTT)assay,Hoechst 33258 assay and Annexin V-FITC/PI assay.The mR-NA expression of Shh,PTCH1,SMO,GLi1 and HDAC2 was performed by qRT-PCR.And the protein expression of Shh,PTCH1,SMO,GLi1 and HDAC2 was assessed by western blotting.Results Our study found that melittin effectively inhibited cell prolifera- tion and promoted cell apoptosis in vitro using MTT method and Flow cytometry.The mRNA and protein expression of Shh,PTCH1,SMO,GLi1 and HDAC2 were obviously decreased after treated with various con-centrations of melittin for 48h in HepG2 cells.Conclu-sions Taken together,our data suggest that melittin could inhibit cell proliferation and promote cell apopto-sis,reduce the level of HDAC2 and down-regulate the Hedgehog signaling pathway in this process simultane-ously.
Key words:melittin;HDAC2;Hedgehog signaling pathway;proliferation;apoptosis;HepG2 cells
作者簡介:沈文文(1988-),男,碩士,研究方向:抗炎免疫藥理學(xué),E-mail:aswen1988@163.com;李 俊(1960-),男,博士,教授,博士生導(dǎo)師,研究方向:臨床藥理學(xué),抗炎免疫藥理學(xué),通訊作者,Tel:0551-65161001,E-mail:lijun@ahmu.edu.cn
基金項目:國家自然科學(xué)基金資助項目(No 81273526);博士點基金項目(No 20123420120001);安徽省教育廳基金資助項目(No KJ2012A156);安徽省自然科學(xué)基金項目(No 1308085MH145);安徽醫(yī)科大學(xué)基金項目(No XJ201118)
收稿日期:2015-04-27,修回日期:2015-05-29
文獻標(biāo)志碼:A
文章編號:1001-1978(2015)09-1222-06
doi:10.3969/j.issn.1001-1978.2015.09.009