免疫磁珠聯合定量PCR檢測胰腺癌患者冷凍前后循環腫瘤細胞的變化
穆峰 陳繼冰 姜峰 汪媛 曾健瀅 姚飛 牛立志 徐克成
·論著·
免疫磁珠聯合定量PCR檢測胰腺癌患者冷凍前后循環腫瘤細胞的變化
穆峰 陳繼冰 姜峰 汪媛 曾健瀅 姚飛 牛立志 徐克成
目的采用免疫磁珠(MACS)聯合定量PCR法檢測胰腺癌患者外周血循環腫瘤細胞(CTCs) ,分析冷凍消融術前后CTCs變化及其與患者預后的關聯性。方法 收集2011年11月至2013年6月暨南大學醫學院附屬復大腫瘤醫院收治的20例行冷凍消融術的胰腺癌患者,使用MACS聯合定量PCR法檢測患者術前及術后10 d外周血CTCs。治療后隨訪2年,記錄患者的預后,分析CTCs對患者預后的預測價值。結果 20例患者冷凍術前1 d 外周血CTCs陽性檢測率為45.0%,冷凍術后10 d CTCs陽性檢測率為15.0%,治療后患者的CTCs陽性率較術前顯著下降,差異有統計學意義(χ2=4.286,P<0.05)。3例術后CTCs陽性患者的中位生存期為5個月,17例術后CTCs陰性患者中位生存期為8個月,CTCs陰性患者的生存期顯著長于CTCs陽性患者,差異有統計學意義(χ2=5.552,P=0.0185)。結論 采用MACS聯合定量PCR法檢測胰腺癌患者外周血CTCs,對評估行冷凍治療胰腺癌患者的預后有一定臨床價值。
胰腺腫瘤; 循環腫瘤細胞; 預后; 冷凍消融術
胰腺癌是世界范圍內對人類生存威脅較大的惡性腫瘤,90%的胰腺癌患者在診斷后1年內死亡,5年生存率僅為1%~3%[1-2]。雖然以手術為主的綜合治療可延長生存率,但是5年生存率仍較低,約為4%,即使行根治性切除術,80%的患者2年內出現復發[3-6]。其預后不良的原因主要是轉移。大量研究表明,循環血腫瘤細胞(circulating tumor cells,CTCs)水平是一種可靠的預后指標,它能有效地預測腫瘤患者的進展情況和預后生存期[7-8]。Kurihara等[9]采用免疫磁珠負性富集結合免疫熒光染色的方法檢測胰腺癌患者CTCs,結果顯示術前檢測出CTCs的患者預后不良。本研究采用免疫磁珠負性富集結合熒光定量PCR的方法檢測胰腺癌患者冷凍消融治療前后外周血CTCs的變化,評價其對胰腺癌患者臨床預后的應用價值。
材料與方法
一、研究方案
收集暨南大學醫學院附屬復大腫瘤醫院2011年11月至2013年6月入院接受冷凍治療的胰腺癌患者的病例資料。入組標準:(1)經病理及影像學確診的4期胰腺癌;(2)患者經綜合分析原發灶不可手術切除,且接受冷凍消融治療;(3)患者簽署知情同意書,同意入組。本研究經廣州復大腫瘤醫院倫理委員會的批準,并在倫理委員會指導下進行。經過整理,共20例胰腺癌患者入組,其中男性12例,女性8例,年齡42~84歲,中位年齡65歲。胰腺導管腺癌16例,其他類型胰腺癌4例。
二、CTCs免疫磁性標記、富集和分選
采集入組患者冷凍消融術前1 d及術后10 d外周血10 ml,分離外周血單核細胞(PBMC),將分選FC受體(FcR)阻斷劑(100 μl)和抗上皮細胞黏附分子(Epithelial cell adhesion molecule,EpCAM)單抗耦聯的磁性微珠(100 μl)先后加入樣本的細胞懸液混勻,4~8℃孵育30 min,然后將細胞懸液流經置于磁場中的MS分選柱進行EpCAM陽性細胞分選。免疫磁珠分選系統(MACS)和EpCAM陽性細胞分選試劑盒均購自德國美天妮公司,按說明書操作。
三、RNA提取及cDNA合成
采用Trizol(Invitrogen公司) 提取經免疫磁珠富集分離后的細胞總RNA,紫外分光光度計測濃度后,取2 μg mRNA逆轉錄成cDNA。反應總體積為20 μl,含25 mmol/L MgCl24 μl,Oligod引物1 μl,10 mmol/L dNTP 1 μl,10×RT buffer 2 μl,RNA酶抑制劑0.5 μl,AMV反轉錄酶0.625 μl。反轉錄條件:42℃ 60 min,95℃ 5 min,最后反應產物稀釋至100 μl,置-20℃冰箱儲存。所用試劑均購于大連寶生物工程公司。
四、熒光定量PCR檢測
根據GeneBank目的基因的cDNA序列,應用Primer 3.0軟件設計跨內含子引物。引物序列見表1,委托生工生物工程(上海)有限公司合成。使用SYBR?PremixExTaqTM(TARAKA,大連)檢測mRNA表達。反應體系:cDNA 2 μl,SYBR?PremixExTaqTM10 μl,50×Rox Reference Dye 0.4 μl,10 μmol/L上下游引物各0.4 μl,ddH2O 6.8 μl,總共20 μl。PCR擴增條件:94℃ 5 min, 95℃ 5 s、60℃ 20 s、72℃ 15 s,40個循環。以ACTB為內參。

表1 胰腺CTC表面標志物的擴增引物
五、免疫磁珠負性富集結合熒光定量PCR法的檢測
計數106個PANC1胰腺癌細胞,逐級進行10倍稀釋,獲取105、104、103、102、10、1個胰腺癌細胞,提取RNA,分別與10 ml健康志愿者血標本所提取的RNA相混合后進行定量RT-PCR檢測。擴增效率設為96%~104%;斜率設置為-3.1~-3.5和-3.113;R2≥0.99。檢測閥值設定在最低樣本濃度情況下4個腫瘤標志物同時出現擴增信號時的Ct值[10],KRT19、MUC1、CEACAM5、BIRC5的檢測Ct閾值分別為36.8、37.5、37.6、38.0。任意一個基因的擴增Ct值大于該閥值即為CTCs陽性。
六、統計分析
應用美國San Diego公司GraphPad軟件進行統計學分析。采用χ2檢驗比較冷凍前后CTCs變化,生存率曲線采用Kaplan-Me-ier方法描繪,采用Long-rank檢驗比較生存期差異。P<0.05表示差異有統計學意義。
結 果
一、冷凍前后CTCs表面標志物表達的變化
冷凍治療前共9例CTCs陽性,陽性率為45.0%,其中3個標志物均陽性2例,2個標志物陽性7例;術后共3例CTCs陽性,陽性率為15.0%,其中3個標志物均陽性1例,2個標志物均陽性2例。術前陽性的9例中7例術后轉陰;1例術前3個標志物陽性,術后2個標志物仍陽性,1個標志物轉陰;1例術前3個標志物陽性,術后2個標志物轉陰,1個標志物術前為陰性,術后轉陽。1例術前陰性者術后3個標志物轉陽。20例患者KRT19、MUC1、BIRC1、CEACAM5具體表達情況見表2。冷凍治療后外周血CTCs陽性率較術前顯著下降,差異有統計學意義(χ2=4.286,P=0.038)。
二、治療后CTCs轉陰與預后的關系
20例患者冷凍術后隨訪2年,3例術后CTCs陽性患者的中位生存期為5個月,17例術后CTCs陰性患者中位生存期為8個月,CTCs陰性患者的生存期顯著長于CTCs陽性患者,差異有統計學意義(χ2=5.552,P=0.0185,圖1)。
討 論
腫瘤細胞進入外周血循環稱之為CTCs,它們形成的微轉移灶是腫瘤遠處轉移的前提,但并不是所有進入外周血的腫瘤細胞均能夠導致遠處轉移,因為進入循環系統的腫瘤細胞絕大多數會在短期內死亡。由于宿主的免疫識別和機械殺傷作用以及腫瘤細胞自身因素,只有極少數具有高度活力,高度轉移潛能的腫瘤細胞在循環系統中得以生存,相互聚集或分裂增殖形成微小癌栓,并在一定條件下再次脫離循環系統,進入組織內發展為遠處轉移灶,因此CTCs是經過體內免疫系統的篩選之后所剩余的腫瘤細胞,其在生物學特性上具有和腫瘤干細胞相似的特點。少數具有干細胞特性的腫瘤細胞可以在不同于原位腫瘤的微環境中存活,稱之為循環腫瘤干細胞。
CTCs抵達組織、器官可以形成新的腫瘤,檢測這些細胞表面的腫瘤標志物可明確CTCs的存在。目前研究顯示,乳腺癌、結直腸癌、腦瘤等惡性腫瘤中CTCs的數量均與患者的預后密切相關[7-8, 11],De Giorg等[12]對晚期乳腺癌進行PET-CT檢查,并檢測患者外周血CTCs,結果顯示有骨轉移患者的CTCs
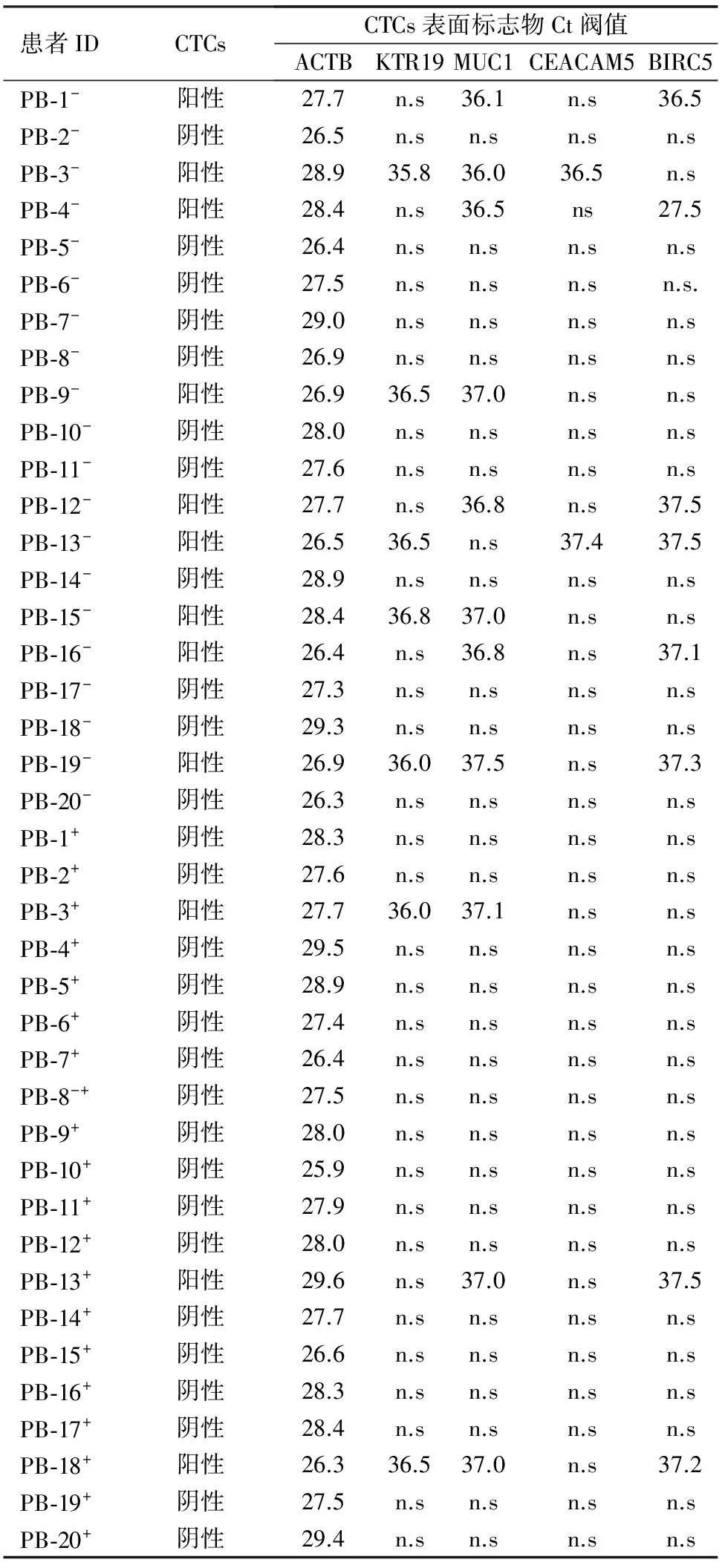
表2 腫瘤細胞表面標志物mRNA表達情況
注:“-”冷凍治療前,“+”冷凍治療后,n.s未發現該基因表達
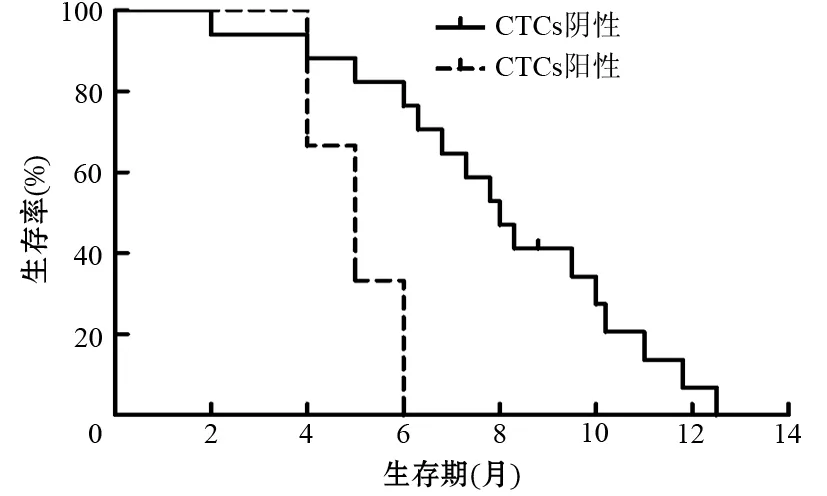
圖1 冷凍治療患者的術后生存時間
數量顯著多于無骨轉移者,認為CTCs是影響預后的獨立危險因素。本研究利用MACS聯合定量PCR法檢測胰腺癌外周血KTR19、MUC1、BIRC1、CEACAM5腫瘤標志物,分析胰腺癌冷凍消融術前后外周血CTCs的變化。結果顯示20例行冷凍消融術的胰腺癌患者的術前CTCs陽性率為45.0%,術后降為15.0%,術后CTCs陰性患者總生存期顯著長于CTCs陽性患者,提示檢測外周血CTCs可能在評估冷凍術后患者預后方面有一定價值。至于本研究中有1例術前陰性術后轉陽是何原因尚待進一步探討。
[1] Jemal A, Siegel R, Xu J, et al. Cancer statistics, 2010[J]. CA Cancer J Clin,2010,60(5):277-300.
[2] Orr RK. Outcomes in pancreatic cancer surgery[J]. Surg Clin North Am,2010,90(2):219-234.
[3] Rosty C, Goggins M. Early detection of pancreatic carcinoma[J]. Hematol Oncol Clin North Am,2002,16(1):37-52.
[4] Wagner M, Redaelli C, Lietz M, et al. Curative resection is the single most important factor determining outcome in patients with pancreatic adenocarcinoma[J]. Br J Surg, 2004, 91(5): 586-594.
[5] 張太平, 杜瀟, 趙玉沛. 多學科綜合治療胰腺癌現狀及評價[J]. 中國實用外科雜志,2009,29(9): 771-773.
[6] 姚飛, 陳繼冰, 袁遠英,等. 冷凍消融聯合DC-CIK治療伴轉移的胰腺癌[J]. 中華胰腺病雜志,2013, 13(5):335-337.
[7] Paterlini-Brechot P, Benali NL. Circulating tumor cells (CTC) detection: clinical impact and future directions[J]. Cancer Lett,2007,253(2):180-204.
[8] Mostert B, Sleijfer S, Foekens JA, et al. Circulating tumor cells (CTCs): detection methods and their clinical relevance in breast cancer[J]. Cancer Treat Rev,2009,35(5):463-474.
[9] Kurihara T, Itoi T, Sofuni A, et.al. Detection of circulating tumor cells in patients with pancreatic cancer: a preliminary result[J]. J Hepatobiliary Pancreat Surg,2008,15(2):189-195.
[10] de Albuquerque A, Kubisch I, Breier G, et al. Multimarker gene analysis of circulating tumor cells in pancreatic cancer patients: a feasibility study[J]. Oncology, 2012,82(1):3-10.
[11] Alunni-Fabbroni M, Sandri MT. Circulating tumour cells in clinical practice: Methods of detection and possible characterization[J]. Methods,2010,50(4):289-297.
[12] De Giorgi U, Valero V, Rohren E, et al. Circulating tumor cells and bone metastases as detected by FDG-PET/CT in patients with metastatic breast cancer[J]. Ann Oncol, 2010,21(1):33-39.
(本文編輯:屠振興)
·讀者·作者·編者·
稿件遠程管理系統作者投稿說明
1.瀏覽器中輸入http:∥www.cma.org.cn/ywzx/ywzx.asp;
2.網站注冊(用戶名和密碼為您在中華醫學會統一的登錄信息,請牢記!忘記密碼時可通過填寫的郵箱索取密碼);
3.申請成為雜志作者;
4.進入系統,點擊左菜單欄中的【稿件遠程管理系統】,相應的功能就顯示在下方;
5.點擊“作者投稿”,按照投稿要求填寫內容;
6.點擊“投稿”,稿件投給當前雜志編輯部;
7.點擊“暫存”,稿件進入【我的草稿】模塊;
8.作者還可以在系統中進行稿件狀態查詢、與編輯部溝通、稿件退修后的修改。
Change of circulating tumor cells in pancreatic cancer patients detected by magnetic activated cell sorting (MACS) combined with RT-qPCR
MuFeng,ChenJibing,JiangFeng,WangYuan,ZengJianying,YaoFei,NiuLizhi,XuKecheng.DepartmentofOncologicalSurgery,FudaCancerHospital,MedicalCollegeofJinanUniversity,Guangzhou510665,China
Correspondingauthor:NiuLizhi,Email:fudaclab@gmail.com
Objective To evaluate the circulating tumor cells (CTCs) in peripheral blood by using magnetic activated cell sorting (MACS) combined with RT-qPCR, and analyze the relationship between CTCs and the prognosis. Methods From January 2013 to December 2014, 20 pancreatic cancer patients underwent cryoblation in Fuda Cancer Hospital Affiliated to Medical College of Jinan University were enrolled. MACS combined with RT-qPCR were used to identify preoperative CTCs and CTCs at 10 days postoperatively. The patients were followed in the next two year, and the prognosis was recorded, then the relationship between CTCs and the prognosis was analyzed. Results In the 20 cases, positive rate of preoperative CTCs was 45%, which decreased to 15% postoperatively, and the difference between the two groups was statistically significant (χ2=4.286,P<0.05). The median survival of 3 patients with positive CTCs was 5 months, and the median survival of 17 patients with negative CTCs was 8 months, the median survival of patients with negative CTCs was significantly longer than those patients with positive CTCs, and the difference between the two groups was statistically significant (χ2=5.552,P=0.0185). Conclusions It is of value to detect the circulating tumor cells in peripheral blood by MACS combined with RT-qPCR. CTCs is a potential indicator for predicting the prognosis of pancreatic cancer with cryoablation.
Pancreatic neoplasms; Circulating tumor cell; Prognosis; Cryosurgery
10.3760/cma.j.issn.1674-1935.2015.06.002
廣州天河區科技計劃項目資助(201209kw008)
510665 廣州,暨南大學醫學院附屬復大腫瘤醫院腫瘤外科
牛立志,Email: fudaclab@gmail.com
2015-02-02)

