GLT-1激動劑頭孢曲松鈉對慢性神經病理性痛的影響
盧麗莉 楊倩 仇艷玲 易力
GLT-1激動劑頭孢曲松鈉對慢性神經病理性痛的影響
盧麗莉楊倩仇艷玲易力
【摘要】目的探討頭孢曲松鈉( Ceftriaxone,Cef)對慢性神經病理性痛過敏及GLT-1表達的影響。方法雄性SD大鼠90只,隨機分為Sham組、CCI 14 d組、Cef預防組、Cef治療組,后2組設腹腔注射NS組為對照,在不同時間點測定熱縮足反射潛伏期;另設CCI 1 d、4 d、7 d組。應用免疫組化觀察不同時間點脊髓后角GLT-1表達的變化。結果
CCI誘導大鼠產生了熱痛敏,腹腔注射NS對CCI誘導的熱痛敏無影響。Cef預防組大鼠CCI側后肢熱縮足反射潛伏期于CCI后第5天、第7天明顯延長( P<0.05) ; Cef治療組大鼠CCI側后肢熱縮足反射潛伏期在術后第11天、第14天明顯延長( P<0.05)。免疫組化檢測發現,Cef預防組和Cef治療組分別抑制和逆轉了GLT-1在CCI后期表達的降低。結論Cef可通過上調GLT-1的表達對慢性神經病理性痛起到預防和治療作用。
【關鍵詞】慢性神經病理性疼痛;頭孢曲松鈉; GLT-1; CCI
谷氨酸是中樞神經系統最主要的興奮性神經遞質,參與脊髓水平傷害性信息的傳遞及痛覺過敏的形成[1]。由于胞外沒有谷氨酸的代謝酶,胞外谷氨酸的清除主要依靠谷氨酸轉運體[2]。目前已克隆出五種高親和力谷氨酸轉運體GLAST ( EAAT1)、GLT-1 ( EAAT2)、EAAC1( EAAT3)、EAAT4和EAAT5[3-7]。眾多文獻表明,GLT-1在病理性痛和痛過敏的發生和維持中發揮重要作用。2005年Rothstein等[8]在《Nature》上報道,β-內酰胺類抗生素(包括青霉素和一些新的衍生物)具有新的功能,其中頭孢曲松( Ceftriaxone,Cef)可增加GLT-1的表達和谷氨酸的攝取。但β-
內酰胺類抗生素是否會對慢性神經病性疼痛過程產生影響尚未報道。本研究觀察β-內酰胺類抗生素Cef對CCI大鼠慢性神經病理性痛過敏的影響,并觀察脊髓GLT-1表達的變化,為闡明GLT-1在病理性痛中的作用提供依據,為臨床上病理性痛的防治提供新線索與思路。
1 材料與方法
1.1實驗動物分組健康雄性Sprague-Dawley大鼠90只,體重( 280±20) g,將動物隨機分組: Sham組( n =10) :僅暴露坐骨神經不進行結扎;于術前1 d,術后第1天、3天、5天、7天、9天、11天、14天測定熱縮足反射潛伏期后,取材觀察GLT-1表達的變化。CCI 14 d組:行右側CCI,其他步驟同Sham組。另設CCI 1 d、CCI 4 d和CCI 7 d組觀察CCI后GLT-1表達的動態變化( n =10)。Cef預防( CCI + Cef 7)組( n =10) : 于CCI手術后當天開始腹腔注射Cef,1次/d,共注射7次。于CCI術前1 d,術后第1天、3天、5天、7天觀察熱縮足反射潛伏期變化。完成上述程序后取材觀察GLT-1表達的變化。另設10只動物以相同程序腹腔注射NS為對照( CCI + NS 7)組。Cef治療( CCI + Cef 14)組( n =10) :于CCI手術后第7天開始腹腔注射Cef,1次/d,共注射7次。其他同Sham組。完成上述程序后取材觀察GLT-1表達的變化。另設10只動物以相同程序腹腔注射NS為對照( CCI + NS 14)組。
1.2熱縮足反射潛伏期的測定參照Bennett等[9]的方法制作CCI模型。應用BME-410A型熱痛刺激儀(光源為12 V/35 W鹵素燈)進行。測痛實驗臺高36 cm,頂部為2 mm厚的石英玻璃板,將有機玻璃板制成的動物籠( 220 mm×220 mm×280 mm,無底,用有機玻璃隔板隔成3個23 cm×11 cm×28 cm的獨立空間)置于測痛實驗臺頂部的石英玻璃板上,將待測動物置于籠內,調節光源與石英玻璃板之間的距離,使落在足底的照射光圈直徑5 mm,記錄從開始照射至出現縮足逃避反射的時間( s),作為熱刺激縮足潛伏期。重復測量5次,同一部位間隔10 min,不同部位間隔5 min,取平均值作為統計數值。如大于30 s無反應則停止照射,以免導致大鼠足底組織過熱損傷。
1.3取材、固定及免疫組化在預定時間點,將動物迅速斷頭,取出腰5( L5)脊髓節段,將所取標本置于4%多聚甲醛固定液中固定24 h,經脫水、透明、浸蠟、包埋后,連續橫截面切片,片厚約5 μm,石蠟切片經二甲苯透明,常規梯度乙醇脫蠟,3%甲醇-過氧化氫,室溫下孵育15 min,10%血清工作液封閉抗原,豚鼠抗GLT-1抗體( 1∶1 000),4℃冰箱過夜,生物素化二抗IgG(羊抗豚鼠1∶2 000),37℃恒溫水浴鍋濕盒內孵育60 min,辣根酶標記鏈霉卵白素工作液,37℃恒溫水浴鍋濕盒內孵育50 min,DAB顯色,梯度乙醇脫水、二甲苯透明、中性樹膠封片。每例動物隨機選取6張切片,于Olympus光學顯微鏡下進行定性觀察。應用形態學圖象分析系統軟件(江蘇捷達,JEDA801D)進行積分光密度( IOD)、平均光密度( AO)的測量。
1.4統計學分析應用SPSS 11.5統計軟件,計量資料以珋x±s表示,采用單因素方差分析( One-Way ANOVA)和t檢驗( paried t-test),P<0.05為差異有統計學意義。
2 結果
2.1熱縮足反射潛伏期Sham組大鼠手術側后肢熱縮足反射潛伏期在所觀測的14 d內均無明顯變化。CCI 14 d組大鼠CCI前熱縮足反射潛伏期在14 s左右,于CCI后第3天大鼠CCI側后肢熱縮足反射潛伏期開始下降,與Sham組比較明顯縮短( P<0.05)。術后第5~7天下降到基礎值的55%左右,達最低值,一直持續到所測試的第14天。CCI + NS7組CCI側后肢熱縮足反射潛伏期與CCI組比較未見明顯變化,而Cef預防組大鼠CCI側后肢熱縮足反射潛伏期于CCI后第5天、第7天同NS對照組相比明顯延長。Cef治療組CCI側后肢熱縮足反射潛伏期在術后第11天、第14天與NS對照組比較明顯延長。未手術側后肢熱縮足反射潛伏期在所觀測的14 d內各時間點無明顯變化。見表1。
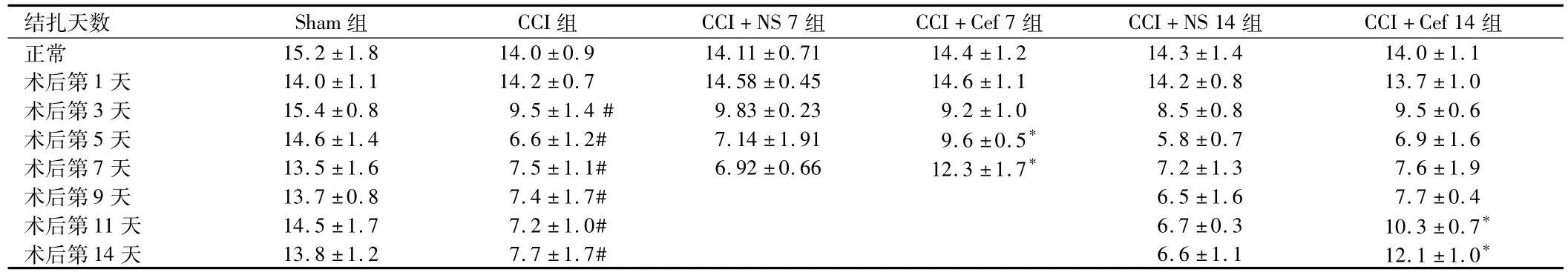
表1 大鼠熱縮足潛伏期n =10,x珋±s
2.2免疫組化脊髓后角GLT-1表達的變化CCI后脊髓后角GLT-1的表達出現先升高后降低的雙向性
變化。與Sham組比較,CCI后第1天和第4天脊髓后角淺層GLT-1的表達顯著增強,表現為IOD、AO值明顯增加( P<0.05)。CCI后第7天和第14天脊髓后角淺層GLT-1的表達下降,表現為IOD、AO值明顯降低( P<0.05)。Cef預防組GLT-1的表達較CCI + NS 7組顯著升高,表現為IOD、AO值增加( P<0.05),表明預先給予的Cef抑制了GLT-1在CCI后期表達的降低。Cef治療組GLT-1的表達較CCI + NS 7組顯著升高,表明GLT-1表達下降后再給予Cef逆轉了GLT-1表達的降低,表現為IOD、AO值的增加( P<0.05),而CCI + NS 7組GLT-1的表達同CCI 14 d組比較無明顯變化。見圖1。
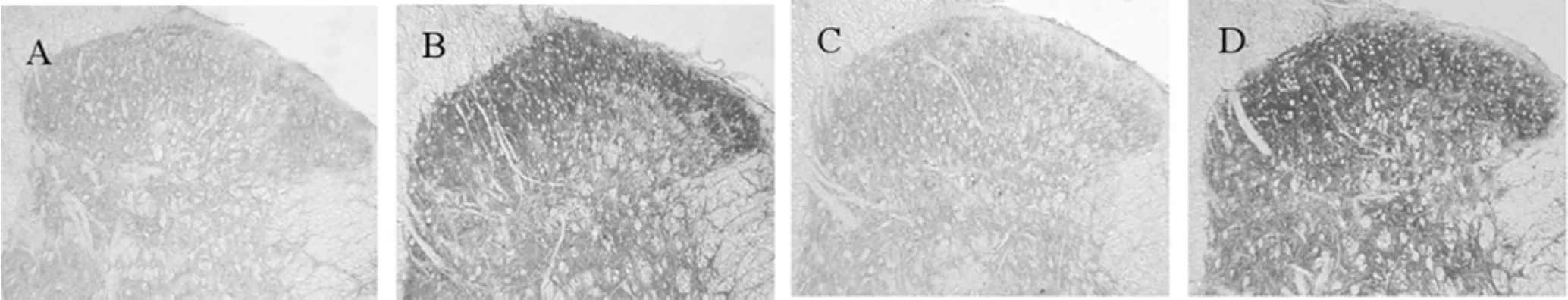
圖1 腹腔注射0.9%氯化鈉溶液或頭孢曲松鈉后腰5脊髓后腳GLT-1表達的變化A: CCI + NS7組,B: CCI + Cef 7組,C: CCI + NS14組,D: CCI + Cef 14組(免疫組化×100)
3 討論
谷氨酸是中樞神經系統最主要的興奮性氨基酸,參與脊髓傷害性信息的傳遞。由于沒有谷氨酸代謝酶,所以胞外谷氨酸的攝取主要靠高效的谷氨酸轉運體系統來實現[10,11]。許多研究表明調節谷氨酸轉運體的表達和攝取對維持體內谷氨酸的穩態起重要的作用。
研究發現,通過連續腹腔注射Cef 7 d后,Cef可通過血腦屏障進入腦和脊髓,可以選擇性地誘發編碼GLT-1谷氨酸轉運體的基因轉錄,增加GLT-1的腦內表達,并增強其功能活性[8]。在本實驗中觀察到CCI大鼠脊髓后角GLT-1的表達出現雙向性變化,術后第1天和第4天表達明顯升高,術后第7天和第14天表達減少。最初GLT-1的上調作為一種保護性的機制,攝取突觸間隙的谷氨酸,減少了這種過度激活導致的有害影響。有研究表明,神經損傷后導致谷氨酸的釋放,可反饋性的引起GLT-1的上調[12]。隨后GLT-1下調。有人推測這種下調可能是由于失去了初級傳入引起的[12],脊髓的退化性變化也對GLT-1的下調起到了一定作用。后期脊髓GLT-1的下調使脊髓谷氨酸在突觸間隙過多蓄積,結果導致谷氨酸受體的異常激活,是脊髓敏感化乃至痛覺過敏產生的重要機制[1]。這樣脊髓GLT-1的下調在慢性神經病理性疼痛的產生和維持中起到了重要的作用。本實驗觀察到腹腔連續注射NS對CCI誘導的熱痛敏無影響,而預防性和治療性腹腔注射Cef 7 d后,發現CCI大鼠CCI側后肢熱縮足反射潛伏期同NS對照組比較明顯升高。免疫組化檢測發現腹腔注射NS后對GLT-1的表達無顯著影響,而腹腔注射Cef預防組和治療組的GLT-1表達與NS對照組比較均明顯增加。GLT-1表達的這種變化在其以上結果表明,腹腔注射Cef可以減輕CCI誘導的熱痛敏和機械性痛敏,并且使脊髓GLT-1表達增加。在病理性疼痛狀態下,阻斷脊髓谷氨酸轉運體的攝取后,可導致脊髓谷氨酸的過多蓄積,引起谷氨酸受體過度激活,產生自發性痛和痛覺過敏。腹腔注射Cef激動了GLT-1的表達,從而使脊髓細胞間隙內的谷氨酸維持在低水平,減少谷氨酸受體的過度激活,從而抑制了熱痛敏和機械性痛敏的產生和發展。
參考文獻
1Faden AI,Demediuk P,Panter SS,et al.The role of excitatory amino acids and NMDA receptors in traumatic brain injury.Science,1989,244: 798.
2Seal RP,Amara SG.Excitatory amino acid transporters: a family in flux.Annu Rev Pharmacol Toxicol,1999,39: 431-456.
3Arriza JL,Kavanaugh MP,Fairman WA,et al.Cloning and expression of a human neutral amino acid transporter with structural similarity to the glutamate transporter gene family.J Biol Chem,1993,268: 15329-15332.
4Fairman WA,Vandenberg RJ,Arriza JL,et al.An excitatory amino acid transporter with properties of a ligand-gated chloride channel.Nature,1995,375: 599-603.
5Kanai Y,Hediger MA.Primary structure and functional characterization of a high-affinity glutamate transporter.Nature,1992,360: 467-471.
6Pines G,Danbolt NC,Bjoras M,et al.Cloning and expression of a rat brain L-glutamate transporter.Nature,1992,360: 464-467.
7Storck T,Schulte S,Hofmann K,et al.Structure,expression,and functional analysis of a Na-dependent glutamate/ aspartate transporter from the rat brain.Proc Natl Acad Sci USA,1992,789: 10955-10959.
8Rothstein JD,Patel S,Regan MR,et al.β-lactam antibiotics offer neuroprotection by increasing glutamate transporter expression.Nature,2005,433: 73-77.
9Bennett GJ,Xie YK.A peripheral mononeuropathy in rat that produces disorder of pain sensation like those seen in man.Pain,1988,33: 87-107.
10Robinson MB,Dowd LA.Heterogeneity and functional properties of subtypes of sodium-dependent glutamate transporters in the mammalian central nervous system.Adv Pharmacol,1997,37: 69-115.
11Danbolt NC.Glutamate uptake.Prog Neurol,2001,65: 1-105.
12Minami T,Matsumura S,Okuda-Ashitaka E,et al.Charact-erization of the glutamatergic system for induction and maintenance of allodynia.Brain Res,2001,895: 178-185.
·論著·
項目來源:石家莊市科學技術研究與發展指導計劃項目(編號: 131461223)
作者單位: 050011河北省石家莊市第三醫院病理科(盧麗莉、易力) ;河北省石家莊市第四醫院病理科(楊倩) ;河北省優撫醫院老年病科(仇艷玲)
Effect of ceftriaxone on chronic neuropathic pain and the expression of GLT-1 in rats
LU Lili*,YANG Qian,QIU Yanling,et al.*Department of Pathology,The Third Hospital of Shijiazhuang City,Shijiazhuang 050011,China
【Abstract】Objective To investigate the effects of( Ceftriaxone,Cef) on chronic neuropathic pain and the expression of GLT-1 in rats.Methods Ninety male Spague-Dawley rats were randomly divided into sham-operation group,CCI 14d group,Cef prevention group,Cef therapy group,at the same time,the two groups with intraperitoneal injection with NS were designed as control groups for the last two groups.The thermal withdrawal latency was measured in different time points,in addition,CCI 1d,CCI 4d and CCI 7d groups were designed to observe dynamic change of GLT-1 expression after CCI.The changes of GLT-1 expression in dorsal horn of spinal cord were detected by immunohistochemistry.Results The thermal hyperalgesia in rats was induced by chronic crushing injury( CCI),however,intraperitoneal injection with NS had no effect on thermal hyperalgesia induced by CCI.The thermal withdrawal latency was obviously prolonged in Cef prevention group on the 5th day,the 7th day after CCI( P<0.05),moreover,which in Cef therapy group was significantly prolonged on the 11th day,14th day after CCI( P<0.05).The results by immunohistochemisty showed that Cef prevention group and Cef therapy group inhibited and reversed the down-regulation of GLT-1 expression at CCI later period.Conclusion The Cef can prevent and treat chronic neuropathic pain by up-regulating the expression of GLT-1.
【Key words】chronic neuropathic pain; ceftriaxone sodium; GLT-1; CCI
收稿日期:( 2014-05-10)
doi:10.3969/j.issn.1002-7386.2015.04.004
【中圖分類號】R 441.1
【文獻標識碼】A
【文章編號】1002-7386( 2015) 04-0494-03

