磁性功能化納米粒子對微囊藻毒素Microcystin-LR的吸附性能研究
孫 紅,婁大偉 ,連麗麗,韓 雪,郭亭秀,3,陳慧君
(1.吉林化工學院化學與制藥工程學院,吉林吉林132022;2.吉林大學化學學院,吉林長春130012;3.東北師范大學化學學院,吉林長春130024)
隨著社會工業化進程加快,人類在工農業生產及日常生活中,向水體排入大量含氮、磷的污染物,加速了湖泊的富營養化,藻類由此而獲取豐富的營養而大量繁殖.而且藻類能釋放生物毒素——藻毒素,它是一類具有生物活性的單環七肽,具有強烈的促癌作用[1].針對被藻毒素污染的水體,已報道的方法如以活性炭[2]為吸附劑對藻毒素吸附效果十分顯著,但需要大劑量的碳不夠環保;傳統的生物降解[3]無污染適用于藻毒素的去除,但處理周期非常漫長;臭氧氧化[4]去除效果較好但價格十分昂貴.因此,開發一種經濟、環保、高效去除藻毒素的新型吸附劑對水資源的保護具有重大意義,引起社會廣泛關注.
磁性納米粒子作為一種新興的納米材料[5-6],具有超大的比表面積、較好的化學穩定性和很強的磁性,解決了傳統吸附劑固液分離困難的問題.
本文將Fe3O4磁性微球表面修飾,合成一種新型功能化Fe3O4@NiSiO3吸附劑,用于水中微囊藻毒素MC-LR的富集,對其吸附性能進行了研究.
1 實驗部分
1.1 試劑與材料
微囊藻毒素(MC-LR)購自臺灣Algal Science公司.正硅酸乙酯(TEOS)、FeCI3·6H2O、乙二醇、聚乙二醇、無水醋酸鈉以及NiSO4·7H2O均為分析純,購自天津大茂化學試劑制造有限公司.
1.2 儀器
LC-20AT高效液相色譜儀(日本Shimadzu公司),KQ-300VDV型超聲清洗器(昆山市超聲儀器有限公司),H1650離心機(湖南湘儀實驗室有限開發公司),XW-80A型旋渦混合儀(海門市其林貝爾儀器制造有限公司),H-7500型透射電子顯微鏡(日本Hitachi公司).D8 focus X-射線衍射儀(德國布魯克公司).
1.3 實驗方法
1.3.1 磁性吸附劑的制備
首先我們根據近期報道的方法制備出粒徑~250 nm的 Fe3O4磁性微球[7].然后通過水熱合成將磁性微球表面進行功能化修飾.準確稱取0.2 g Fe3O4分散于 50 mL 0.1 mol/L HCl中,超聲10 min,磁性分離出Fe3O4并用二次水充分洗滌后,再將其均勻分散于裝有120 mL無水乙醇、80 mL水的三口圓底燒瓶中,同時加入2 mL氨水(28 wt.%),連續攪拌 0.5 h 后,再將 0.5 mL TEOS逐滴加入上述溶液,繼續攪拌6 h.攪拌停止后,用磁鐵收集產物并用二次水、無水乙醇各洗3次以去除非磁性副產物.得到 Fe3O4@SiO2微球[8].
稱取0.10 g Fe3O4@SiO2分散于20 mL蒸餾水中,將 1 mmol NiSO4·7H2O、10 mmol NH4Cl加入20 mL的二次水中混合均勻,同時加入1 mL氨水(28 wt.%).將以上兩種溶液通過超聲波振動混合均勻轉移到50 mL的水熱合成釜中,在140℃下反應12 h.自然冷卻至室溫,獲得的磁性粒子用去離子水和無水乙醇反復清洗,烘干即得到Fe3O4@NiSiO3粉末[9].
1.3.2 MC-LR 的液相分析
MC-LR的去除率由吸附前后溶液的峰面積之比獲得.具體的HPLC條件為,色譜柱:Dikma Technologies,Spursil C18色譜柱(250 mm ×4.6 mm,5 μm);柱溫:30 ℃;檢測波長:238 nm;流速:1.0 mL/min;流動相為乙腈:水(含 0.1%的磷酸)=35:65(v/v);進樣量:10 μL.
1.3.3 磁性吸附劑對MC-LR的吸附性能研究
我們具體討論了吸附劑的加入量,吸附時間,MC-LR的初始濃度,溶液的pH等反應條件對磁性納米粒子實際吸附性能的影響.具體的操作步驟為:將一定質量的磁性納米粒子加入到1 mL的MC-LR溶液中,將其置于旋渦振蕩混合儀上振蕩一定時間,取200 μL的混合溶液,并通過磁鐵分離出負載MC-LR的吸附劑,取上清液100 μL注入到2 mL潔凈的試劑瓶中,通過HPLC檢測溶液中MC-LR的濃度.
2 結果與討論
2.1 表征測試結果
用透射電鏡(TEM)表征制備的納米粒子的粒度和形貌.如圖1所示,通過水熱法合成的Fe3O4@NiSiO3磁性納米粒子為規則的球形,顆粒均勻,分散性好.中間黑色球體為Fe3O4,NiSiO3的包覆層是比較松散的,粒徑基本在200~300 nm范圍內,在此范圍內的磁性納米粒子具有很高的比表面積和很強的磁性.

圖1 Fe3O4@NiSiO3磁性納米粒子的透射電鏡圖
圖2 為Fe3O4和Fe3O4@NiSiO3的XRD譜圖,從圖中可以看出Fe3O4和 Fe3O4@NiSiO3磁性納米粒子的衍射峰定義明確.水熱合成法得到的Fe3O4@NiSiO3在2θ=30.4°、35.9°、43.3°、57.3°和62.9°處出現的吸收峰和Fe3O4特征峰的位置基本一致,而在2θ=11.2°、25.3°、41.2°和 53.2°處出現新峰.該結果證明我們成功合成Fe3O4@Ni-SiO3磁性納米粒子.

圖2 Fe3O4和Fe3O4@NiSiO3XRD譜圖
2.2 吸附劑加入量對MC-LR去除率的影響
分別向1 mL 0.25 μg/mL的 MC-LR 溶液中加入 10 ~50 μg的 Fe3O4@NiSiO3,旋渦振蕩50 min后,通過磁鐵將負載了MC-LR的吸附劑分離,移取200 μL上清液注入到1 mL潔凈的試劑瓶中,標記,待測.實驗結果如圖3所示,隨著吸附劑加入量的增大,去除率呈上升趨勢,當加入吸附劑的量達到30 μg時,吸附效率達到90%以上.這說明新型磁性吸附劑Fe3O4@NiSiO3可以有效地去除水中的MC-LR.

圖3 吸附劑加入量對MC-LR去除率的影響
2.3 MC-LR初始濃度和吸附時間對吸附量的影響
配制 0.25、0.5、0.75 和 1.0 μg/mL 的 MCLR溶液1 mL于2 mL的離心管中,加入3 mg的Fe3O4@NiSiO3磁性納米粒子,將其置于旋渦振蕩混合儀上振蕩一定時間,取200 μL的混合溶液,通過磁鐵分離出負載MC-LR的磁性吸附劑,然后取上清液100 μL注入到2 mL潔凈的試劑瓶中,通過HPLC檢測,研究MC-LR的濃度和吸附時間對吸附結果的影響.實驗結果如圖4所示.

圖4 MC-LR初始濃度對吸附量的影響
從圖中可以看出Fe3O4@NiSiO3對MC-LR的吸附是一個非常快速的過程.當MC-LR的濃度為0.25 μg/mL,吸附開始的 5 min 內,90% 以上的MC-LR被迅速地吸附于Fe3O4@NiSiO3表面,然后緩慢增加,在約10 min后達到吸附平衡.圖2同時說明了濃度對吸附量及平衡時間都具有較大影響,當 MC-LR的濃度由 0.25 μg/mL增大到1.00 μg/mL時,達到吸附平衡的時間也隨之改變,約20 min左右達到吸附平衡.但正是因為濃度的提高增大了吸附作用發生的驅動力,促使MC-LR分子和Fe3O4@NiSiO3表面活性位點發生更多次的有效碰撞,影響了最終的平衡過程及Fe3O4@NiSiO3的吸附容量.當濃度增大到1.00 μg/mL 時,吸附量增大到165.12 mg/g.
2.4 溶液pH對MC-LR去除率的影響
將30 μg的Fe3O4@NiSiO3加入到1 mL濃度為0.50 μg/mL的MC-LR溶液中,探討不同酸度(2~10)下,磁性 Fe3O4@NiSiO3對 MC-LR的吸附能力.
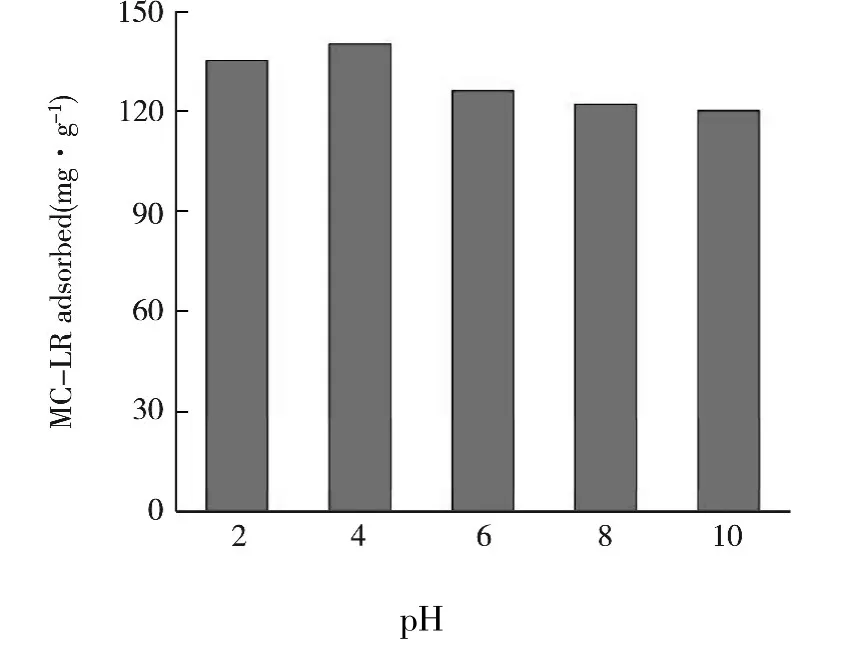
圖5 pH變化對吸附量的影響
實驗結果如圖5所示,溶液的酸度對吸附量具有一定的影響,這主要是因為pH的改變,影響了Fe3O4@NiSiO3表面和MC-LR分子的帶電情況.吸附劑對MC-LR的最大吸附量出現在pH=4時,這說明較低的pH更有利于MC-LR分子在Fe3O4@NiSiO3表面的吸附.
2.5 吸附動力學研究
為了深入了解吸附過程,我們應用準一級、
準二級反應動力學模型以及粒子內擴散模型來進行數據的擬合.
準一級反應動力學模型方程如下:

粒子內擴散模型Weber-Morris方程[10]為:

式中:qe(mg/g)與qst(mg/g)分別是平衡時與時間t(min)時單位吸附劑吸附的MC-LR的量.K1(1/min)是準一級反應速率常數,K2(g/mg/min)是準二級反應的速率常數,Kp(μg/g/min-1/2)為粒子內擴散系數.
經過3種數學模型擬合得到的相關參數均列于表1.其中,準二級反應動力學的相關性系數相對較高(R2>0.99),說明 Fe3O4@NiSiO3對 MCLR的吸附過程更符合準二級反應模型.從表中也可以觀察到,由準二級模型計算得到的qe值比通過準一級反應動力學模型擬合得出的值更接近實驗值,這也說明了吸附過程更符合準二級反應動力學模型.
根據粒子間擴散模型的假設,如果qt對t1/2作圖得到的曲線是線性的,那么吸附過程包括粒子間的擴散過程;如果該直線通過原點,那么粒子間的擴散作用是速率的控制步驟[11,12].從表1可以觀察到,粒子內擴散模型的線性相關性并不高,其r2的值介于0.1240~0.8901之間,低于準二級反應動力學的相關系數,通過粒子內擴散模型擬合得到的直線不經過原點.這說明在Fe3O4@NiSiO3與MC-LR分子相互作用的過程中,粒子內擴散作用和表面吸附作用可能共同決定著吸附速率.

表1 Fe3O4@NiSiO3吸附MC-LR的動力學模型參數
2.6 等溫吸附研究
通過Langmuir和Freundlich等溫方程式來描述在吸附過程中Fe3O4@NiSiO3和MC-LR之間的作用過程.Langmuir模型假定吸附表面為均相(所有吸附位點具有相同的吸附親合勢)[13],在吸附過程中被吸附的物質之間沒有相互作用,只以單層的排列方式聚集于吸附劑的表面.而Freundlich模型是關于非均相表面的吸附經驗關系式[14],該方程既可應用于單層吸附也可以用于多層吸附的情況,更適用于低濃度溶液中的吸附過程.
Langmuir等溫吸附模型可用下式表示:

qe(mg/g)是到達吸附平衡時Fe3O4@NiSiO3對MC-LR的吸附量,ce(mg/L)為平衡時溶液中MC-LR的濃度,qmax(mg/g)是達到單分子吸附飽和時吸附劑的最大吸附量,b(L/mg)為Langmuir常數.
Langmuir等溫吸附方程的本質特征可以通過平衡常數RL表示,RL與b及C0有關.當RL的值介于0和1之間說明吸附易于發生[15].RL可用下式表示:

Freundlich等溫吸模型可以用下式表示:

kf和n分別為與吸附能力、吸附密度相關的Freundlich等溫吸附常數.1/n的數值一般在0與1之間,1/n值越小說明Fe3O4@NiSiO3的吸附性能越好,當 1/n在 0.1~0.5,則表示吸附易于發生.
由Langmuir和Freundlich等溫吸附方程得到的相關參數均列于表2.由相關系數的數值可以看出,Langmuir等溫吸附方程比Freundlich等溫吸附方程更適合描述Fe3O4@NiSiO3和MC-LR之間的作用過程,這說明,MC-LR吸附過程發生在Fe3O4@NiSiO3表面,MC-LR分子之間不存在相互作用.RL的值介于 0.159~0.431之間說明MC-LR易于吸附于Fe3O4@NiSiO3的表面.而kf(315.26)的值說明 Fe3O4@NiSiO3和 MC-LR之間存在較強的親和性.
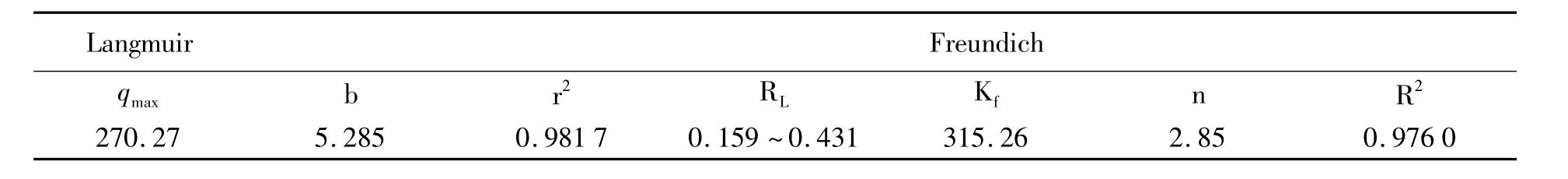
表2 Fe3O4@NiSiO3對MC-LR的等溫吸附參數
3 結 論
實驗成功制備出一種對水溶液中的藻毒素MC-LR具有特異性吸附性能的新型磁性Fe3O4@NiSiO3吸附材料.結果表明,磁性Fe3O4@NiSiO3納米粒子具有吸附量大、吸附速率快、達到平衡時間短的特點,同時探討了磁性納米粒子對MC-LR的吸附動力學和熱力學特征.可用準二級反應模型描述對MC-LR的吸附動力學過程,所得平衡吸附量理論值與實驗值更為接近.磁性Fe3O4@Ni-SiO3對MC-LR的吸附更符合Langmuir模型.價格低廉、簡單快速分離的磁性納米粒子有望在水處理領域中有更大的潛在應用前景.
[1] Liu L.L.,Zhong R.G.,Zeng Y.,et al.[J].Hygiene Research,2006,35(3):377.
[2] Wang H.,Ho L.,Lewis D.M.,Brookes J.D.,Discriminating and assessing adsorption and biodegradation removal mechanisms during granular activated carbonfiltration of microcystin toxins[J].Water Research,2007,41:4262-4270.
[3] Bourne D.G.,Blakeley R.L.,Riddles P.,Jones G.J.,Biodegradation of the cyanobac-terial toxin microcystin LR in natural water and biologically active slow sandfilters[J].Water Research,2006,40:1294-1302.
[4] Miao H.F.,Qin F.,Tao G.J.,Tao W.Y.,Detoxification and degradation of microcystin-LR and-RR by ozonation [J].Chemosphere,2010,79:355-361.
[5] Lian L.L.,Cao X.L.,Wu Y.Q.,Sun D.Z.,Lou D.W.,A green synthesis of magnetic bentonite material and its applicationfor removal of microcystin-LR in water[J].Applied Surface Science,2014,289:245-249.
[6] Yu J.X.,Wang L.Y.,Chi R.A.,Competitive adsorption of pb2+and Cd2+on magnetic modified sugarcane bagasse prepared by two simple steps[J].Applied Surface Science,2013,268:163-170.
[7] Lian L.L.,Cao X.L.,Wu Y.Q.,Lou D.W.,Han D.D.,Synthesis of organo-functionalized magnetic microspheres and application for anionic dye removal[J].Journal of the Taiwan Institute of Chemical Engineers,2013:4467-4473.
[8] Oliveira L.C.A.,Petkowicz D.I.,Smaniotto A.,et al.Magnetic zeolites:a new adsorbent for removal of metallic contaminants from water[J].Water Research,2004,38:3699-3704.
[9] Liu X.W.,Hu Q.Y.,Fang Z.,et al.Magnetic chitosan nanocomposites:a useful recyclable tool for heavy metal ion removal[J].Langmuir,2009,25:3-8.
[10] Shi Y.,Kong X.Z.,Zhang C.M.,Chen Y.M.,Hua Y.F..[J].Chem.Eng.,2013,113:215-216.
[11] Kannan N.,Sundaram M.M.Kinetics and mechanism of removal of methylene blue by adsorption on various carbons-a comparative study [J].Dyes Pigments,2001,51:25-40.
[12] Chen J.P.,Wu S.,Chong K.H..Surface modification of a granular activated carbonby citric acid for enhancement of copper adsorption [J].Carbon,2003,41:1979-1986.
[13] Zhang P.K.,Li W..[J].Sep.Purif.Technol.,2010,70:367.
[14] Gautham P.J.,Clement T.P..[J].Contam.Hydrol.,2012,46:129-130.
[15] Mouzdahir Y.E.,Elmchaouri A.,Mahboub R.,et al.Adsorption of methylene blue fromaqueous solutions on a moroccan clay [J].J.Chem.Eng.Data,2007,52:1621-1625.

