我院抗腫瘤藥致不良反應報告分析
楊國韜
惡性腫瘤已成為我國城鄉居民發病和死亡的主要病因,且呈持續增長趨勢。2010年全國癌癥新發病例約為309.30萬例,發病率為235.23/10萬;死亡病例約為195.66萬例,病死率為148.81/10萬[1]。我院作為湖北省特色腫瘤專科醫院,抗腫瘤藥物應用廣泛,其引起的藥品不良反應(ADR)近年來均占總報告數首位。本文對我院2010至2013年報告的113例抗腫瘤藥致 ADR病例進行回顧性分析,總結抗腫瘤藥致ADR發生的特點及規律,為改進我院抗腫瘤藥物監測工作及臨床合理使用提供參考和依據。
1 資料與方法
1.1 一般資料 收集本院2010至2013年填寫的113例抗腫瘤藥致ADR報告。
1.2 方法 整理資料后將患者年齡、性別、原患疾病與過敏史、聯合用藥及給藥途徑、涉及藥品種類、累及器官或系統及臨床表現、關聯性評價及轉歸等信息錄入Excel軟件進行統計與分析。
2 結果
2.1 ADR患者一般情況 113例抗腫瘤藥致ADR報告中,男31例(27.43%),女82例(72.57%);年齡36~71歲,平均年齡55歲。原患疾病中乳腺癌45例,肺癌18例,宮頸卵巢癌16例,直腸結腸癌9例,鼻咽癌7例,胃癌6例,淋巴瘤5例,食管癌3例,胰腺癌、扁桃體癌各2例。既往有藥物過敏史者11例(9.73%),無過敏史者73例(64.60%),過敏史不詳者29例(25.67%)。見表1。
2.2 聯合用藥及給藥途徑 113例ADR報告中單獨用藥103例(91.15%),聯合用藥10例(8.85%),包括多西紫杉醇聯合順鉑4例,多西紫杉醇聯合吡柔比星2例,多西紫杉醇聯合奧沙利鉑、氟尿嘧啶聯合亞葉酸鈣、伊立替康聯合奈達鉑、長春新堿聯合順鉑各1例。給藥途徑中靜脈給藥98例(86.73%),口服給藥9例(7.96%),其他給藥途徑(胸腔腹腔給藥、皮下注射、肌內注射)6例(5.31%)。
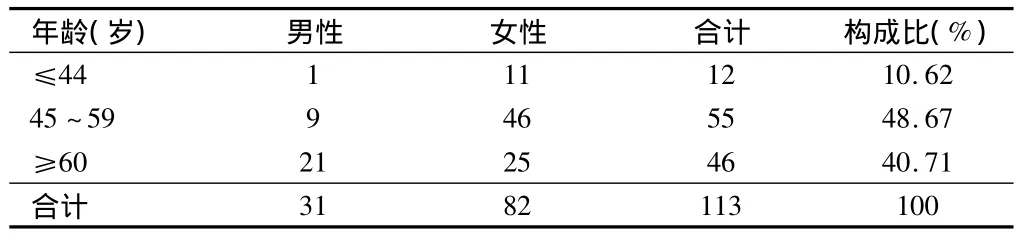
表1 ADR患者年齡與性別分布 例
2.3 ADR涉及藥品種類分布 113例ADR報告共涉及抗腫瘤藥6類19個品種,其中植物來源的抗腫瘤藥及其衍生物引發的ADR位居首位。見表2。
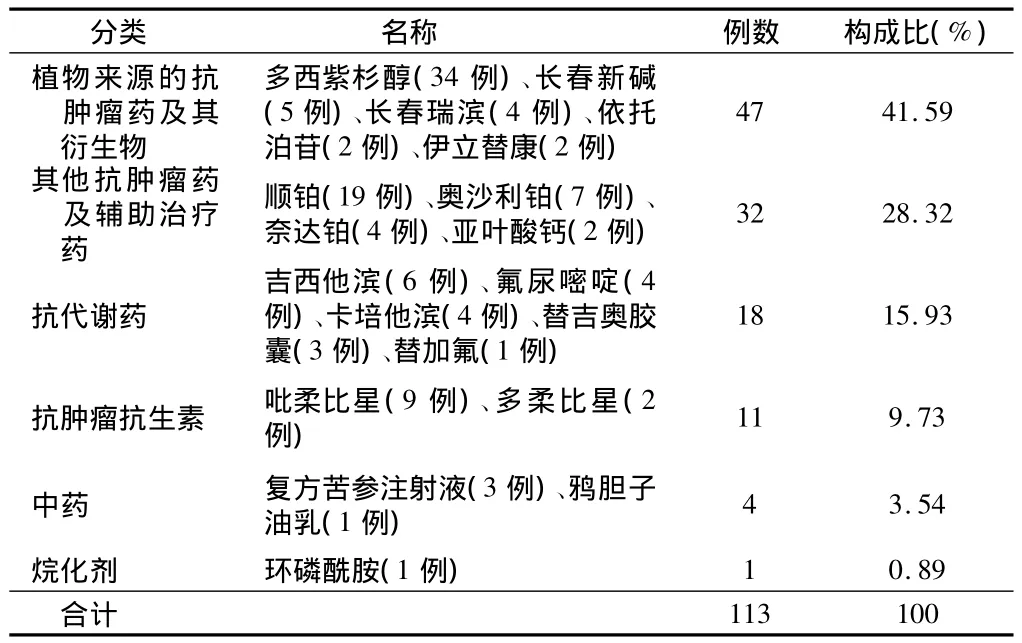
表2 引發ADR的抗腫瘤藥物分布
2.4 ADR累及器官或系統分布及主要臨床表現 根據國家藥品不良反應監測中心編寫的《WHO藥品不良反應術語集》進行分類統計,抗腫瘤藥致ADR累及的系統或器官及主要臨床表現(因部分ADR患者同時累及多個器官或系統,故實際發生例次>113例)。見表3。
2.5 ADR關聯性評價及轉歸 根據國家藥品不良反應監測中心發布的ADR關聯性評價標準,113例ADR報告中評價為“肯定”27例(23.89%),“很可能”73例(64.60%),“可能”10例(8.85%),“待評價”3例(2.66%)。經過停藥或對癥治療等處理后,68例ADR患者痊愈(60.18%),43例好轉(38.05%),未好轉2例(1.77%),無后遺癥及死亡病例。
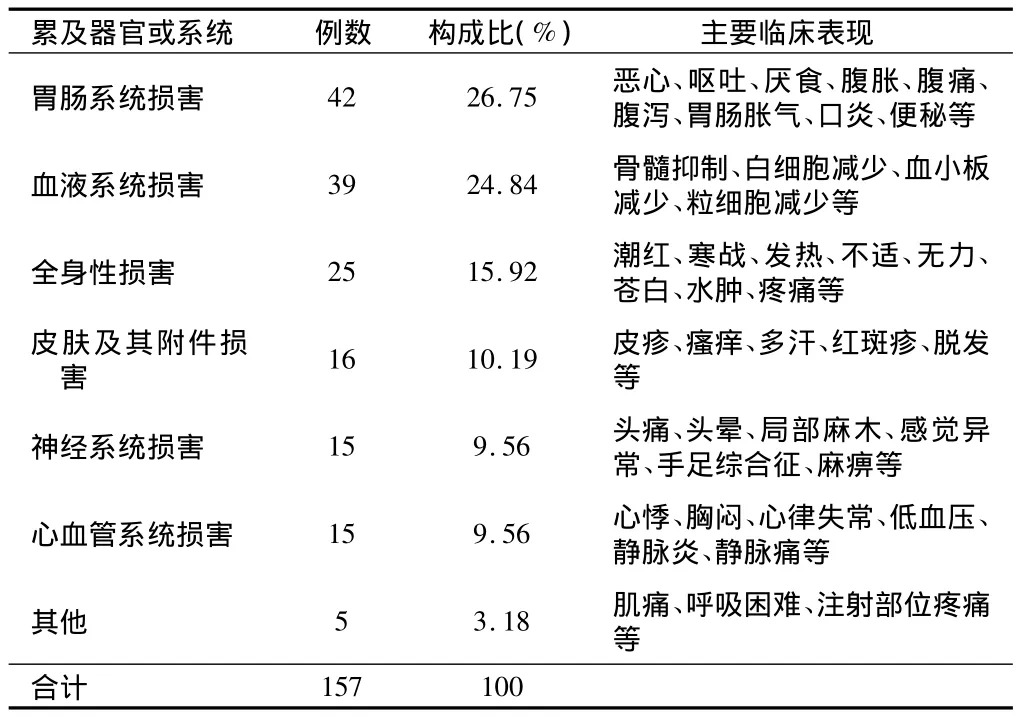
表3 ADR累及器官或系統及主要臨床表現
3 討論
本院2010至2013年填寫的113例ADR報告中,男女比例為1∶2.65,女性明顯高于男性,可能與我院就診人群特點及婦科惡性腫瘤比例較高有關。由表1可知,ADR患者人群中45~59歲的中年患者所占比例最大,達到48.67%;其次為60歲以上的老年患者,占40.71%。中老年人群是惡性腫瘤的高發人群,也是我院發生ADR的高風險人群,由于許多器官的儲備功能明顯下降,對處置藥物的能力和對藥物反應上與青年人有明顯差異,加之合并用藥種類增多以及對醫生處方的依從性差,因而ADR的發生率高[2]。
引發 ADR的給藥途徑主要為靜脈給藥(86.73%),抗腫瘤藥由于其生物利用度等原因,注射劑型的品種多于口服劑型,因而臨床上腫瘤化療較多采取靜脈給藥方式;注射劑的pH值、微粒、內毒素、賦形劑以及藥物的配制、輸注過程等也較其他給藥途徑更易引起ADR[3]。建議臨床醫師和臨床藥師應詳細掌握藥物的理化性質及藥動學特點,考慮藥物禁忌證及相互作用,根據病情采用適當的藥物劑型和給藥途徑,安全、合理的使用抗腫瘤藥。
從涉及藥品分布看,我院引發ADR的藥品種類主要為植物來源的抗腫瘤藥及其衍生物和鉑類藥物,與其他文獻報道[4]一致。臨床表現主要為胃腸系統損害(26.75%)及血液系統損害(24.84%),這主要是胃腸黏膜,骨髓等增殖活躍細胞對抗腫瘤藥物的作用,尤其是細胞毒藥物較為敏感的緣故[5],同時也與上述兩類藥物的大量使用有關。特別是植物來源的抗腫瘤藥及其衍生物近年來發展迅速,用藥份額一直位于各類抗腫瘤藥之首。這類藥物主要作用于有絲分裂M期,干擾腫瘤細胞微蛋白合成,在抗腫瘤藥物中有不可替代的地位,但其所含有效成分復雜、質量標準低、可控性差,不溶性微粒易導致靜脈炎及過敏反應[4]。
目前我院用量較大的植物來源抗腫瘤藥主要為多西紫杉醇,113例ADR報告中多西紫杉醇占34例(包括骨髓抑制18例,胃腸系統損害8例,過敏樣反應3例,發熱2例,靜脈炎1例,脫發1例,低血壓1例),其所致的骨髓抑制為劑量限制性毒性,隨著劑量和療程的增加,其血液學毒性加重,但可逆轉不蓄積[6],主要表現為中性粒細胞減少,最快發生在用藥1 d后,最遲發現于第88天,多數患者發生時間集中在用藥后3~8 d,中位數為6 d。由于紫杉烷類藥物在水中的溶解性能極差,注射劑中助溶劑含有聚氧乙烯蓖麻油(Cremophor EL)、聚山梨醇酯80(吐溫-80,Tween-80)和無水乙醇混合液可引起多種毒性反應[7],因此目前國內外臨床制劑研究的熱點是致力于開發多西紫杉醇的新劑型,避免使用聚山梨酯80,增加藥物溶解度,降低毒副作用。現已報道的新劑型包括脂質體、白蛋白納米粒、微乳和乳劑、聚合膠束、環糊精包合物等,但想實現大規模臨床應用還有待進一步深入研究。
根據我院就診患者的人群及用藥特點,應針對抗腫瘤藥物完善監測管理制度,臨床醫藥人員要高度重視抗腫瘤藥的潛在危險,充分了解可能出現的不良反應,根據患者年齡、病情、過敏史、藥物特性及配伍禁忌等因素制定個性化給藥方案,對紫杉烷類藥物用藥前必須實施常規預處理,給藥初期應控制滴注速度,嚴密監測可能發生的過敏反應,化療結束后應隨時關注患者血液學指標及肝腎功能變化,同時做好針對性的防治措施,一旦發現異常情況要及時處理,最大程度規避和降低不良反應造成的損害。
1 陳萬青,張思維,曾紅梅,等.中國2010年惡性腫瘤發病與死亡.中國腫瘤,2014,23:1.
2 安澤余,殷玉會,顧吉順.我院290例藥品不良反應報告分析.河北醫藥,2012,34:1252-1253.
3 錢錦,張樹,吳俊華,等.422例抗腫瘤藥物不良反應分析.南京醫科大學學報,2013,33:915.
4 李蓉,董志,路曉欽,等.重慶市818例抗腫瘤藥不良反應報告分析.中國藥房,2013,24:3225.
5 劉加濤,金亮,汪燕燕,等.我院抗腫瘤及輔助治療藥物不良反應164例分析.中國藥物警戒,2012,9:184.
6 朱婉貞.53例多西紫杉醇注射液不良反應報道文獻分析.中國臨床藥學雜志,2010,19:381.
7 劉韜,林子超,潘瑩,等.31例紫杉烷類注射劑過敏反應臨床觀察.中國醫院用藥評價與分析,2009,9:777.

