microRNA-146a在LPS誘導的大鼠雪旺細胞損傷模型中的表達
周秀梅 陳龍 邵一葉 陳英輝 施曉紅
(復旦大學附屬金山醫院神經內科,*內分泌科,上海 201508)
?
·論著·
microRNA-146a在LPS誘導的大鼠雪旺細胞損傷模型中的表達
周秀梅陳龍邵一葉陳英輝施曉紅*
(復旦大學附屬金山醫院神經內科,*內分泌科,上海201508)
摘要目的:探討microRNA-146a(miRNA-146a)在體外培養的大鼠雪旺細胞炎性反應模型中的表達變化。方法: 采用脂多糖(lipopolysaccharide,LPS)建立大鼠雪旺細胞炎性反應模型(LPS組),加入LPS 6 h后給予環氧合酶-2(COX-2)抑制劑NS398處理,正常組僅在LPS組加入LPS時更換培養基。采用real-time PCR及CCK-8方法檢測miRNA-146a的表達水平及雪旺細胞的增殖能力。結果:與正常組相比,LPS組miRNA-146a的表達明顯升高(P<0.05),而且miRNA-146a的表達隨LPS濃度升高而增加;經1.0 μg/mL的 LPS處理6 h后給予NS398處理,miRNA-146a表達水平下降(P<0.05)。經10 μg/mL的 LPS處理6 h后,雪旺細胞的增殖能力下降;而LPS處理6 h后加入NS398,雪旺細胞的增殖能力改善。結論:miRNA-146a參與了體外培養的大鼠雪旺細胞炎性反應的調控,其表達水平在一定程度上可反應炎性反應的嚴重程度。
關鍵詞雪旺細胞;miRNA-146a;炎性反應
糖尿病周圍神經病變(diabetic peripheral neuropathy, DPN)是糖尿病患者常見的慢性并發癥。60%~90%的2型糖尿病患者合并周圍神經病變,出現不同程度的感覺和(或)運動神經系統功能障礙,嚴重時甚至可致殘,嚴重影響患者的生活質量[1]。目前DPN的發生機制尚未明確,可能是機體內多種病理生理因素綜合作用的結果[2]。近期研究[3-4]表明,DPN與炎性反應密切相關。作為非編碼短鏈RNA,miRNA-146a參與了免疫反應及炎性反應的調節[5-6],但其在DPN中的作用尚不明確。本研究在脂多糖(lipopolysaccharide, LPS)誘導的大鼠雪旺細胞炎性反應模型中,采用實時熒光定量PCR(real-time PCR)檢測了miRNA-146a的表達水平,并采用CCK-8技術檢測了雪旺細胞的增殖能力,以初步了解miRNA-146a在DPN炎性反應中的作用。
1資料與方法
1.1細胞培養RSC96大鼠雪旺細胞(購于中科院上海細胞庫)的培養采用DMEM+10%FBS培養基。隔天換一次培養液,當細胞融合度達到95%時,用含0.25% 胰酶的消化液進行消化傳代。將雪旺細胞按2×106個/孔接種于六孔板,培養24 h后,將細胞分為正常組、LPS組、NS398組。LPS組更換培養基后分別加入終濃度為0.1、1.0和10 μg/mL 的LPS處理細胞,同時予正常組更換等體積培養基;NS398組在加入1.0 μg/mL的LPS刺激6 h后加入COX-2抑制劑NS398至終濃度為 10 μmol/L(上海碧云天生物技術有限公司),繼續培養24 h后收集細胞。
1.2實時熒光定量PCR(real-time PCR)應用trizol提取RNA,用紫外分光光度計測OD值,將λ1/λ3 為1.8~2.0、λ1/λ2 為1.8~2.0的樣本采用RR718試劑盒(日本Takara公司) 進行反轉錄及PCR。miRNA-146a上游引物由日本Takara公司合成,序列為5’- CATGAGAACTGAATTCCATGGGTT -3’,下游通用引物及內參RNU6B引物包含在RR718試劑盒中。采用real-time PCR(ABI7300)擴增目的基因,測得相應Ct值。用相對定量分析2-ΔΔCt法計算miRNA-146a的表達水平。
1.3細胞增殖能力測定將細胞懸液加入96孔板(每孔1×104個細胞),置于培養箱內培養24 h后,將細胞分為正常組、LPS組、NS398組,予正常組更換新培養基,另外兩組更換LPS濃度為10 μg/mL的培養基,培養6 h后予NS398組加入NS398 至終濃度10 μmol/L,繼續培養24 h,每孔加入CCK-8試劑10 μL并繼續培養2 h后用酶標儀檢測細胞增殖能力。
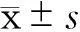
2結果
2.1不同濃度LPS對大鼠雪旺細胞中miRNA-146a表達的影響采用real-time PCR 檢測不同濃度LPS組和正常組miRNA-146a的表達,結果表明,與正常組相比,LPS濃度為0.1、1.0、10 μg/mL 時,大鼠雪旺細胞中miRNA-146a的表達水平均升高(分別為1.67±0.21、2.43±0.28、3.56±0.33),并隨LPS濃度的升高而增加。LPS組與正常組差異有統計學意義(P<0.05)。見圖1。
注:與正常組比較,*P<0.05
圖1miRNA-146a在不同濃度LPS組和正常組的表達
2.2NS398對雪旺細胞增殖能力及miRNA-146a表達的影響經10 μg/mL的LPS 處理6 h后,雪旺細胞的增殖被抑制;而LPS處理6 h后加入COX-2抑制劑NS398,雪旺細胞的增殖能力改善(圖2A),提示NS398可以有效抑制LPS誘導的炎性反應。采用real-time PCR方法分析miRNA-146a表達,發現1.0 μg/mL的 LPS刺激雪旺細胞24 h后,miRNA-146a表達水平(2.15±0.25)較正常組升高(P<0.05);在LPS刺激6h后給予NS398(10 μg/mL)24 h后,miRNA-146a表達水平(0.89±0.09)明顯下降(P<0.05),見圖2B。結果表明,NS398可以抑制miRNA-146a的表達。
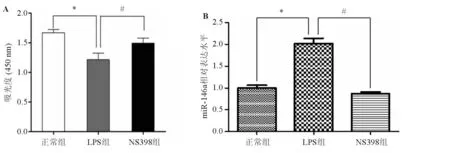
注:*與正常組比較,P<0.05;#與LPS組比較,P<0.05
3討論
研究[7]認為,miRNAs調節著人類約1/3的基因,因此參與了機體的諸多生理、病理過程。miRNA-146a是近年來的研究熱點,大量研究[5-6,8-9]證實miRNA-146a參與免疫及炎性反應。人類的miRNA-146a位于第5號染色體LOC285628基因上,成熟的miRNA-146a位于第二外顯子上[5]。研究[10]發現,miRNA-146a在健康人的20個組織器官中均有表達,尤其在淋巴細胞含量豐富的胸腺和脾臟中高度表達,免疫細胞的成熟及激活均可誘導其表達。miRNA-146a的表達受系統特異性轉錄因子PU.1和c-ETS以及核轉錄因子-κB(nuclear factor Kappa B,NF-κB)、活化因子蛋白1(activator protein 1,AP1)、鋅指轉錄因子Snail等的調節[11]。研究[5]表明,多種微生物成分、促炎性細胞因子,如LPS、 腫瘤壞死因子-α(tumor necrosis factor α,TNF-α)、干擾素-α(interferonα,IFN-α)等均可誘導miRNA-146a的表達;miRNA-146a表達與轉錄因子NF-κB密切相關。NF-κB是重要的炎性反應調節分子,調節TNF-α、白介素-1β(interleukin1β,IL-1β)、IL-6、 IL-8的合成以及COX-2的表達,促進Th1 細胞釋放IL-2、IL-12和IFN-γ,繼而激活巨噬細胞[12]。
雪旺細胞為周圍神經系統的膠質細胞,除了參與髓鞘形成之外,還有營養支持、促進軸索再生等作用。雪旺細胞是一種類抗原提呈細胞,可被誘導產生主要組織相容性復合體II(major histocomatibility complex II,MHCII)及黏附分子。DPN主要的病理表現是髓鞘神經纖維節段性或彌漫性皺縮及脫髓鞘。因此,本研究采用體外培養的大鼠雪旺細胞,觀察miRNA-146a在炎性反應損傷的雪旺細胞中的表達變化,發現隨著LPS濃度的升高,大鼠雪旺細胞中miRNA-146a的表達增加。有研究[13]報道,系統性紅斑狼瘡的嚴重程度與miRNA-146a表達呈正相關。膿毒血癥患者中亦有相似的報道[14]。這些結果提示,miRNA-146a表達水平或許可在一定程度上反應體內炎性反應狀態。同時,我們發現,COX-2抑制劑NS398能抑制LPS誘導的雪旺細胞增殖能力的下降,且能下調miRNA-146a的表達,而COX-2在炎性反應中扮演重要角色,因此,我們推測NS398可能通過調節miRNA-146a的表達參與炎性反應的調節,但具體機制有待進一步研究。
由于我們的研究結果是由體外培養的細胞實驗獲得,故需要在動物體內及DPN患者中進一步研究。明確miRNA-146a在雪旺細胞炎性反應中的作用及其與包括COX-2在內的炎性因子的關系,將有助于明確DPN的發病機制。
參考文獻
[1]Tesfaye S. Advances in the management of diabetic peripheral neuropathy [J]. Current Opinion in Supportive & Palliative Care, 2009, 3 (2): 136-143.
[2]Harati Y. Diabetic neuropathies: unanswered questions [J]. Neurol Clin, 2007, 25(1):303-317.
[3]Gundogdu BM. Diabetic peripheral neuropathy: An update on pathogenesis and management [J]. Current neurology and neuroscience reports, 2006, 6(1): 1-4.
[4]Anjaneyulu M, Berent-Spillson A, Inoue T, et al. Transforming growth factor-β induces cellular injury in experimental diabetic neuropathy [J]. Exp Neurol, 2008, 211(2): 469-479.
[5]Taganov KD, Boldin MP, Chang KJ, et al. NF-kappaB-dependent induction of microRNA miR-146, an inhibitor targeted to signaling proteins of innate immune responses[J]. Proc Natl Acad Sci U S A, 2006, 103(33): 12481-12486.
[6]Hou J, Wang P, Lin L, et al. MiRNA-146a feedback inhibits RIG-I-dependent Type I IFN production in macrophages by targeting TRAF6, IRAK1, and IRAK2[J]. J Immunol, 2009, 183(3): 2150-2158.
[7]Hobert O. Gene regulation by transcription factors and microRNAs[J]. Science, 2008, 319(5871):1785-1786.
[8]Perry MM, Moschos SA, Williams AE, et al. Rapid changes in miRNA-146a expression negatively regulate the IL-1beta-induced inflammatory response in human lung alveolar epithelial cells[J]. J Immunol, 2008, 180(8): 5689-5698.
[9]Tang Y, Luo X, Cui H, et al. MiRNA-146a contributes to abnormal activation of the type I interferon pathway in human lupus by targeting the key signaling proteins[J]. Arthritis Rheum, 2009, 60(4): 1065-1075.
[10]Sonkoly E, Wei T, Janson PC, et al. MicroRNAs: novel regulators involved in the pathogenesis of psoriasis[J]. PLoS One, 2007,2(7):e610.
[11]Hwang W, Jiang J, Yang S, et al. MicroRNA-146a directs the symmetric division of Snail-dominant colorectal cancer stem cells[J]. Nat Cell Biol, 2014,16(3):268-280.
[12]Tak PP, Firestein GS. NF-kappaB: a key role in inflammatory diseases[J].J Clin Invest,2001,107(1):7-11.
[13]Luo X, Yang W, Ye D, et al. A functional variant in microRNA-146a promoter modulates its expression and confers disease risk for systemic lupus erythematosus[J]. PLoS Genet, 2011,7(6):e1002128.
[14]Shao Y, Li J, Cai Y, et al. The functional polymorphisms of miR-146a are associated with susceptibility to severe sepsis in the Chinese population[J]. Mediators Inflamm, 2014:916202.
Expression of MicroRNA-146a in LPS-Induced Injured Models of Rat Schwann Cells
ZHOUXiumeiCHENLongSHAOYiyeCHENYinghuiSHIXiaohong*DepartmentofNeurology,*DepartmentofEndocrinology,JinshanHospital,FudanUniversity,Shanghai201508,China
AbstractObjective:To investigate the expression of miRNA-146a in the inflammatory response model of rat Schwann cells (SCs) cultured in vitro. Methods:Lipopolysaccharide(LPS) was applied to induce inflammatory response model of rat SCs. The cyclooxygenase-2(COX-2) inhibitor (NS398) was added six hours after LPS had been used. In normal group, the same amount of culture medium was replaced while the LPS was applied in LPS group. The expression of miRNA-146a and the proliferative capacity of SCs were detected by real-time PCR and CCK-8 method. Results: Compared with that in the normal group, the expression levels of miRNA-146a in all LPS groups increased significantly(P<0.05), and the expression level of miRNA-146a was up-regulated in accordance with the increase of the concentration of LPS. If NS398 was added six hours after the application of 1.0 μg/mL LPS, The expression of miRNA-146a was down-regulated. Six hours after the application of 10 μg/mL LPS, the proliferative capacity of SCs declined. However, if NS398 was added six hours after the application of LPS, then the proliferative capacity of SCs improved. Conclusions: The miRNA-146a is involved in the regulation of inflammatory response in Schwann cells cultured in vitro, and its expression level may reflect the severity of inflammatory response to a certain extent.
Key WordsSchwann cells;MicroRNA-146a;Inflammatory response
通訊作者施曉紅,E-mail: shixh80301@163.com
基金項目:上海市金山區科委科技創新項目(編號:2014-3-05)
中圖分類號R587.2
文獻標識碼A

