Ddx1基因在不同發育階段小鼠睪丸組織中的表達
李 莉,張 雷,龔 淼,趙秀軍,趙 昱(河北醫科大學基礎醫學院組織胚胎學教研室,河北 石家莊 050017)
?
·論著·
Ddx1基因在不同發育階段小鼠睪丸組織中的表達
李莉,張雷,龔淼,趙秀軍,趙昱*(河北醫科大學基礎醫學院組織胚胎學教研室,河北 石家莊 050017)
[摘要]目的系統觀察不同日齡小鼠睪丸組織的發育特點,檢測ddx1基因與蛋白在不同發育階段小鼠睪丸組織中的表達模式,探討ddx1基因在精子發生過程中的作用。方法采用石蠟切片HE染色的方法觀察不同發育階段小鼠睪丸組織的結構特征;采用實時熒光定量PCR法檢測ddx1 mRNA在不同日齡小鼠睪丸組織中的表達;采用免疫印跡和免疫組織化學法檢測DDX1蛋白在不同日齡小鼠睪丸組織中的表達特性與細胞內的定位。結果石蠟切片HE染色顯示5、15、23、35、42和60日齡小鼠睪丸組織結構特點能代表生精上皮組織發生發育階段;實時熒光定量PCR法顯示ddx1 mRNA在各日齡小鼠睪丸組織中均有表達,于15日齡開始增高,隨后維持穩定水平;免疫印跡法顯示DDX1蛋白在35、42、60日齡小鼠睪丸組織中特異性表達并逐漸增高;免疫組織化學法顯示在少量精原細胞、大量精母細胞和圓形精子細胞胞質與細胞核中存在DDX1蛋白陽性表達。 結論Ddx1基因和蛋白在小鼠精子發生過程中呈現階段與細胞特異性表達, 提示ddx1基因可能在精子發生過程中發揮作用。
[關鍵詞]精子發生;ddx1基因;睪丸;精母細胞;小鼠
doi:10.3969/j.issn.1007-3205.2015.12.001
精子發生是生精細胞特殊分化的復雜過程,各級生精細胞具有特異的基因表達與調控方式,此過程不僅需要多種基因正確表達,也需要多種RNA正確執行功能[1]。DEAD box家族蛋白是一個三磷酸腺苷(adenosine tripho-sphate,ATP)依賴的RNA解旋酶家族,參與RNA各種功能的執行[2]。研究顯示該家族成員DDX3、DDX4、DDX25等與精子生成和男性不育有密切關系[3-6]。本實驗前期研究發現正常成年男性睪丸內有ddx1基因與蛋白的表達。而有些進行睪丸穿刺的非梗阻性無精子癥(non-obstructive azoospermia,NOA)患者的睪丸組織中沒有ddx1基因與蛋白的特異表達。目前國內外尚未見到關于ddx1基因在人和小鼠睪丸組織中動態表達情況的報道。本研究連續觀察了小鼠出生后2個月內多個時點的睪丸組織形態特征,確定小鼠精子發生過程與小鼠出生后日齡的具體對應關系,選取與首個精子發生波的時間點完全一致的5、15、23、35、42、60日齡小鼠,觀察ddx1 基因與蛋白在小鼠精子發生過程中的表達情況,探討ddx1基因在小鼠精子發生過程中可能發揮的功能,旨在為闡明生精障礙的病因和探索男性不育的靶向治療提供理論與實驗基礎。
1材料與方法
1.1實驗動物與主要試劑清潔級C57BL/6j雄性小鼠,購自北京華阜康生物科技股份有限公司。取出生后 1、3、5、7、9、11、13、15、18、23、27、30、33、35、39、42、45、48、51、54、58、60日齡小鼠,每組7只。兔抗鼠DDX1多克隆抗體(sc-134752,美國Santa Cruz公司);兔抗鼠β-actin多克隆抗體(sc-7210,美國Santa Cruz公司);二步法通用型免疫組織化學試劑盒(上海基因科技有限公司);ECL化學發光試劑盒(美國Abcam公司);PrimeScript?Ⅱ High Fidelity RT-PCR Kit(DR023A,寶生物公司);SYBR?Premix DimerEraser?試劑盒(DRR091A,寶生物公司)。
1.2石蠟切片制備用頸椎脫臼法將不同日齡小鼠處死,冰上快速取出睪丸放入4% 多聚甲醛固定4 h,取出切開睪丸組織后繼續固定12~36 h。常規石蠟包埋,4 μm連續切片,60 ℃烤箱3 h,裝盒備用。
1.3HE染色切片常規脫蠟、梯度酒精水合,蘇木精染液染色3~10 min,自來水沖洗3 min,1% 鹽酸酒精分化2 s,自來水沖洗3 min,5%氨水返藍30 s,伊紅染色3 min ,梯度酒精逐級脫水,二甲苯透明,中性樹膠封片,Leica光學顯微鏡下觀察并攝片。
1.4實時熒光定量PCR(Quantitative Real-Time PCR)法檢測ddx1 mRNA的水平取液氮凍存的生后5、15、23、35、42、60日齡小鼠睪丸組織每份20 mg,應用TRIzol 法提取 RNA,選取凝膠電泳驗證提取質量良好的RNA應用PrimeScript?Ⅱ High Fidelity RT-PCR試劑盒進行反轉錄,所得cDNA作為模板,參照SYBR?Premix DimerEraser?試劑盒說明書,將反應體系放置于 ABI-7300 Real-Time PCR儀中進行擴增反應。反應結束后確認擴增曲線和熔解曲線,證實無非特異性擴增,ddx1的相對表達量計算采用ΔΔCT法,以Gapdh (管家基因)、ddx25(已證實在小鼠睪丸不同發育階段均有表達的基因)、Stra8(顯示減數分裂起始的標志基因)、Prm1(顯示長形精子細胞形成的特異性基因)作為對照,引物序列見表 1。

表1 實時熒光定量PCR所用引物序列
1.5免疫印跡(Western blotting)法檢測DDX1蛋白在睪丸組織中的表達取液氮凍存的不同日齡小鼠睪丸組織,提取總蛋白并測定濃度,各組蛋白上樣量為40 μg,SDS-PAGE膠分離,轉膜,5%牛血清蛋白(bovine serum albumin,BSA)室溫搖床封閉 2 h,去除封閉液,分別加入3%BSA稀釋的兔抗鼠DDX1多克隆抗體(工作濃度為1∶100),兔抗鼠β-actin多克隆抗體(工作濃度為1∶1 000),4 ℃過夜,次日,室溫平衡1h,加入用TBST稀釋的辣根酶過氧化物標記的羊抗小鼠IgG(1∶200),室溫垂直搖床孵育2 h,常規化學發光顯色,在Gene-box成像系統中顯影。
1.6免疫組織化學檢測DDX1蛋白在睪丸組織中的表達與定位切片經脫蠟、水化后用10 mmol/L枸櫞酸鈉緩沖液微波加熱至沸騰10 min進行抗原修復,用3% H2O2室溫孵育 10 min 封閉內源性過氧化物酶的活性,滴加兔抗鼠DDX1多克隆抗體工作液(工作濃度為1∶50)避光孵育,4 ℃過夜,次日取出平衡至室溫,滴加二抗復合物室溫孵育 45 min,0.05%二氨基聯苯胺(diaminoben zidine,DAB)溶液顯色5~10 min,部分切片進行蘇木精復染 3 min。陰性對照用 磷酸鹽緩沖液替代一抗。常規脫水、透明、封片,顯微鏡下觀察并攝片。
2結果
2.1不同日齡小鼠睪丸組織的形態結構5日齡小鼠睪丸生精小管的上皮內細胞層數2~3層,由大量支持細胞和少量精原細胞組成;睪丸間質細胞(Leydig 細胞)數量較少(圖1A)。15日齡小鼠睪丸生精小管之間的間隙變小,部分小管可見管腔;生精上皮細胞層數為3~5層,初見前細線期精母細胞,體積較大,染色質松散;精原細胞位于基膜內側,核染色質致密深染,可見有絲分裂相;Leydig細胞數量增多(圖1B)。23日齡小鼠睪丸內生精上皮增厚,細胞層數明顯增多,初見圓形精子細胞;精原細胞緊貼基膜,相對數量減少,核深染;初級精母細胞數量明顯增多,粗線期精母細胞所占比例增大,細胞體積大,胞質嗜酸性,胞核呈絨球狀;近管腔側上皮內開始出現圓形精子細胞,體積較小,胞核呈均質狀;偶見間質細胞成團分布,體積增大(圖1C)。35日齡小鼠睪丸生精小管上皮明顯增厚,可見精原細胞、精母細胞、圓形精子細胞和長形精子細胞,其中圓形精子細胞所占比例較大,可見較多處在形態改變過程中的精子細胞和處于各期的精母細胞;相鄰生精小管之間可見成群分布的Leydig細胞,胞質嗜酸性強(圖1D)。42日齡小鼠睪丸生精小管排列緊密,管腔明顯;生精上皮內可見各種類型的生精細胞,其中長形精子細胞數量明顯增多,偶見發育成熟的精子(圖1E)。60日齡小鼠睪丸生精小管排列更緊密,間隙變小,管腔中精子增多;Leydig 細胞成群分布,細胞輪廓清晰,胞質嗜酸性增強(圖1F)。

圖1不同日齡C57BL/6j小鼠睪丸組織光鏡結構(HE ×400)
A.5日齡;B.15日齡;C.23日齡;D.35日齡;E.42日齡;F.60日齡
Figure 1Morphological structure of normal C57BL/6j mouse spermatogenesis at different postnatal stages of the developing testis(HE ×400)
2.2Ddx1 mRNA在不同日齡小鼠睪丸組織中的表達Ddx1 mRNA在5日齡小鼠睪丸組織內已有微量表達,在15日齡即生精細胞開始進入減數分裂時期的小鼠睪丸組織中轉錄水平略有升高,隨后逐漸升高,直到60日齡維持穩定水平;ddx25 mRNA 自生后即有持續表達;Stra8 mRNA 從出生后15日齡小鼠即有一定轉錄水平,到23 d齡轉錄水平有顯著升高,隨后維持較低水平;Prm1 mRNA自23 d出現微量特異性轉錄,至35日齡轉錄水平達最高,隨后維持較高水平(圖2)。
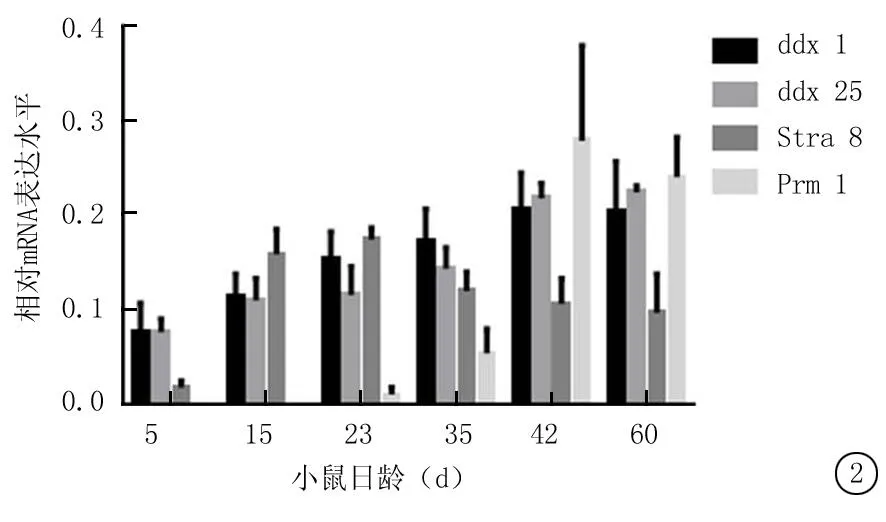
圖2實時熒光定量PCR法檢測ddx1 mRNA在不同日齡小鼠睪丸組織中的表達
Figure 2The expression of ddx1 mRNA by quantitative real-time PCR in mouse testis at different ages
2.3DDX1蛋白在不同日齡小鼠睪丸組織中的表達5、15和23日齡小鼠睪丸組織中無DDX1蛋白條帶出現;35、42、60日齡小鼠睪丸組織中可見相對分子質量為82 000處有條帶出現(圖3)。
2.4DDX1蛋白在不同日齡小鼠睪丸組織中的表達與定位5、15和23日齡小鼠睪丸組織中未見DDX1蛋白的表達(圖4B、C、D);DDX1蛋白的陽性
表達首先出現于35日齡小鼠睪丸生精細胞的胞質中,呈弱陽性表達(圖4E),主要在精母細胞與圓形精子細胞胞質中表達(圖4F);在42日齡小鼠睪丸組織中DDX1蛋白則分別在睪丸間質細胞胞質,精原細胞、精母細胞和圓形精子細胞的胞質與胞核中表達,其中精母細胞和圓形精子細胞中的陽性表達較強,長形精子細胞的胞核無表達(圖4G、H);60日齡小鼠睪丸組織中DDX1蛋白的表達與42日齡小鼠睪丸組織中的表達情況一致(圖4I、J)。對照組為陰性(圖4A)。

圖3免疫印跡法檢測DDX1蛋白在不同日齡小鼠睪丸組織中的表達
Figure 3The expression of DDX1 by Western blotting in mouse testis at different ages
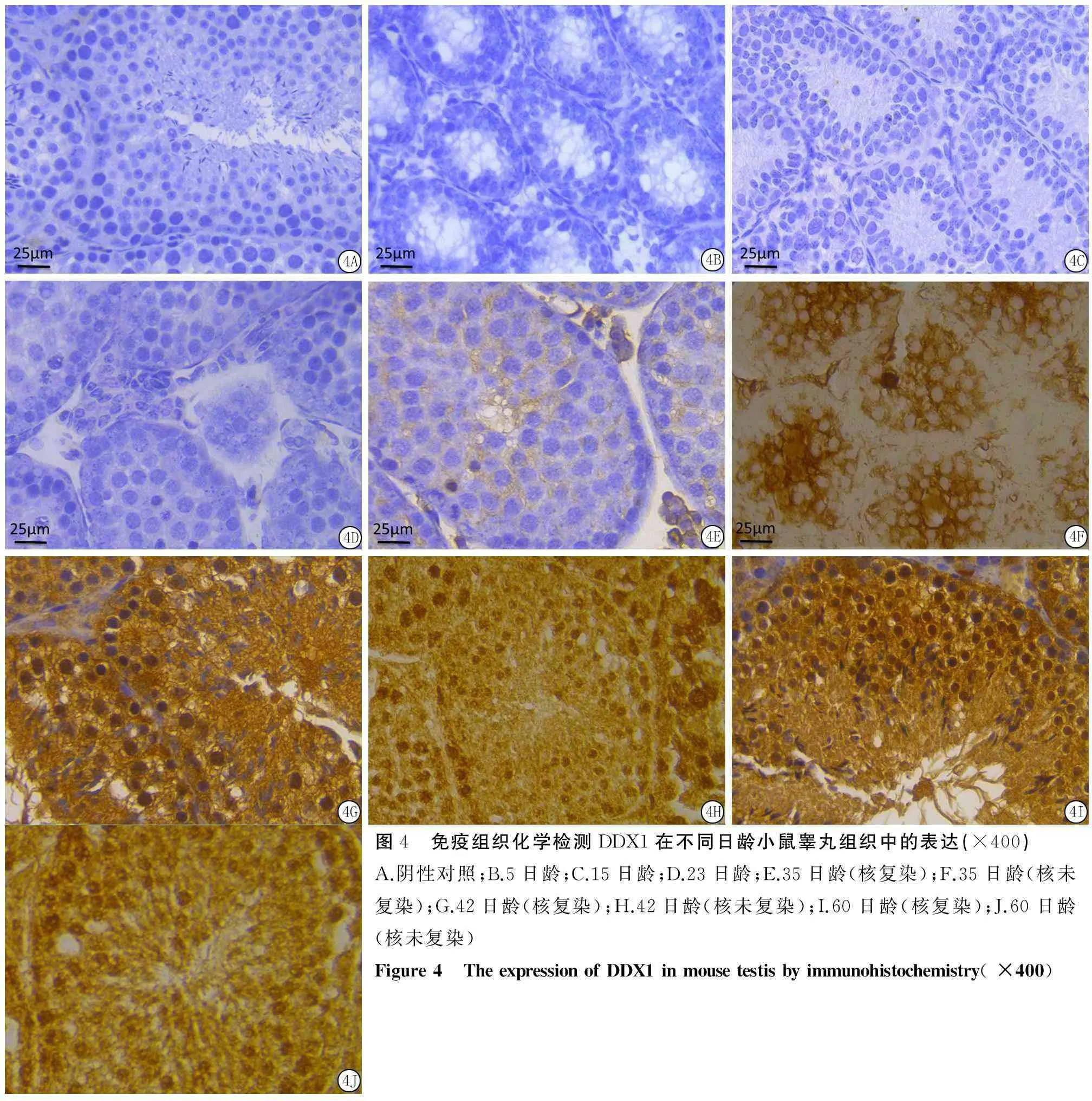
圖4 免疫組織化學檢測DDX1在不同日齡小鼠睪丸組織中的表達(×400)A.陰性對照;B.5日齡;C.15日齡;D.23日齡;E.35日齡(核復染);F.35日齡(核未復染);G.42日齡(核復染);H.42日齡(核未復染);I.60日齡(核復染);J.60日齡(核未復染)Figure4 TheexpressionofDDX1inmousetestisbyimmunohistochemistry(×400)
3討論
隨著生殖健康研究的深入開展,男性不育的病因研究取得了較大進步。男性不育癥患者的精液中沒有精子,通常被稱為NOA。中國有25%的NOA患者的長輩中有NOA患者。研究證實,相當比例的NOA患者的病因是基因突變[7]。近年來與男性不育相關的基因突變或多態現象日益成為研究熱點。因此,研究精子發生相關基因的特性與功能,將為男性生精障礙發病機制的闡明、臨床診斷、靶向治療與男性避孕奠定基礎。本研究前期發現ddx1基因在小鼠的腦、肝、腎和睪丸組織中均有表達,但DDX1蛋白僅在腦和睪丸組織中檢測到,為進一步研究ddx1基因與蛋白在小鼠睪丸組織中的確切表達與其在精子發生中的作用,本研究先從顯微組織學水平入手,將生后0~60日齡的C57BL/6j小鼠的睪丸組織進行石蠟包埋并連續切片,系統觀察該小鼠睪丸組織結構與功能的變化規律,較完整地揭示小鼠精子發生過程各階段與小鼠生后日齡的具體對應關系,旨在為后續基因與蛋白分子水平的功能研究提供實驗基礎。本研究形態學結果顯示,C57BL/6j小鼠在精子發生過程中,生精細胞的減數分裂在出生后第15天左右開始,生精上皮內偶見前細線期精母細胞,到第18天左右,生精上皮內的粗線期精母細胞的數量增加明顯,到第23天時,可見少量減數分裂完成而形成的圓形精子細胞。第25天圓形精子細胞進入精子形成階段,形態開始發生改變,到第35天生精上皮內可見到少量形態改變即將完成的長形精子細胞。第42天在生精上皮的管腔側可見到長出鞭毛的精子,提示小鼠睪丸組織中的第1個精子發生波結束,第60天小鼠生精小管內可見大量精子提示小鼠進入成年期。因此,本研究選取第1個精子發生波相關的時間點,即生后第5、15、23、35、42天以及成年期生后第60天作為對比,對ddx1基因與蛋白在睪丸組織中的動態表達進行研究,探討其在小鼠精子發生過程中的作用。
在精子發生的多種調控因素中起決定性作用的是生精細胞內基因水平的調控[8]。許多特異性基因均具有各發育階段的特異性表達和不同生精細胞的特異性表達的特征[9]。研究特定基因在精子發生中的作用需從該基因在精子發生過程中的基因與蛋白的表達入手。因此,本研究選取與第1個精子發生波時間點相對應的不同生后日齡,減數分裂開始對應15日齡,染色質的濃縮對應23日齡,形態改變過程對應35日齡,精子形成對應42日齡。一般情況基因特異表達于精子發生過程中的某種生精細胞,則該基因的轉錄產物將出現在睪丸發育的某個特定時期,并與精子發生的特定階段一致。本研究從基因水平開始,首先探討ddx1 mRNA是否表達于不同日齡C57BL/6j小鼠睪丸組織內。實時熒光定量PCR檢測結果顯示不同日齡小鼠睪丸組織中均有ddx1 mRNA的表達,表達水平呈現逐漸升高的趨勢,于42日齡后趨于穩定,表達水平與60日齡無明顯差異,提示ddx1基因在精子發生過程中未表現出明顯的時空特異性,但在睪丸組織內確實有ddx1 mRNA的表達。同時,本研究將ddx25、Stra8和Prm1作為對照[10-12],結果顯示,在不同日齡小鼠睪丸組織中均可檢測到ddx25的表達,15日齡小鼠睪丸內Stra8 mRNA的表達開始升高,35日齡小鼠睪丸組織中開始出現Prm1 mRNA的表達,于42日齡達到最高。提示小鼠睪丸組織RNA的提取與檢測方法正確,小鼠生精細胞于15日齡左右開始進入減數分裂階段,35日齡小鼠睪丸組織中開始出現長形精子細胞,于42日齡長形精子細胞數量明顯增加,進一步驗證了對小鼠睪丸發育階段組織學觀察的正確性。有研究顯示,在精子發生過程中僅有20%左右的基因表達與蛋白表達具有相關性,大多數基因與蛋白表達的特異性并不一致[13]。同時,精子形成后不再進行轉錄,精子發生的相關基因在精子發生早期即開始進行轉錄,并可在睪丸組織中檢測到該基因的表達,但轉錄產物沒有立即翻譯形成蛋白,在數日內呈抑制狀態,直到精子發生至特定階段需要特定蛋白表達時才進行翻譯[14],即基因表達水平并不代表蛋白水平的表達。因此,本研究考慮ddx1基因很可能以上述這種方式對精子發生進行調控,于是接著進行DDX1蛋白在睪丸組織與生精細胞中表達與定位的研究。
本研究分別應用免疫印跡法檢測不同日齡小鼠睪丸組織中DDX1蛋白的總體表達情況和免疫組織化學方法檢測DDX1蛋白在不同生精細胞中的表達定位。免疫印跡結果顯示,5、15和23日齡小鼠睪丸組織中未見DDX1蛋白的表達,35日齡小鼠睪丸組織內開始出現DDX1蛋白的表達,隨著日齡的增加,蛋白的表達水平逐漸增高。提示ddx1基因的表達與蛋白的表達情況確實不一致,轉錄后直到減數分裂后期才進行翻譯形成蛋白產物表達于睪丸組織。為了進一步探討DDX1蛋白的表達是否具有階段與細胞特異性,本研究采用免疫組織化學法檢測不同日齡小鼠睪丸組織中DDX1蛋白的表達與定位,結果與免疫印跡結果一致,5、15和23日齡小鼠睪丸組織中未見DDX1蛋白的表達;陽性表達首先出現于35日齡小鼠精母細胞與圓形精子細胞胞質中;在42日齡小鼠睪丸組織中DDX1蛋白則分別表達于精原細胞、精母細胞和圓形精子細胞的胞質與胞核,其中精母細胞和圓形精子細胞中的陽性表達較強,長形精子細胞的胞核未見表達。提示ddx1基因在小鼠睪丸圓形精子細胞的形成與形態改變過程中發揮作用,雖然不參與減數分裂的起始,但對維持減數分裂的正常進行可能發揮作用。RNA解旋酶家族幾乎參與全部與RNA相關的生命活動,如RNA二級結構的改變,轉錄起始與調控,線粒體RNA剪接,核糖體和剪接體裝配,mRNA降解與穩定性維持,翻譯調控等[15]。Ddx1作為該家族的成員之一,也具有上述一些功能。本研究結果顯示DDX1蛋白在生精細胞的表達中有時空特異性,但與其基因的表達不完全一致。提示ddx1基因可能在轉錄后翻譯水平在精子發生過程中發揮作用。本研究結果還顯示42日齡小鼠睪丸間質細胞的胞質中有DDX1蛋白的表達。提示ddx1基因可能與睪丸間質細胞合成分泌雄激素的功能發揮有關。
綜上所述,ddx1基因在不同日齡小鼠睪丸組織中表達,但無階段特異性,DDX1蛋白在不同日齡小鼠睪丸組織中的表達有時空特異性與生精細胞特異性。提示ddx1基因在精子發生過程中調控作用可能發生在轉錄后翻譯水平,可為臨床生精障礙的診治提供新指標。為了探討ddx1基因在精子發生過程中的精確作用,本研究后期將把RNA干擾技術與生精細胞體外培養技術結合進行深入研究。
[參考文獻]
[1]Senti KA,Jurczak D,Sachidanandam R,et al.piRNA-guided slicing of transposon transcripts enforces their transcriptional silencing viaspecifying the nuclear piRNA repertoire[J].Genes Development,2015,29(16):1747-1762.
[2]Cherry AA,Ananvoranich S.Characterization of a homolog of DEAD-box RNA helicases in Toxoplasma gondii as a marker of cytoplasmic mRNP stress granules[J].Gene,2014,543(1):34-44.
[3]Singh P,Schimenti JC.The genetics of human infertility by functional interrogation of SNPs in mice[J].Proc Natl Acad Sci USA,2015,112(33):10431-10436.
[4]Celik H,Sajwan KP,Selvanathan SP,et al.Ezrin binds to dead-box rna helicase ddx3 and regulates its function and protein level[J].Mol Cell Biol,2015,35(18):3145-3162.
[5]Leng L,Tan Y,Gong F,et al.Differentiation of primordial germ cells from induced pluripotent stem cells of primary ovarian insufficiency[J].Human Reprod,2015,30(3):737-748.
[6]Kavarthapu R,Tsai-Morris CH,Fukushima M,et al.A 5′-flanking region of gonadotropin-regulated testicular RNA helicase (GRTH/DDX25) genedirects its cell-specific androgen-regulated gene expression[J].Endocrinology,2013,154(6):2200-2207.
[7]Vloeberghs V,Verheyen G,Haentjens P,et al.How successful is TESE-ICSI in couples with non-obstructive azoospermia? [J].Hum Reprod,2015,30(8):1790-1796.
[8]Yuan Y,Zhou Q,Wan H,et al.Generation of fertile offspring from Kit(w)/Kit(wv) mice through differentiation of gene corrected nuclear transfer embryonic stem cells[J].Cell Res,2015,25(7):851-863.
[9]Coutton C,Escoffier J,Martinez G,et al.Teratozoospermia:spotlight on the main genetic actors in the human[J].Hum Reprod Update,2015,21(4):455-485.
[10]Takebe M,Onohara Y,Yokota S.Expression of MAEL in nuage and non-nuage compartments of rat spermatogenic cells and colocalization with DDX4,DDX25 and MIWI[J].Histochem Cell Biol,2013,140(2):169-181.
[11]Sahin P,Sahin Z,Gungor-Ordueri NE,et al.Inhibition of mammalian target of rapamycin signaling pathway decreases retinoic acid stimulated gene 8 expression in adult mouse testis[J].Fertil Steril,2014,102(5):1482-1490.
[13]Hu JR,Liu M,Hou CC,et al.Gene expression pattern of KIFC3 during spermatogenesis of the skink Eumeces chinensis[J].Gene,2015,556(2):206-212.
[14]Krieger T,Simons BD.Dynamic stem cell heterogeneity[J].Development,2015,142(8):1396-1406.
[15]Desai SS,Roy BS,Mahale SD.Mutations and polymorphisms in FSH receptor:functional implications in human reproduction[J].Reproduction,2013,146(6):R235-248.
(本文編輯:許卓文)
Developmental expression of ddx1 in mouse testis
LI Li,ZHANG Lei,GONG Miao,ZHAO Xiu-jun,ZHAO Yu*
(Department of Histology and Embryology,the School of Basic Medical Science,Hebei Medical University,Shijiazhuang 050017,China)
[Abstract]ObjectiveTo identify the different developmental stages of testis in mice.To investigate the dynamic expression of ddx1 mRNA and protein in mouse testis as well as the function of ddx1 during spermatogenesis.MethodsParaffin sections were used with H&E staining to show morphological structure of normal mouse spermatogenesis at postnatal stages of the developing testis.Quantitative real-time PCR was used to establish the ddx1 mRNA expression in the testis of mice at different ages.Immunohistochemistry and Western blotting were carried out to detect the expression and distribution of DDX1 protein in mouse testis and spermatocytes.ResultsHistological analysis showed morphological structure of normal mouse spermatogenesis at different postnatal stages of the developing testis from 5,15,23,35,42,60-day old mice.Quantitative real-time PCR showed that express of ddx1 mRNA situate at low relatively at postnatal P5,then increased at P15 and retained high afterwards.Western blotting confirmed that the specific expression of DDX1 protein in mouse testis.The DDX1 antigen was detected in testis of 35,42 and 60-day old and located mainly in the cytoplasm and nuclear of spermatocyte and round spermatid by immunohistochemistry.ConclusionThe ddx1 mRNA and protein expressed in the testis of mice at different stage during spermatogenesis.It indicated that ddx1 may be involved in the regulation of spermatogenesis and spermiogenesis.
[Key words]spermatogenesis;ddx1;testis;spermatocyte;mice
[中圖分類號]R321.1
[文獻標志碼]A
[文章編號]1007-3205(2015)12-1365-06
[作者簡介]李莉(1976-),女,河北石家莊人,河北醫科大學基礎*通訊作者。E-mail:441678544@qq.com
[基金項目]國家自然科學基金項目(81373787)
[收稿日期]2015-09-14;[修回日期]2015-11-21
醫學院講師,醫學博士,從事生殖生物學與組織學研究。

