入院血糖水平與急性腦梗死患者短期預后的相關性分析
李海燕,沈光莉,劉文宏,付 睿
目前,受生活環境及飲食結構等多因素影響,糖尿病在我國的發病率逐年上升。急性缺血性卒中患者中,21%~44.4%的患者合并有糖尿病[1~3],40.1%~53.0%的患者發病后血糖水平升高[4]。糖尿病是缺血性卒中的獨立危險因素。研究表明,血糖調節異常(IGR)可作為我國缺血性卒中患者1 y 死亡的獨立預測因素[5]。本研究對560 例急性腦梗死患者的資料進行回顧性分析,探討入院血糖水平對急性腦梗死患者短期預后的影響。
1 資料與方法
1.1 研究對象 連續性納入我院2014 年1 月~2014 年12 月診治的急性腦梗死患者。納入標準:符合WHO 制定的急性腦卒中診斷標準;符合中華醫學會第四屆全國腦血管病會議制定的缺血性腦血管病診斷標準;經顱腦MRI +DWI 證實為急性缺血性卒中;發病24 h 入院的腦梗死患者;初次發病或既往有腦梗死病史但無遺留明顯神經功能缺陷患者。排除標準:嚴重感染病史;嚴重肝、腎疾病史;明確惡性腫瘤病史;以及各種原因不能完成隨訪的患者。共納入560 例,其中男性326 例,女性234 例。平均年齡67.3 ±6.75 歲。所有患者均接受急性腦梗死臨床常規治療,包括抗血小板聚集、改善循環、營養腦細胞、調節血脂、調節血壓、調節血糖等。部分患者發病3 h 內入院,接受了靜脈溶栓治療。
1.2 血糖的測定及分組 所有患者入院24 h內取靜脈血,采用實驗室葡萄糖氧化酶法行空腹血糖測定,正常值3.9~6.1 mmol/L。詢問患者既往史,無糖尿病史患者7 d 后行葡萄糖耐量試驗(oral glucose tolerance test,OGTT)。依據既往史、入院空腹血糖水平及OGTT 結果,將患者分為3 組:(1)正常血糖組:指既往無糖尿病史,入院空腹血糖位于3.9~6.1 mmol/L,7 d 時OGTT 空腹血糖≤6.1 mmol/L,餐后2 h 血糖≤7.8 mmol/L。(2)應激性高血糖組:指入院時空腹血糖≥6.1 mmol/L,7 d OGTT 時空腹血糖≤6.1 mmol/L,餐后2 h 血糖≤7.8 mmol/L。(3)糖尿病組:指既往有明確糖尿病史;或無明確糖尿病史,入院時空腹血糖≥7.0 mmol/L,7 d 時OGTT 空腹血糖≥7.0 mmol/L,餐后2 h血糖≥11.1 mmol/L。
1.3 神經功能評價 對所有入組的患者在入院時、出院時進行美國國立衛生研究院卒中量表(National Institute of Health stroke scale,NIHSS)評分,評價患者神經功能缺損程度。患者發病30 d、90 d時進行隨訪,隨訪的形式主要為患者到門診進行隨訪,僅有一小部分不能到院的患者為電話隨訪。于發病30 d 時通過NIHSS 評分評估患者神經功能恢復情況。于發病90 d 時通過Barthel 指數對患者進行獨立生活能力評價來評估預后。
1.4 統計學分析 采用SPSS17.0 統計軟件包進行統計學處理。計量資料用表示,計數資料采用率或構成比表示。組間因素比較,計量資料采用t 檢驗或方差分析,計數資料采用χ2檢驗,P<0.01為差異有顯著性。
2 結果
2.1 基線資料 各組患者基線資料見表1。入院時,性別、發病至入院間隔、既往吸煙史、飲酒史、高血壓病史、房顫病史、冠心病史、既往卒中病史以及入院時基線總膽固醇、甘油三酯、低密度脂蛋白、高密度脂蛋白等方面,3 組患者之間比較無明顯差異。3 組患者在年齡、入院時血糖水平、入院時HbA1C 以及入院時NIHSS 評分比較時,存在顯著性差異,具有統計學意義(P <0.01);糖尿病組患者入院時NIHSS 評分明顯高于正常血糖組,具有統計學意義(P <0.01)。
2.2 發病30 d 神經功能恢復情況 在30 d 隨訪時,3 組患者的NIHSS 評分較發病時均有明顯下降,有統計學意義(P <0.01);糖尿病組患者入院時NIHSS 評分、30 d 時NIHSS 評分均明顯高于正常血糖組及應激性高血糖組,具有統計學意義(P <0.01)。
2.3 發病90 d 時神經功能恢復情況 在90 d隨訪時,應激性高血糖組及糖尿病組的Barthel 指數明顯低于正常血糖組,具有統計學意義(P <0.01);應激性高血糖組及糖尿病組的死亡率明顯高于正常血糖組,具有統計學意義(P <0.01)。
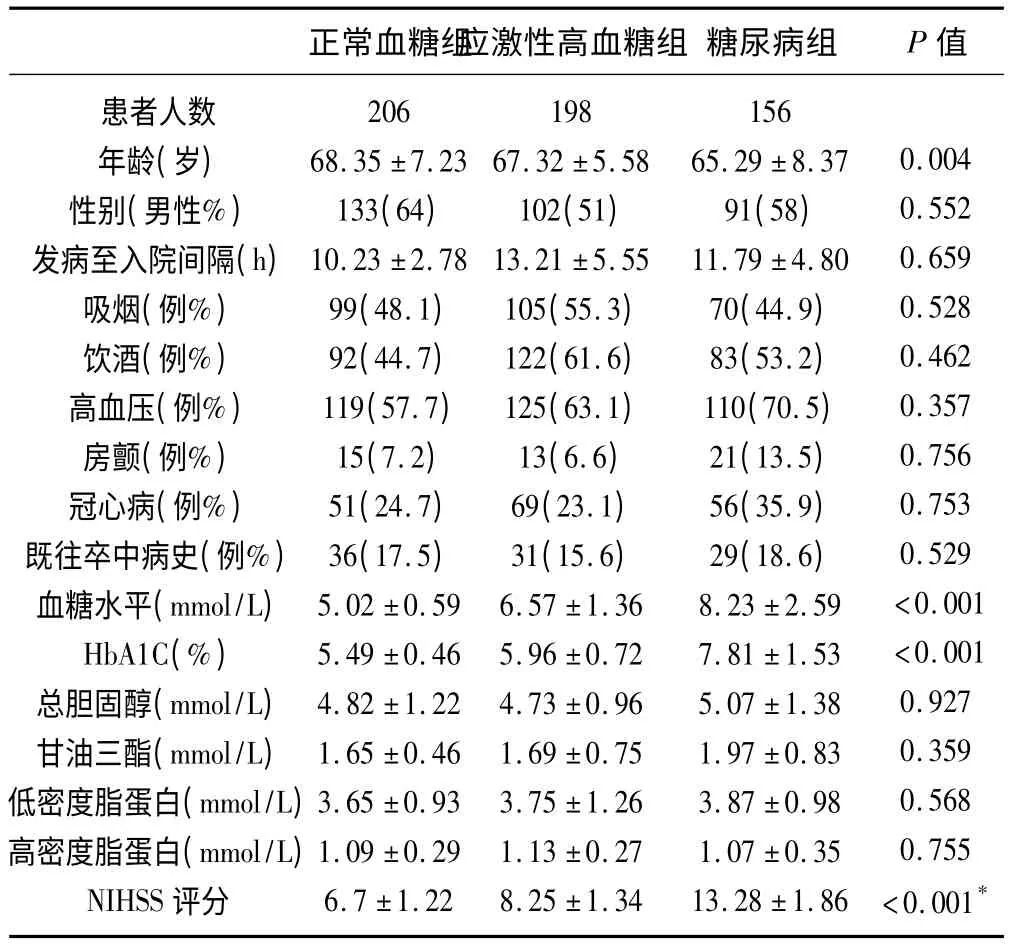
表1 3 組患者基線資料

表2 發病30 d 時神經功能恢復情況
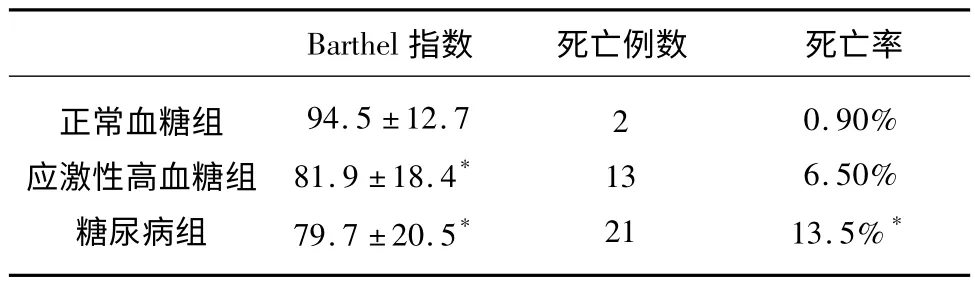
表3 發病90 d 時Barthel 指數和死亡率比較
3 討論
缺血性卒中患者發病后血糖水平升高的比例可高達40.1%~53.0%[4]。基于日本人群的一項臨床研究發現,缺血性卒中發生后血糖水平升高的比例更是高達68.0%[6]。卒中后血糖升高的原因可能是應激性高血糖、潛在的糖耐量受損、未曾發現的糖尿病以及糖尿病性高血糖,前者指非糖尿病患者在卒中后出現的短期高血糖現象。應激性高血糖的發生,可能與以下因素相關:卒中事件直接影響腦部血糖調節中樞;腦組織缺血缺氧興奮激活了下丘腦-垂體-腎上腺軸,進而出現神經內分泌紊亂;部分患者可能出現卒中后胰島素抵抗,比例可高達77%[7]。
Muir 等[8]研究發現,36.3%的非糖尿病患者以及80.9%的糖尿病患者入院時存在血糖升高;在入院48 h 內,48.1%的非糖尿病患者以及88.1% 的糖尿病患者存在血糖升高。研究同時發現,卒中后48 h 內血糖升高與不良預后明顯相關。大量研究證實,糖尿病可加重卒中后神經功能損傷,增加卒中后死亡率,但有關入院血糖水平與卒中患者短期預后的相關性研究并不多見。
本研究結果顯示,30 d 隨訪時,糖尿病組的NIHSS 評分明顯高于正常血糖組及應激性高血糖組;90 d 隨訪時,應激性高血糖組及糖尿病組的Barthel 指數明顯低于正常血糖組,且應激性高血糖組及糖尿病組的死亡率明顯高于正常血糖組,均具有統計學意義。本研究結果表明入院時血糖水平升高與患者短期不良預后相關。
Meta 分析結果顯示,非糖尿病患者,應激性血糖升高可使卒中后30 d 的死亡率增加3 倍(OR=3.07,95%CI:2.5-3.79);對于糖尿病患者,應激性血糖升高并沒有明顯增加卒中后短期死亡率(OR=1.03,95%CI:0.49-3.43)[9]。基于我國人群的一項研究證實,血糖調節異常是缺血性卒中患者1 y 死亡的獨立預測因素,研究入選了2639 例中國缺血性卒中患者,隨訪1 y 結果顯示,伴血糖調節異常者死亡率明顯高于血糖調節正常者(6.8% vs 2.1%),但兩組患者殘疾和卒中復發率相似[5]。Fuentes 等研究結果表明,高血糖使卒中后3 m 不良結局(mRS>2)的風險增加2.7 倍(OR=3.7,95%CI:1.42-5.27),3 m 的死亡風險增加了2.8 倍(OR=3.8,95%CI:1.79-8.10)[10]。
高血糖影響卒中患者預后的機制可能與下列因素相關:(1)高血糖會導致乳酸積累和細胞內酸中毒,加速脂質過氧化反應,促進自由基的形成以及細胞內Ca2+超載,損害線粒體功能,加重對缺血半暗帶的神經毒性作用[11,12]。(2.)高血糖可引起腦血管滲透壓升高,減少腦組織的血流量,增大梗死面積。Venables 等[13]在貓腦缺血模型中發現,對貓腹腔注射葡萄糖再灌注1 h 后,缺血半暗帶的血流下降40%,而血糖正常對照組的缺血半暗帶血流僅下降11%。(3)高血糖會導致內皮細胞功能損傷,長期高血糖會引起體內廣泛小動脈及顱內大動脈動脈硬化。(4)高血糖導致血腦屏障通透性增加,促進腦梗死后出血轉化[14]。
本研究表明,缺血性卒中患者入院血糖水平與神經功能恢復及短期預后相關,可作為評估病情的一項有效指標。及時、積極的監測及調控患者入院血糖水平對改善預后、降低病死率及致殘率具有重要意義。今后仍需進行大樣本、前瞻性、多中心的研究進一步驗證。
[1]Sun Y,Paul M,Toh HS.Impact of diabetes mellitus (DM)on the health-care utilization and clinical outcomes of patients with stroke in singapore[J].Int Soc Pharm Outcomes Res(ISPOR),2009,1098-3015:S101-S105.
[2]Kernan WN,Viscoli CM,Inzucchi SE,et al.Prevalence of abnormal glucose tolerance following a transient ischemic attack or ischemic stroke[J].Arch Intern Med,2005,165:227-233.
[3]Megherbi SE,Milan C,Minier D,et al.Association between diabetes and stroke subtype on survival and functional outcome 3 months after stroke data from the European BIOMED Stroke Project[J].Stroke,2003,34:688-694.
[4]Williams LS,Rotich J,Qi R,et al.Effects of admission hyperglycemia on mortality and costs in acute ischemic stroke[J].Neurology,2002,59:67-71.
[5]Jia Q,Liu G,Zheng H,et al.Impaired glucose regulation predicted 1-year mortality of Chinese patients with ischemic stroke:data from abnormal glucose regulation in patients with acute stroke across China[J].Stroke,2014,45(5):1498-1500.
[6]Urabe T,Watada H,Okuma Y,et al.Prevalence of abnormal glucose metabolism and insulin resistance among subtypes of ischemic stroke in Japanese patients[J].Stroke,2009;40:1289-1295.
[7]Ivey FM,Ryan AS,Hafer-Macko CE,et al.High prevalence of abnormal glucose metabolism and poor sensitivity of fasting plasma glucose in the chronic phase of stroke[J].Cerebrovasc Dis,2006,22:368-371.
[8]Muir KW,McCormick M,Baird T,et al.Prevalence,Predictors and Prognosis of Post-Stroke Hyperglycaemia in Acute Stroke Trials:Individual Patient Data Pooled Analysis from the Virtual International Stroke Trials Archive (VISTA)[J].Cerebrovasc Dis Extra,2011,1(1):17-27.
[9]Capes SE,Hunt D,Malmberg K,et al.Stress hyperglycemia and prognosis of stroke in nondiabetic and diabetic patients[J].Stroke,2001,32(10):2426-2432.
[10]Fuentes B,Castillo J,San Jose B,et al.The prognostic value of capillary glucose levels in acute stroke:the GLycemia in Acute Stroke(GLIAS)study[J].Stroke,2009,40:562-568.
[11]Siesjo BK,Bendek G,Koide T,et al.Influence of acidosis on lipid peroxidation in brain tissues in vitro[J].J Cereb Blood Flow Metab,1985,5:253-258.
[12]Ou Yang YB,Mellerg?rd P,Kristián T,et al.Influence of acid-base changes on the intracellular calcium concentration of neurons in primary culture[J].Exp Brain Res,1994,101:265-271.
[13]Venables GS,Miller SA,Gibson G,et al.The effects of hyperglycaemia on changes during reperfusion following focal cerebral ischaemia in the cat[J].J Neurol Neurosurg Psychiatry,1985,48:663-669.
[14]Dietrich WD,Alonso O,Busto R.Moderate hyperglycemia worsens acute blood-brain barrier injury after forebrain ischemia in rats[J].Stroke,1993,24:111-116.

