利培酮治療精神分裂癥前后血清腦源性神經營養因子的變化
張云飛,賈黎方
(1.江蘇省徐州市東方人民醫院檢驗科 221000;2.江蘇省徐州精神病院檢驗科 221004)
?
·論 著·
利培酮治療精神分裂癥前后血清腦源性神經營養因子的變化
張云飛1,賈黎方2
(1.江蘇省徐州市東方人民醫院檢驗科 221000;2.江蘇省徐州精神病院檢驗科 221004)
目的 探討利培酮治療精神分裂癥前后患者血清腦源性神經營養因子(BDNF)的含量變化。方法 分別采集健康對照者(健康對照組)和精神分裂癥患者(病例組)經利培酮治療前后的靜脈血,使用ELISA法檢測血清BDNF含量。結果 利培酮治療前病例組血清BDNF平均濃度為(10.50±5.47)μg/L,與健康對照組(11.08±5.17)μg/L比較,差異無統計學意義(P>0.05);病例組患者治療后血清BDNF平均濃度為(9.66±4.43)μg/L,與治療前比較,差異也無統計學意義(P>0.05)。結論 BDNF對精神分裂癥的診斷和判斷預后的價值尚不確定。
腦源性神經營養因子; 精神分裂癥; 利培酮
血清腦源性神經營養因子(BDNF)及其受體在神經系統廣泛表達,其通過與特異性跨膜受體絡氨酸蛋白激酶B(TrkB)結合,作用于神經元細胞、神經膠質細胞和某些免疫細胞,參與神經元的生長、分化及修復[1]。近年來研究發現精神分裂癥患者血清BDNF含量低于健康人群。本研究檢測利培酮治療精神分裂癥患者前后的血清BDNF含量,探討BDNF作為精神分裂癥診斷及判斷預后的實驗室檢測指標的可行性。現報道如下。
1 資料與方法
1.1 一般資料 (1)病例組:選擇2012年10月至2013年4月徐州市東方人民醫院收治的40例精神分裂癥患者,年齡16~80歲,平均年齡(34.7±14.3)歲,其中男21例,女19例。(2)健康對照組:隨機挑選體檢健康者40例,無心腦血管疾病及其他嚴重的軀體疾病,均無煙酒嗜好,既往無精神疾病史,懷孕及哺乳期女性未入組。年齡16~80歲,平均年齡(33.4±10.3)歲,其中男20例,女20例。2組研究對象的年齡、性別等一般資料比較,差異無統計學意義(P>0.05),具有可比性。健康對照組研究對象來自體檢中心,均同意參加本項研究。
1.2 入選和排除標準 (1)診斷符合《中國精神疾病分類與診斷標準》第3版(CCMD-3),包括首發和復發病例,病例由2名主治醫師診斷,并由1名主任醫師復核一致。(2)復發病例入組前30 d內未服用抗精神病藥物,6個月內未接受無抽搐電休克(MECT)治療。(3)陽性和陰性癥狀量表(PANSS)評分由2名經過培訓的資深精神科醫師進行,治療前PANSS總分大于60分。治療后PANSS減分率大于或等于50%。(4)患者或其監護人對本研究過程知情并同意參加。(5)排除標準:合并心腦血管、內分泌、腫瘤及其他嚴重的軀體疾病。有煙草、酒精及其他精神性物質濫用史。懷孕及哺乳期女性。
1.3 方法 病例組患者每日早飯后服用抗精神病藥物(利培酮),首劑量1 mg/d,在1周左右的時間內逐漸加大至每日2~4 mg,第2周內逐漸加大至每日4~6 mg,然后維持該劑量,或根據個體調整。總療程4周,期間不合并使用其他抗精神病藥物,不使用MECT治療。分別采集健康對照者及患者治療前后的空腹靜脈血3 mL,室溫放置30 min后離心(3 500 r/min,10 min),收集血清,取0.5 mL血清分裝,-70 ℃保存,使用ELISA法檢測BDNF水平。
1.4 儀器與試劑 Multiskan-MK3酶標儀(美國Thermo),美國進口分裝RD人腦源性神經營養因子檢測試劑盒(ELISA)。
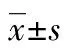
2 結 果
2.1 利培酮治療前后病例組男、女性患者的BDNF含量結果比較。見表1。

表1 病例組治療前后男、女性患者BDNF含量結果比較
注:與男性比較,*﹟P>0.05;與治療前比較,△☆P>0.05。
2.2 健康對照組與病例組BDNF含量結果比較。見表2。
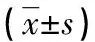
表2 健康對照組與病例組治療前后BDNF含量f消癌平對不同民族食管癌患者術后免疫功能的研究結果比較
注:與健康對照組比較,*P>0.05;與病例組治療前比較,﹟P>0.05。
3 討 論
目前研究發現BDNF與精神分裂癥動物模型的建立、疾病的發生及治療均有關。Pan等[2]研究表明大鼠血清BDNF能通過血-腦屏障,且與腦組織中的BDNF含量呈正相關。BDNF可促進多巴胺能神經元的生長和發育并影響多巴胺受體的表達。Vogel等[3]研究報道,腦內BDNF含量的降低會導致多巴胺能受體的表達發生變化,使可能導致精神分裂癥的受體占優勢,從而參與精神分裂癥的發生。也有研究顯示精神分裂癥患者藥物治療能恢復腦內BDNF含量并改善精神癥狀。相關學者的實驗研究都顯示慢性精神分裂癥患者BDNF含量較健康者低[4-5]。Cui等[6]通過系統綜述法分析國內外研究精神分裂癥與BDNF關系的相關文獻,發現統計結果雖然表明患者血清BDNF較健康人群低,但由于現有的研究質量較低等原因,精神分裂癥患者BDNF低的證據應屬性較弱,需要進一步研究證實后才有可能作為精神分裂癥診斷的生物學指標。也有學者的研究結果相反,Reis 和Nieolato[7]分析了40例慢性精神分裂癥患者和20例健康對照者的血清BDNF含量,發現病例組明顯高于健康對照組,其血清含量與PANSS陰性癥狀分數呈正相關。本研究檢測了40例精神分裂癥患者治療前血清BDNF濃度,男性患者血清BDNF平均濃度為(9.31±3.72)μg/L,女性患者為(11.34±3.62)μg/L,差異無統計學意義(P>0.05)。治療后男性患者血清BDNF平均濃度為(8.72±3.94)μg/L,女性患者為(10.69±3.78)μg/L,差異也無統計學意義(P>0.05),治療后的男、女性分別與治療前比較,差異無統計學意義(P>0.05)。健康對照組健康者血清BDNF平均濃度為(11.08±5.17)μg/L,病例組患者治療前血清BDNF平均濃度為(10.50±5.47)μg/L,較健康者低,但差異無統計學意義(P>0.05)。本研究結果與Toyooka等[4]和Xiu等[5]結果不一致,而與Reis和Nieolato[7]的研究結果一致。究其原因可能是精神分裂癥患者BDNF并未發生數量上的改變,而是發生質量改變,可能是由于編碼BDNF的基因發生突變,從而編碼出不具備生物學效應的BDNF分子,失去了保護和修復神經元細胞的作用[8]。BDNF基因的單核苷酸多態性Val66Met,即編碼多肽鏈上第66位纈氨酸(Val)的密碼子GUG被編碼甲硫氨酸(Met)的密碼子取代,使得具有生物學活性的BDNF生產減少,患者記憶功能下降,顳葉和額葉體積減少[9]。Weickert 等[10]研究了精神分裂癥、情感障礙、抑郁癥等重癥精神疾病的BDNF含量及其受體TrkB,發現患者TrkB降低。本研究結果提示,精神分裂癥患者也有可能是BDNF的受體TrkB減少,從而使BDNF無法發揮其生物學效應。
本組比較精神分裂癥患者治療前和治療后血清BDNF濃度變化表明,患者治療前血清BDNF濃度為(10.50±5.47)μg/L,經過4周利培酮治療后減分率均大于50%,治療效果顯著,而治療后的BDNF濃度為(9.66±4.43)μg/L,與治療前比較,差異無統計學意義(P>0.05),本研究結果顯示BDNF在精神分裂癥的診斷和判斷預后的價值尚不明確,其在精神分裂癥的發生、發展過程中的變化仍需擴大樣本量進行更深一步的研究。
[1]Murray PS,Holmes PV.An overview of brain-derived neurotrophic factor and implications for excitotoxic vulnerability in the hippocampus[J].Int J Pept,2011,211(76):654-685.
[2]Pan W,Banks WA,Fasold MB,et al.Transport of brain-derived neurotrophic factor across the blood-brain barrier[J].Neuropharmacology,1998,37(12):1553-1561.
[3]Vogel M,Busse S,Freyberger HJ,et al.Dopamine D3 receptor and schizophrenia:a widened scope for the immune hypothesis[J].Med Hypotheses,2006,67(2):354-358.
[4]Toyooka K,Asama K,Watanabe Y,et al.Decreased levels of brain-derived neurotrophic factor in serum of chronic schizophrenic patients[J].Psychiatry Res,2002,110(3):249-257.
[5]Xiu MH,Hui L,Dang YF,et al.Decreased serum BDNF levels in chronic institutionalized schizophrenia on long-term treatment with typical and atypical antipsychotics[J].Prog Neuropsychopharmacol Biol Psychiatry,2009,33(8):1508-1512.
[6]Cui HR,Jin Y,Wang JJ,et al.Serum brain-derived neurotrophic factor (BDNF) levels in schizophrenia:a systematic review[J].Shanghai Archives of Psychiatry,2012,24(5):250-260.
[7]Reis HJ,Nieolato R.Increased serum levels of brain-derived neurotrophic factor in chronic institutionalized patients with schizophrenia[J].Neurosci Lett,2008,439(92):157-159.
[8]Egan M,Kojima M,Callicot JH,el al.The BDNF val66met polymorphism affects activity-dependent secretion of BDNF and human memory and hippocampal function[J].Cell,2003,112(2):257-269.
[9]謝勇,孫劍.腦源性神經營養因子與精神分裂癥[J].神經疾病與精神,2007,7(1):65-68.
[10]Weickert CS,Barillo M,Webster MJ.BDNF reductions in schizophrenia and affective disorders may be reversible with antidepressant treament[J].Abstracts Schizophrenia Research,2008,102(1/3):279-283.
The change of serum brain-derived neurotrophic factor in schizophrenia before and after risperidone treatment
ZHANGYun-fei1,JIALi-fang2
(1.DepartmentofClinicalLaboratory,DongfangPeople′sHospital,Xuzhou,Jiangsu221000,China;2.DepartmentofClinicalLaboratory,MentalHospitalofXuzhou,Xuzhou,Jiangsu221004,China)
Objective To explore the change of serum brain-derived neurotrophic factor in schizophrenia before and after risperidone treatmentMethods Venous blood were collected in healthy controls and schizophrenia patients before and after treatment with risperidone,BDNF levels were measured by alzyme linked immunosorbent assay (ELISA),Statistical software SPSS13.0 was used to analysis the dataResults The mean concentration of serum BDNF in schizophrenia patients were (10.50±5.47) μg/L,and (11.08±5.17) μg/L in healthy subjects,which had no significant difference between schizophrenia patients and healthy subjects (P>0.05).The mean concentration of serum BDNF were (9.66±4.43) μg/L in schizophrenia patients after risperidone treatment,which had no significant difference compared with pre-treatment patients (P>0.05).Conclusion The value of BDNF in diagnosis and prognosis of schizophrenia is still uncertain.
brain-derived neurotrophic factor; schizophrenia; risperidone
張云飛,女,碩士,主管檢驗師,主要從事生物化學檢驗與診斷研究。
10.3969/j.issn.1672-9455.2015.12.045
A
1672-9455(2015)12-1772-02
2014-12-25
2015-02-13)

