結腸癌組織VEGF 表達與樹突狀細胞浸潤的臨床意義及與血清VEGF濃度及其活化水平的相關性
張子杰 (河南省南陽市中心醫院病理科,南陽 473009)
結腸癌是消化道中最常見的惡性腫瘤之一,近 年來,我國結腸癌的發病率逐年上升,目前已居于惡性腫瘤發病率的第二位[1]。腫瘤血管的形成是腫瘤發生中的必要條件,在腫瘤生長、浸潤及轉移方面都起著不可替代的作用。而腫瘤血管的新生是一個十分復雜的過程,受到多種因子調控,其中功能最強、特異性最高的是血管內皮生長因子(Vascular endothelial growth factor,VEGF),它能夠促進內皮細胞分裂、增殖和血管構建、遷移,增加血管通透性[2]。除決定腫瘤血管生成外,VEGF 還具有一定的免疫調節功能,能夠降低機體內的免疫監視功能,從而促進免疫逃逸[3,4]。樹突狀細胞(Dendritic cells,DCs)在誘導、調節、維持機體抗腫瘤免疫中起核心作用,是目前已知的體內唯一能激活且功能最強的初始T 細胞的抗原提呈細胞[5]。有研究表明,腫瘤組織中浸潤的DCs 存在成熟障礙,會導致機體無法進行有效的免疫反應[6]。已有報道表明[7],結直腸癌患者外周血DCs 在腫瘤抗原刺激下誘導T淋巴細胞產生IL-10 而導致腫瘤免疫逃逸,DCs 數量和功能異常在結直腸癌發生、發展中具有重要的作用。本課題通過分析結腸癌組織中VEGF 的表達水平及血清VEGF 濃度與樹突狀細胞浸潤及其活性的相關性,揭示VEGF 與DCs 在結腸癌發病及轉移過程中的分子機制。
1 材料與方法
1.1 臨床資料 2011 年1 月~2013 年12 月經我院經病理學確診接受結腸癌根治術的90 例結腸癌患者納入本次研究。所有結腸癌患者術前均無接受過放療、化療,并且無長期接受非甾體消炎藥、糖皮質激素類藥以及其他影響患者免疫功能的藥物。90例結腸癌患者中,男性59 例(65.56%)、女性31 例(34.44%);年齡范圍26~83 歲,平均年齡(52.73±12.40)歲。所有病理標本切除后測量最大直徑,在腫瘤中心取標本進行HE 染色,明確浸潤程度、分化程度和病理分期。取腫瘤組織外2cm 癌旁組織作為對照,并經過病理檢查排除累及腫瘤。90 例結腸癌患者,腫瘤TNM 分期Ⅰ期13 例(14.44%)、Ⅱ期15 例(16.67)、Ⅲ期35 例(38.89%)、Ⅳ期27 例(30.00%);黏膜下層浸潤37 例(41.11%)、黏膜層浸潤53 例(58.89%);左半結腸52 例(57.78%),右半結腸38 例(42.22%);高度分化20 例(22.22%)、中度分化23 例(25.56%)和低度分化47 例(52.22%);無淋巴結轉移49 例(54.44%)、有淋巴結轉移41 例(45.56%)。隨機選取30 例結腸癌患者術前抽取空腹肘靜脈血,其中男性21 例(70.00%),女性9 例(30.00%),年齡范圍27~78歲,平均年齡(52.26±11.73)歲,另選擇同期行健康體檢受試者30 例作為對照,其中男性20 例(66.67%)、女性10 例(33.33%),年齡范圍25~80,平均年齡為(51.64±13.27)歲。本研究得到醫院倫理委員會的批準,并且所有患者均知情同意。
1.2 主要試劑和儀器 兔抗人單克隆抗體VEGF、兔抗人S-100 多克隆抗體、ABC 試劑、DAB 試劑盒,均由北京中杉金橋生物技術有限公司提供;人VEGF ELISA 檢測試劑盒,由深圳達科為公司提供;FITC-CD83,由美國BD 公司提供;外周血淋巴細胞分離液(Ficoll),由挪威Axis-shield 公司提供。EXL808 全自動酶標儀,由美國BIO-TEK 公司提供;FACS Calibur cytometer 和Cell Quest 軟件,均由美國BD Biosciences 公司提供。
1.3 方法
1.3.1 免疫組化法測定組織中VEGF 及S-100 蛋白的表達 采用免疫組化Envision 兩步法。使用10% 甲醛溶液固定標本后,經脫水和石蠟包埋處理。4 μm 連續切片,經脫蠟和梯度酒精水化后,使用pH 8.0 的EDTA 在95℃~99℃下水浴抗原修復,冷卻至室溫后,使用2%山羊血清在室溫條件下封閉30 min,滴加VEGF 或S-100 一抗后4℃過夜,PBS 洗滌,加生物素二抗工作液37℃孵育30 min,滴加ABC 試劑,PBS 洗滌,DAB 顯色,使用蘇木精復染后,常規梯度乙醇脫水,使用二甲苯做透明處理后,用中性樹膠封片。陰性對照選擇PBS,陽性對照選擇已知的VEGF 或S-100 陽性切片,分別以VEGF和S-蛋白染色結果評分表示VEGF 的表達強度和DCs 的浸潤程度。以細胞漿中出現棕黃色顆粒者判定為VEGF 或DCs 陽性,以陽性染色細胞百分數及染色強度計分評判染色結果,染色結果評分為陽性染色細胞計數評分和染色強度評分之積,陰性(-)評分<1 分,弱陽性(+)2~3 分,中度陽性(++)4~5 分,強陽性(+++)>5 分。
1.3.2 酶聯免疫吸附試驗檢測血清VEGF 濃度外周血VEGF 水平的測定,采用雙抗夾心ELISA 法,嚴格按試劑盒所提供的說明進行操作。主要步驟:加抗體包被,4℃過夜,洗滌,拋干;加待檢抗原,37℃30 min,洗滌,拋干;加酶標抗體,37℃30 min,洗滌,拋干;加底物液,37℃15 min,加終止液;用ELISA檢測儀測定OD 值。各檢測孔內VEGF 濃度標準曲線根據標準品的標準曲線來計算。
1.3.3 DCs 活化水平的測定 外周血單核細胞利用Ficoll 分離,離心收集上清液,凍存于-70℃冰箱中備用。將單核細胞復蘇,調整細胞密度為5 ×106個/ml,將細胞鋪于24 孔板中于37℃5%CO2孵箱培養,培養第5 天加入TNF-α 促進DCs 成熟。收集收獲的DCs,加入FITC-CD83,4℃孵育30 min,PBS洗滌,多聚甲醛固定,采用FACS Calibur cytometer 對獲得DCs 中成熟DC 進行計數,以流量200 μl 為限,對照調零后檢測CD83 細胞含量,并推算原細胞懸液中CD83 DC 總量。
1.4 統計學分析 數據統計分析使用SPSS13.0。計量資料以±s 表示,采用獨立樣本t 檢驗進行兩組間的比較,采用ANOVA 分析進行多組間比較;計數資料采用χ2檢驗,以百分率表示,等級資料采用秩和檢驗;相關性采用Spearman 等級相關分析。P<0.05 在統計學上有顯著性差異。
2 結果
2.1 結腸癌組織和正常結腸組織VEGF 和S-100蛋白陽性表達率的比較 結腸癌組織和結腸癌旁組織VEGF 和S-100 蛋白陽性表達差異具有統計學意義(P <0.01),具體見表1。結腸癌組織VEGF 陽性表達率分別為47.78%(43/90),較結腸癌旁組織顯著提高(χ2值=47.232,P=0.000)。結腸癌組織S-100 蛋白陽性表達率為47.78%(43/90),較結腸癌旁組織顯著降低(χ2=3.895,P=0.048)。
2.2 結腸癌患者和健康受試者外周血VEGF 水平和DCs 活化水平的比較 結腸癌患者外周血VEGF水平較健康受試者顯著升高,而外周血DCs 中CD83 水平較健康受試者顯著降低,差異均具有統計學意義(P <0.01),具體見表2。
2.3 VEGF 和S-100 蛋白在結腸癌中的表達與臨床病理關系的單因素分析 VEGF 和S-100 蛋白的表達與結腸癌臨床病理參數之間的關系見表3。VEGF 和S-100 蛋白的表達與患者年齡、性別、浸潤程度和腫瘤位置不相關(P >0.05),但是與腫瘤分期、分化程度和淋巴結轉移相關(P <0.01)。
2.4 結腸癌組織VEGF 和DCs 浸潤程度的相關性分析 相關分析結果顯示(見表4),VEGF 表達強度與DCs 浸潤程度呈負相關(rs=-0.445,P=0.008)。
2.5 結腸癌組織VEGF 表達與外周血VEGF 水平和DCs 活化水平的相關性分析 相關分析結果顯示,結腸癌組織VEGF 表達與外周血VEGF 正相關(rs=0.613,P=0.000),與DCs 活化水平負相關(rs=0.426,P=0.010)。
2.6 結腸癌組織DCs 浸潤程度與外周血VEGF 水平和DCs 活化水平的相關性分析 相關分析結果顯示,結腸癌組織DCs 浸潤程度與外周血VEGF 負相關(rs=-0.527,P=0.006),與DCs 活化水平正相關(rs=0.645,P=0.010)。

表1 結腸癌組織和正常結腸組織VEGF 和S-100 蛋白陽性表達率的比較Tab.1 VEGF and S-100 protein positive rate in colon cancer tissue and normal pericarcinous tissue
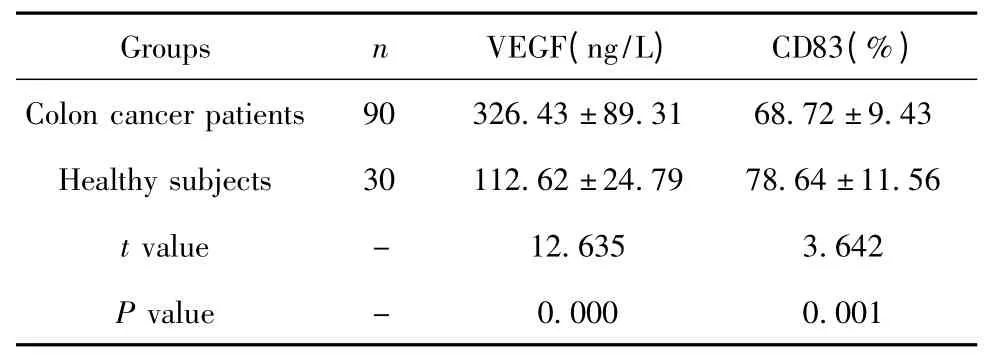
表2 結腸癌患者和健康受試者外周血VEGF 水平和DCs活化水平的比較Tab.2 Sera VEGF and DCs activation level in colon cancer patients and healthy subjects
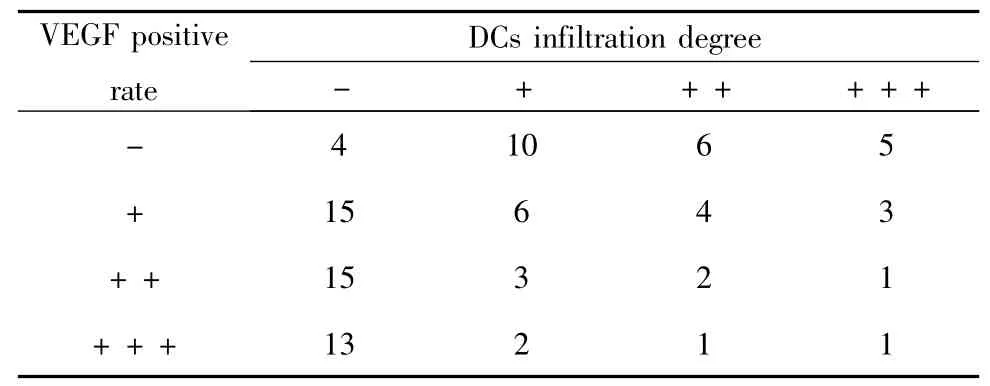
表4 結腸癌組織VEGF 和DCs 浸潤程度的相關性分析Tab.4 Correlation between VEGF expression and DCs infiltration in colon cancer tissues
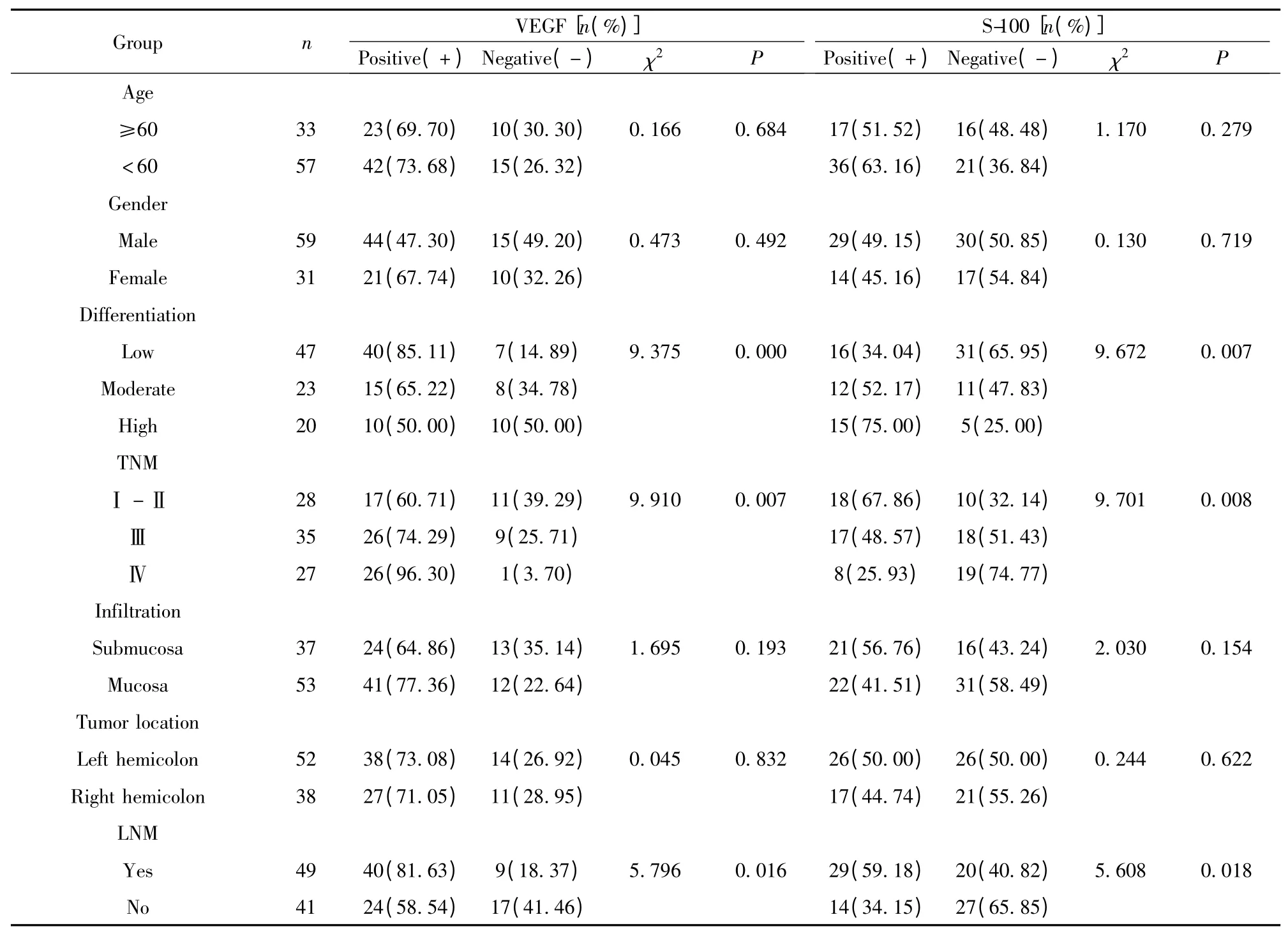
表3 VEGF 和S-100 蛋白在結腸癌中的表達與臨床病理的關系Tab.3 Correlation between VEGF,S-100 protein expression and clinical pathological features in colon cancer
3 討論
微環境中血管形成因子VEGF 與腫瘤血管的生成密切相關。VEGF 是新生血管形成的中心調控因子,是重要的促進血管生成因子,在惡性腫瘤的發生、發展過程中起著重要的作用,并且瘤細胞表達VEGF 是腫瘤具備侵襲性的必需條件[8]。VEGF 廣泛表達于多種細胞,包括內皮細胞及腫瘤細胞、巨噬細胞、平滑肌細胞和成纖維細胞,且以腫瘤細胞和內皮細胞為主,表達具有一定的異質性。VEGF 與血管內皮細胞生長因子受體(Vascular endothelial growth factor receptor,VEGFR)特異性結合,通過旁分泌途徑刺激腫瘤血管內皮細胞增殖、遷移并形成新生的血管[9]。此外,VEGF 還可以促進成纖維細胞、單核細胞及內皮細胞的浸潤,增強血管通透性,有利于腫瘤基質的形成,以此促進腫瘤轉移的活性[10,11]。本研究結果顯示,結腸癌患者外周血VEGF 水平較健康受試者顯著升高(P <0.01),并且結腸癌組織VEGF 陽性表達率較結腸癌旁組織顯著增加(P <0.01)。分析結腸癌組織VEGF 陽性表達率與結腸癌臨床病理參數關系的結果顯示,VEGF表達與腫瘤分期、分化程度和淋巴結轉移相關(P <0.01),提示VEGF 參與結腸癌的發生和發展。
DCs 能夠啟動機體的免疫反應,不需要其他任何刺激因子的存在,是目前已知的體內唯一能激活的且功能最強的初始T 細胞的抗原提呈細胞。DCs具有攝取、處理和提呈抗原的能力,能活化初始T細胞和增殖記憶性T 細胞,在啟動、調控和維持T細胞免疫應答中發揮重要作用。DCs 可通過表達抗原刺激信號和共刺激信號啟動免疫應答[12]。髓樣細胞的不正常分化會造成DCs 功能障礙,導致成熟DCs 數量下降以及部分黏附分子、幼稚型樹突狀細胞(Immature dendritic cell,iDC)和不成熟髓樣細胞增加等。iDCs 有較強的攝取和處理抗原能力,且會誘導T 細胞的免疫耐受[13],因此只有成熟型樹突狀細胞(Mature dendritic cell,mDC)將抗原提呈并激活初始CD4+和CD8+T 細胞[14],發揮特異性抗腫瘤免疫效應[15]。多種腫瘤患者體內存在DCs 功能障礙或iDCS 增多的現象,不能有效地遞呈腫瘤抗原,加之DCs 表面共刺激分子和黏附分子的低表達或不表達,使得抗腫瘤免疫的核心產生CD8+的細胞毒性淋巴細胞(Cytotoxic lymphocyte,CTL)無法有效識別、殺傷腫瘤細胞,是腫瘤免疫逃逸的主要原因[16]。S-100 蛋白是一組可溶性、低分子量、高酸性的蛋白質,特異性表達于DCs 細胞質和細胞核上,而單核細胞和巨噬細胞內不表達S-100,因此S-100 蛋白可作為腫瘤浸潤樹突狀細胞的特異性標記物[17]。本研究結果顯示,結腸癌組織S-100 蛋白陽性表達率較結腸癌旁組織顯著降低(P <0.05),S-100 蛋白的表達與腫瘤分期、分化程度和淋巴結轉移相關(P <0.01),提示DCs 浸潤參與結腸癌的發生和發展。已有研究顯示,腫瘤組織內腫瘤細胞和局部浸潤的DCs 之間存在相互作用,來源于腫瘤細胞的IL-10、TGF-B、PGE2,可以誘導局部浸潤的DCs,使其具有免疫調節和耐受活性[18]。
DCs 在提呈抗原之前以未成熟狀態iDC 遍布全身各組織器官,一旦iDC 捕獲抗原,可迅速分化為mDC,mDC 細胞膜上組織相容性抗原Ⅱ類分子表達上調,淋巴細胞功能相關抗原T 淋巴細胞活化輔助分子表達明顯升高,并出現DCs 成熟標志CD83[19]。因此,本研究采用CD83 水平作為外周血DCs 的活化水平。本研究結果顯示,而外周血DCs 中CD83水平較健康受試者顯著降低,結腸癌患者體內DCs活化水平降低,導致機體免疫調節和耐受活性降低。研究顯示,VEGF 可抑制DCs 細胞分化以及DCs 活性而介導免疫逃逸[20]。相關性分析結果顯示,結腸癌組織VEGF 表達強度與結腸癌組織DCs 浸潤程度和外周血DCs 活化水平呈負相關(P <0.01),外周血VEGF 水平與結腸癌組織DCs 浸潤程度以及外周血DCs 活化水平呈負相關(P <0.01),提示VEGF可抑制DCs 的浸潤和活化。
總之,結腸癌組織VEGF 表達和DCs 浸潤可能共同參與結腸癌的進展,并且VEGF 可抑制DCs 浸潤和活化。
[1]姜毅楠,蔡 遜,馬丹丹,等.趨化因子受體1 在人結腸癌中的表達及其與腫瘤轉移的相關性研究[J].華中科技大學學報(醫學版),2014,43(4):427-430.
[2]白麗淼,黃曉峰,徐寒梅.人結腸癌HT-29 移植瘤不同生長階段微血管密度及相關因子的表達研究[J].中國藥理學通報,2014,30(6):796-800.
[3]Kim H,Kataru RP,Koh GY.Regulation and implications of inflammatory lymphangiogenesis[J].Trends Immunol,2012,33(7):350-356.
[4]Sheng KC,Wright MD,Apostolopoulos V.Inflammatory mediators hold the key to dendritic cell suppression and tumor progression[J].Curr Med Chem,2011,18(36):5507-5518.
[5]Whiteside TI.Antitum or vaccines in head and neck cancer:targeting immune responses to the tumor[J].Curr Cancer Drug Targets,2007,7(7):633-642.
[6]Pinzon-Chatty A,Maxwell Lopez JA.Dendritic cell dysfunction in cancer:a mechanism for immunosuppression[J].Immunol Cell Biol,2005,83(5):451-461.
[7]秦建民,盛 霞,楊 林,等.樹突狀細胞功能異常對結直腸癌肝轉移的影響[J].中華普通外科雜志,2011,26(5):371-376.
[8]Malhot L,Stenninger J.Behavior of seeds and soil in the mechanism of metastasis:a deeper understanding[J].Cancer Sci,2012,103(4):626-631.
[9]Jemal A,Bray F,center MM,et al.Global cancer statistics[J].CA Cancer J Clin,2011,61(2):69-90.
[10]Tie J,Desai J.Antiangiogenic therapies targeting the vascular endothelia growth factor signaling system[J].Crit Rev Oncog,2012,17(1):51-67.
[11]Eichmann A,Simons M.VEGF signaling inside vascular endothelial cells and beyond[J].Curr Opin Cell Biol,2012,24(2):188-193.
[12]仇江輝,黃禮明,趙國靜,等.扶正透毒祛毒復方對髓系微小殘留白血病患者CD 34 +細胞源樹突狀細胞的影響[J].北京中醫藥大學學報,2013,36(9):612-616.
[13]Delirezh N,Moazzeni SM,Shokri F,et al.Autologous dendritic cells loaded with apoptotic tumor cells induce T cell mediated immune responses against breast cancer in vitro[J].Cell Immunol,2009,257(1/2):23-31.
[14]郝建朋,郭金帥,郭大偉,等.自然成熟型樹突狀細胞對CD4+CD25+調節性T 細胞擴增的影響[J].中國現代普通外科進展,2011,17(1):12-16.
[15]Fujii S,Takayama T,Asakura M,et al.Dendritic cell based cancer immunotherapies[J].Arch Immunol Ther Exp,2009,57(3):189-198.
[16]Kawakam IY.Cancer treatment by comprehensive regulation of antitumor immune network[J].Nippon Rinsho,2010,68(6):1094-1099.
[17]Lu L,Qian S,Hershberger PA,et al.Fas ligand(CD95L)and B7 expressoin on endritic cells provide counter-regulatory signals for T cell survival and proliferation[J].J Immunol,1997,158(12):5676-5684.
[18]Ma Y,Shurin GV,Gutkin DW,et al.Tumor associated regulatory dendritic cells[J].Semin Cancer Biol,2012,22(4):298-306.
[19]王 穎,張利榮,吳德平貝氏柯克斯體重組蛋白對樹突狀細胞活化作用分析[J].中華傳染病雜志,2011,29(11):653-659.
[20]肖煒明,吳克艷,龔衛娟,等.胃癌組織VEGF 表達及血清VEGF 濃度與DCs 浸潤及其活性的關聯分析[J].中國免疫學雜志,2013,2(7):700-705.

