內皮素3在不同毛色綿羊皮膚中的差異表達
楊姍姍,白俊明,范瑞文,耿建軍,焦丁興,周 英,董常生*
(1.山西農業大學動物科技學院,太谷 030801;2.河北省清河縣農業局,清河 054000)
內皮素3在不同毛色綿羊皮膚中的差異表達
楊姍姍1#,白俊明1#,范瑞文1,耿建軍1,焦丁興2,周 英1,董常生1*
(1.山西農業大學動物科技學院,太谷 030801;2.河北省清河縣農業局,清河 054000)
本研究旨在探討內皮素3在綿羊皮膚毛色中的作用。采用實時熒光定量PCR、Western blotting和免疫組織化學對內皮素3在黑色和白色綿羊皮膚中的表達差異進行分析。實時熒光定量PCR結果顯示,內皮素3在黑色綿羊皮膚中的相對表達量較高,是其在白色綿羊皮膚中的表達量的2.89倍,且差異極顯著(P<0.01);Western blotting結果顯示,內皮素3在黑色綿羊皮膚總蛋白中的表達量極顯著高于其在白色綿羊皮膚總蛋白中的表達量(P<0.01);免疫組織化學結果表明,內皮素3在白色綿羊皮膚毛囊的毛乳頭上方、毛球底部及外根鞘呈陽性表達,而在黑色綿羊皮膚毛囊的毛球底部和部分外根鞘呈陽性表達。綜上表明,內皮素3可能參與綿羊毛色形成。
內皮素3;皮膚;綿羊
內皮素(Endothelin,Edn)是由21個氨基酸組成的多肽,存在于血管內皮和各種組織及細胞中,參與心血管功能的調節,在維持基礎血管張力與心血管系統穩態方面有著重要作用。內皮素包含3種異構體:Edn1、Edn2和Edn3[1]。在這3種內皮素異構體中,Edn3對來源于神經脊(NC)細胞的黑素細胞的發育有著主要作用[1]。在胚胎發生過程中,Edn3不僅控制起源神經嵴黑素細胞轉化的開始并可以維持其表型;在體外Edn3可以促進培養的正常的人體黑色素細胞、痣細胞和黑色素瘤細胞的生長和遷移[2]。越來越多的研究表明:Edn3在促進黑色素細胞增殖的同時對黑色素的合成也有重要的調節作用。另有研究證明內皮素信號在黑色素細胞的發育和存活的過程中有著至關重要的作用[3]。目前,人們對Edn3在黑色素細胞中黑色素生成和皮膚色素沉積的研究僅僅局限在體外對人、鼠[4-6]、鵪鶉[7]等少數動物,而對毛用動物體內的研究甚少。
綿羊是一種經濟價值較高的毛用動物,毛色是綿羊的重要性狀之一,化學染色是羊毛實現色彩多樣性的主要手段,對人類健康以及環境保護產生不良影響。因此,從分子水平改變綿羊毛色將具有重要的意義,而發掘毛色基因及其功能將為此提供理論依據。動物毛色由黑色素的含量與分布決定,由多個基因調控[8]。關于Edn3在綿羊不同毛色形成過程中的作用未見報道,因此,本試驗以白色和黑色綿羊為研究對象,對Edn3在皮膚中的表達進行研究。
1 材料與方法
1.1 材料
選取白色和黑色成年雄性綿羊各3只。選取綿羊背側皮膚,凈毛后,用取皮器取綿羊皮膚組織3塊(0.8 cm2)。其中兩塊置于液氮中,分別用于實時熒光定量PCR和Western blotting; 1塊置于4% 的Bouin’s固定液中,固定24 h,石蠟包埋,切成5 μm的切片,用于免疫組織化學試驗。
1.2 主要試劑
兔抗內皮素3多克隆抗體(博奧森),山羊抗兔二抗(康為世紀),DAB顯色試劑盒(武漢博士德),Trizol Reagent(Invitrogen),2×Es Taq MasterMix(康為世紀),DL2000 DNA Marker(TaKaRa),反轉錄試劑盒(TaKaRa),SYBR?PrimeSciptTM RT-PCR Kit(Life)。
1.3 引物設計
通過對GenBank上的各個物種Edn3序列進行Blast后,獲取保守序列并利用Primer5.0引物設計軟件,設計熒光定量PCR擴增引物,通過NCBI初步檢測引物的特異性。引物由華大基因公司合成。引物見表1。
表1 目的基因引物序列和退火溫度
Table 1 Primer sequences and annealing temperature of PCR amplification of target genes

目的基因Targetgene引物序列(5′?3′)Primersequence產物/bpProductsEdn3F:TTTGCCTCTTCTTCCTTA,R:TATTCTCGGTAGTGTCCC163β?actinF:CCTGACCGGGAAGAGGAATC,R:AAAACAGGGGGTTGAACTC150
1.4 RNA提取和cDNA合成
用Trizol法提取總RNA。各取白色和黑色綿羊皮膚總RNA 1 μL,快速電泳檢測其質量。
按照TaKaRa公司反轉錄試劑盒進行綿羊皮膚cDNA合成,反應體系:Oligo dT(50 μmol·L-1)或Random 6 mers(50 μmol·L-1)1 μL,dNTP Mixture(10 mmol·L-1each)1 μL,總RNA ≤5 μg,用RNase free水補足至10 μL。反應條件:65 ℃ 5 min,反應結束,立即置于冰上冷卻。在此體系中再加入5×PrimeScript II Buffer 4 μL,RNase Inhibitor(40 U·μL-1)0.5 μL,PrimeScript II RTase(200 U·μL-1)1 μL,用RNase free水補足至20 μL。反應條件:42 ℃30~60 min,95 ℃5 min。反應結束后,置于冰上冷卻,-20 ℃保存備用。
按照Life試劑盒進行實時熒光定量PCR,每個樣本設3次重復,依次在冰上加樣:SYBR?Select Master Mix 10 μL,上下游引物(10 μmol·L-1)各0.4 μL,cDNA 1 μL,用RNase free水補足至20 μL。反應條件:95 ℃30 s;95 ℃5 s,55 ℃30 s,72 ℃10 s,40個循環,內參基因同樣反應條件。反應結束,由熔解曲線判定PCR反應的特異性,根據標準曲線以及熒光曲線的Ct值計算定量結果。數據用SPSS16.0軟件,應用方差分析進行生物統計學分析。不同樣本的2-△△CT法[9]用單因子方差分析,分析結果用“平均值± 標準誤(Means±SE)”表示,內皮素3 mRNA的表達差別倍數用2-△△CT表示。
1.5 免疫組織化學
固定24 h后的綿羊皮膚進行脫水透明后,在石蠟中進行包埋,然后切片烘干進行免疫組織化學試驗。試驗步驟:石蠟切片常規脫蠟、脫水,每張切片滴加一滴3%H2O2,置于37 ℃烘箱中,20 min用于滅活內源性過氧化物酶[8];PBS清洗3次,滴加5%牛血清白蛋白,37 ℃烘箱放置20 min進行封閉,甩掉封閉液,滴加1∶100兔抗Edn3多克隆抗體,4 ℃過夜;取出后,25 ℃反應30 min,PBS清洗3次。濾紙吸干PBS,滴加二抗,37 ℃孵育30 min,PBS清洗3次。滴加DAB顯色試劑,顯色5 min,根據顯色情況終止顯色。脫水、透明后,用中性樹膠封片。顯微鏡下觀察結果。用PBS取代一抗作為陰性比照,對染色結果的陽性產物進行分析。
1.6 總蛋白的提取與Western blotting檢測
提取液氮內剩余的綿羊皮膚組織的總蛋白。用BCA法測定蛋白濃度,每孔總蛋白上樣量為100 μg,進行聚丙烯酰胺凝膠電泳,轉移至PVDF膜,PVDF膜用5%脫脂奶粉封閉,室溫封閉1.5~2.0 h;將PVDF膜放入含有稀釋好的一抗的平皿中,4 ℃搖床過夜孵育;用TBST洗膜,每次10 min,共3次;加入二抗,37 ℃ 搖床孵育30 min,BST洗膜,加入ECL發光劑[9],用顯影劑和定影粉進行膠片曝光處理。用Image proplus 6.0軟件(Olympus)對綿羊皮膚組織總蛋白中的Edn3和β-actin免疫印跡結果進行半定量分析:蛋白總量=條帶面積×灰度值,Edn3與內參蛋白β-actin對比。數據用SPSS16.0軟件進行生物統計學分析,不同樣本的光密度用單因子方差分析,所得結果用“平均值±標準誤(Means±SE)”表示。
2 結 果
2.1Edn3基因的mRNA表達結果
從擴增動力學曲線上看,本研究結果符合標準的“S”形熒光增長曲線,目的基因Edn3和內參基因β-actin的擴增動力學曲線整體平行性較好,基線無明顯上揚趨勢(圖1A)。從擴增熔解曲線上看,曲線為單峰,表明在實時熒光定量PCR過程中,沒有非特異性的擴增產物,熒光強度均來于特異性的擴增產物,目的基因Edn3及內參基因β-actin沒有非特異性擴增及引物二聚體產生(圖1B)。結果表明,在mRNA水平,Edn3基因在黑色綿羊皮膚中的相對表達量是白色綿羊皮膚的2.89倍。且二者表達差異極顯著(P<0.01)(圖2)。
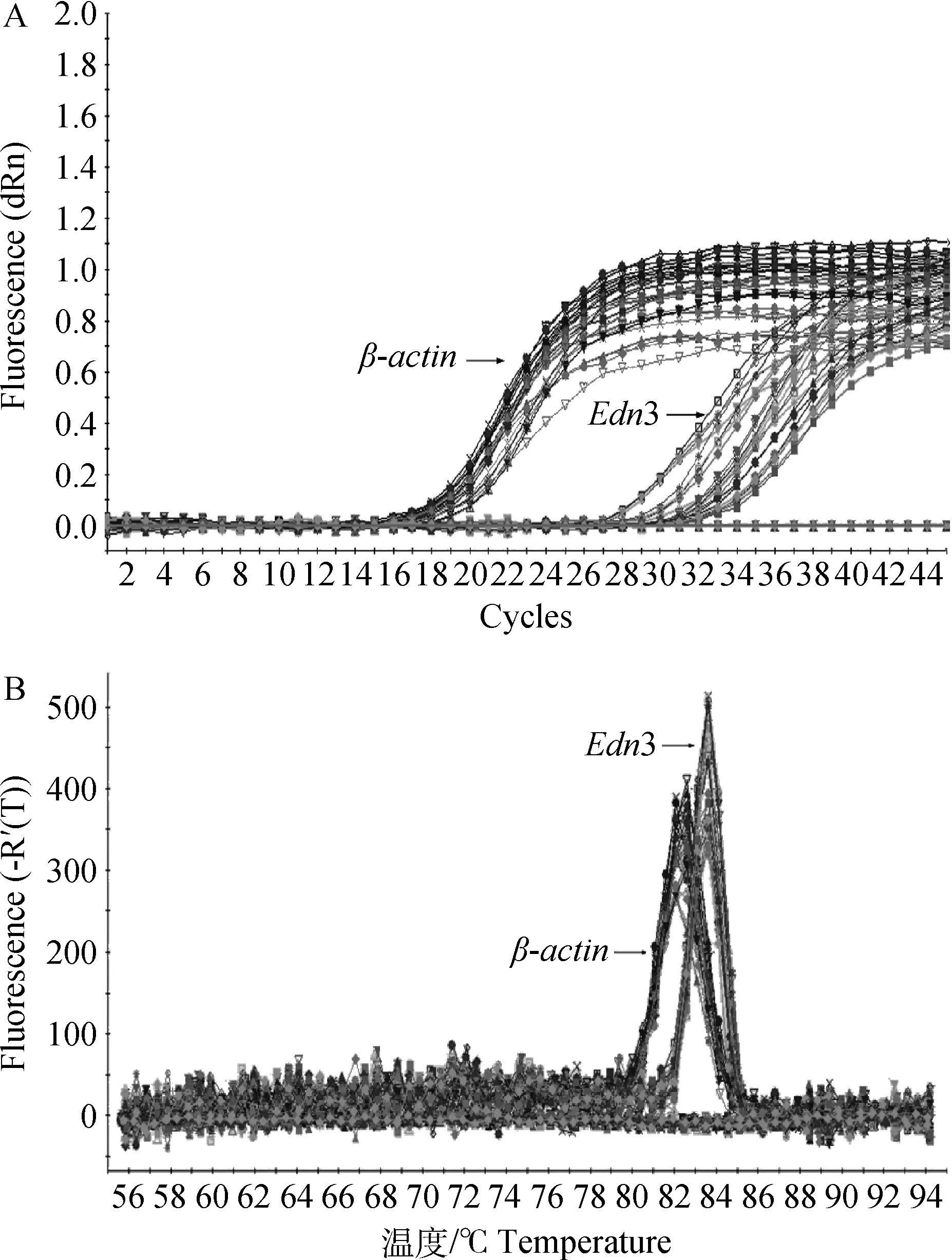
圖1 Edn3基因和內參基因的擴增動力學曲線(A)和熔解曲線(B)Fig.1 PCR amplification plot(A)and dissociation curve(B) of Edn3 and β-actin gene
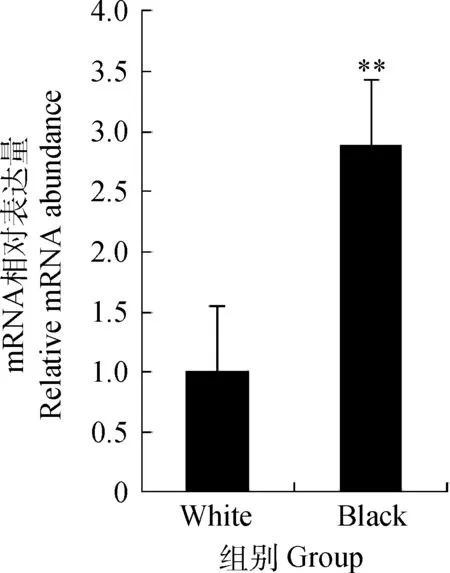
**.P<0.01。下同**.P<0.01.The same as below圖2 Edn3 mRNA在不同毛色綿羊皮膚中的表達Fig.2 Edn3 mRNA expression in sheep skins with different hair color
2.2 綿羊皮膚中Edn3蛋白表達結果
Western blotting結果顯示,綿羊皮膚總蛋白中存在與兔抗Edn3多克隆抗體發生免疫陽性反應的蛋白條帶,且分子質量符合實際大小。對不同毛色的綿羊皮膚內Edn3蛋白表達進行定性分析。從圖中可以看出在黑色綿羊皮膚中,Edn3蛋白水平表達較顯著,而在白色綿羊皮膚中檢測到的信號較弱(圖3A)。應用Inage proplus 6.0軟件對Edn3、內參β-actin的免疫印跡進行半定量分析,結果顯示,Edn3蛋白在白色綿羊皮膚中的平均蛋白含量為0.18±0.074;在黑色綿羊皮膚中的平均蛋白含量為1.47±0.12,兩者差異極顯著(P<0.01)(圖3B)。
2.3 綿羊Edn3蛋白在皮膚組織中的分布
免疫組織化學染色結果顯示,Edn3在白色綿羊皮膚和黑色綿陽皮膚的毛囊中均有免疫陽性反應,但不同毛色的綿羊皮膚毛囊其表達部位不同(圖4)。在白色綿羊中(圖4A、B),Edn3免疫陽性反應細胞分布在皮膚毛囊的毛乳頭上方,毛球底部和外根鞘;在黑色綿羊中(圖4C、D),Edn3免疫陽性細胞主要分布在皮膚毛囊的毛球底部和部分外根鞘。
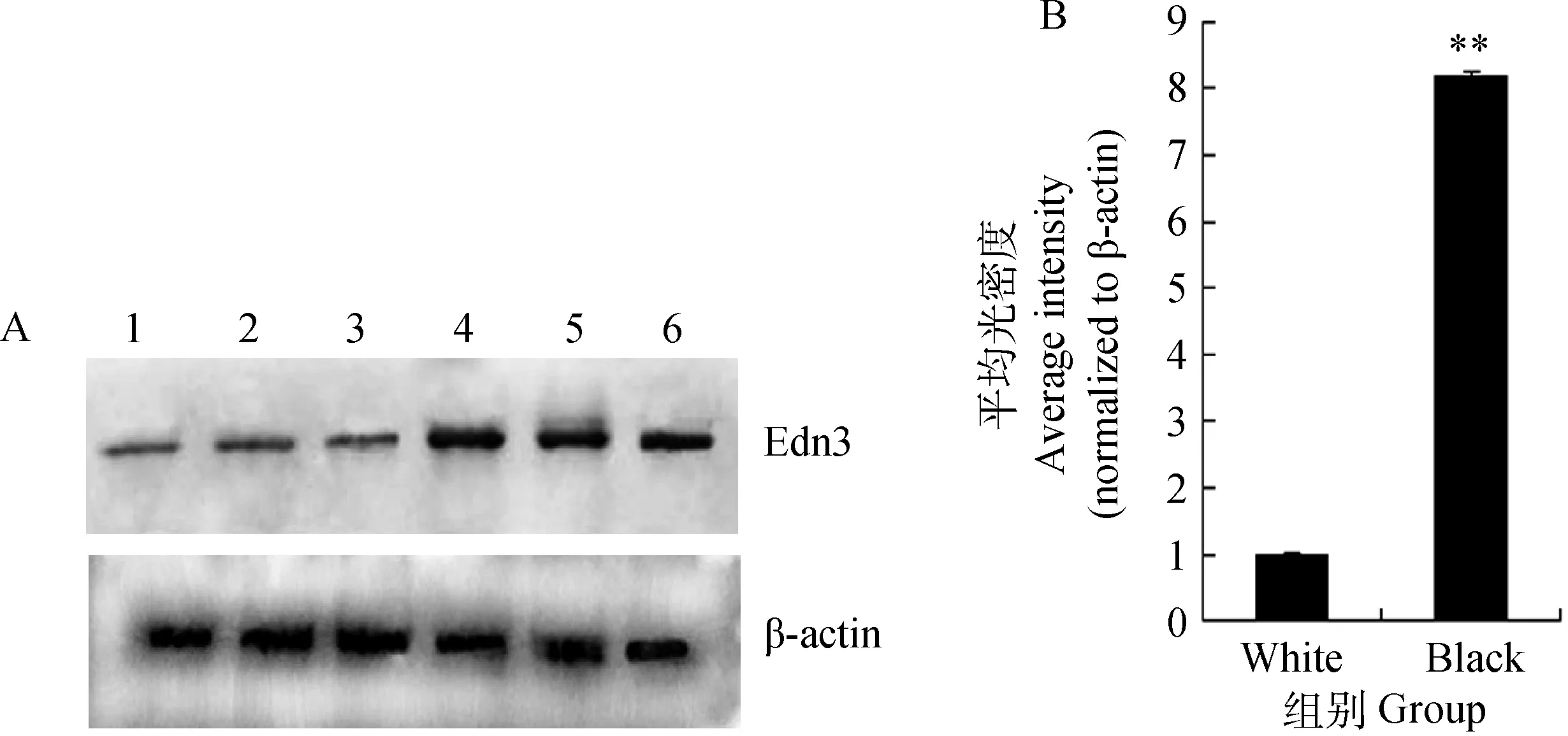
A.1~3、4~6.白色和黑色綿羊皮膚總蛋白中的陽性印跡信號;B.印跡條帶的平均光密度分析。內參為β-actin,數據用 “平均值±標準誤”表示A.The bands were the positively blotting signal with the rabbit Edn3 polyclonal antibody and goat anti-rabbit IgG conjugated HRP as the second antibody.1-3 from sheep skins with white hair color and 4-6 from sheep skins with black hair color;B.The average intensity of blotting band was analyzed.The level of protein was normalized relative to β-actin.Bars in each panel represent the mean ± standard error圖3 Edn3蛋白在綿羊皮膚中的表達Fig.3 Edn3 protein expression in sheep skin
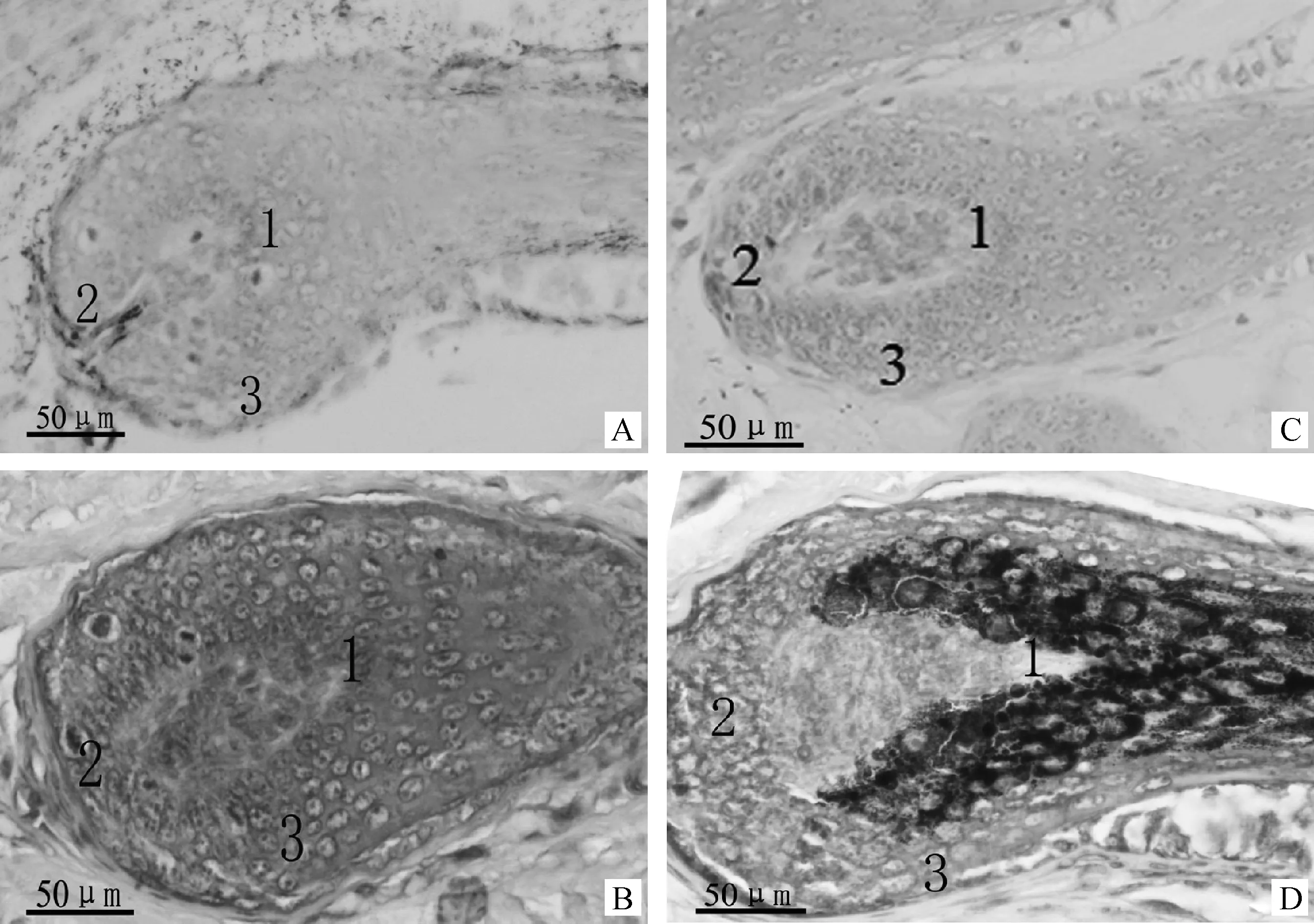
A和B.Edn3在白色綿羊皮膚中的定位;C和D.Edn3在黑色綿羊皮膚中的定位;A和C.陰性對照;B和D.試驗組。1.毛乳頭上方;2.毛球;3.外根鞘A,B.Edn3 localization in sheep skin with white hair color;C,D.Edn3 localization in sheep skin with black hair color.A,C.Negative control;B,D.Experiment groups;1.Upper hair dermal papilla;2.Hair bulb;3.Outer root sheath圖4 Edn3蛋白在綿羊皮膚中的定位40×Fig.4 Localization of Edn3 protein in sheep skin 40×
3 討 論
哺乳動物被毛的顏色主要是由沉著在皮膚內黑色素的量及其種類決定的,黑色素主要包括真黑色素(Eumelanin)和褐黑色素(Pheomelanin)兩類,真黑色素和褐黑色素的相對數量決定了動物皮膚與被毛顏色[10]。黑色素細胞是哺乳動物毛色形成的基礎,在胚胎發育過程中黑色素細胞由神經嵴細胞分化并定向遷移到全身各個組織,其定向分化、遷移與MITF、FGF-2、內皮素以及諸多因子有關[11]。
內皮素是參與黑色素細胞生物學過程的主要旁分泌因子之一,在其早期發育過程中起著重要作用[12]。本研究發現,在白色綿羊皮膚毛囊的毛乳頭上方、毛球底部及外根鞘和黑色綿羊皮膚毛囊的毛球底部及外根鞘均存在Edn3陽性免疫反應物。而毛球是向毛干提供黑色素的部位,其含有大量黑色素細胞,胞質中含有黑色素顆粒[13]。在哺乳動物黑色素細胞中,G蛋白偶聯內皮素受體B(Ednrb) 途徑功能的丟失或突變都會導致胚胎中黑色素細胞前體的數量減少,從而引起毛色的改變[14]。Edn3是Ednrb的配體[15]。說明長期的Edn3通過激活Ednrb2可以促進黑色素細胞的分化。另有資料報道,Ednrb與MITF具有一定的機制關聯性[16],MITF 可結合到與黑色素合成有主要關系的TYRP2 啟動子區域來控制它們的轉錄,TYRP2可以直接參與黑色素生成調控過程,調節黑色素細胞的發育、生存和功能。證明Edn3結合Wnt3a 和 Kit-配體(Kitl、SLF和SCF)誘導人胚胎干細胞表達生黑素標記物,Mitf 和Sox10,產生黑色素小體,從而產生黑色素[17]。因此,筆者認為Edn3的表達差異使Ednrb和KIT差異性調控MITF的表達,進而調控黑色素合成路徑上TYRP2和TYR的表達,導致黑色綿羊皮膚中色素含量升高。本試驗結果也發現黑色綿羊皮膚中Edn3基因的表達水平顯著高于白色綿羊,可能支持Edn3與毛色相關的結論。
在體內,缺失Ednrb或Kit信號肽都會引起部分成黑色素細胞的丟失,Edn3與Kit1共同作用可以促進黑色素細胞的增殖、分化和存活。只有在Edn3和Kit1同時存在的條件下,才會引起成黑素細胞數量的顯著增加和產生具有功能完全的黑色素細胞[12]。KIT的激活作用可以快速引起MAPK介導的MITF磷酸化,與激活因子家族相互作用進而調控MITF的轉錄活性,從而調控黑色素沉著。但Edn3蛋白是否在毛囊的黑色素細胞中通過上調KIT和Ednrb表達,促使KIT和Ednrb與MITF作用,上調毛囊黑色素細胞中MITF蛋白的表達,參與綿羊毛色的形成,有待于進一步研究。
4 結 論
Edn3定位于綿羊皮膚毛囊中黑色素細胞分布的部位,且在不同毛色的綿羊皮膚中存在差異性表達,結果說明Edn3與綿羊毛色形成過程具有一定的相關性。
[1] AMY S,LIDIA K.Roles of endothelin signaling in melanocyte development and melanoma[J].PigmentCellMelanomaRes,2010,23(2):160-170.
[2] REID K,TURNLEY A M,MAXWELL G D,et al.Multiple roles for endothelin in melanocyte development:regulation of progenitor number and stimulation of differentiation[J].Development,1996,122(12):3911-3919.
[3] 耿建軍,白俊明,范瑞文,等.內皮素-3對羊駝黑色素細胞特征及細胞內毛色基因表達的影響[J].畜牧獸醫學報,2013,44(7):1070-1077. GENG J J,BAI J M,FAN R W,et al.The effects of endothelin-3 on the melanocyte characteristic and expression of hair color genes in melanocytes from alpaca(Lamapacos)invitro[J].ActaVeterinariaetZootechnicaSinica,2013,44(7):1070-1077.(in Chinese)
[4] KADONO S,MANAKA I,KAWASHIMA M,et al.The role of the epidermal endothelin cascade in the hyperpigmentation mechanism of lentigo senilis[J].JInvestDermatol,2001,116(4):571-577.
[5] MANAKA L,KADONO S,KAWASHIMA M,et al.The mechanism of hyperpigmentation in seborrhoeic keratosis involves the high expression of endothelin converting enzyme1 alpha and TNF alpha,which stimulate secretion of endothelin1[J].BrDermatol,2001,145:895-903.
[6] OKAZAKI M,YOSHIMURA K,UCHIDA G,et al.Epidermal hyperpigmentation in non-syndromic solitary cafe-au-lait macules may be associated with increased secretion of endothelin-1 by lesional keratinocytes[J].ScandJPlastReconstrSurgHandSurg,2005,39(4):213-217.
[7] LAHAV R,DUPIN E,LECOINE L,et al.Endothelin-3 selectively promotes survival and proliferation of neural crest-derived glial and melanocytic precursorsinvitro[J].ProcNatlAcadSciUSA,1998,95:14214-14219.
[8] 張俊珍,范瑞文,楊姍姍,等.羊駝皮膚中可溶性鳥苷酸環化酶的表達差異[J].畜牧獸醫學報,2013,44(7):1057-1062. ZHANG J Z,FAN R W,YANG S S,et al.The different expression of soluble guanylate cyclase in alpaca skin[J].ActaVeterinariaetZootechnicaSinica,2013,44(7):1057-1062.(in Chinese)
[9] 張丹麗,田 雪,范瑞文,等.APC在羊駝皮膚組織中的表達和定位分析[J].畜牧獸醫學報,2014,45(2):327-332. ZHANG D L,TIAN X,FAN R W,et al.Expression and location analysis of APC in alpaca skin[J].ActaVeterinariaetZootechnicaSinica,2014,45(2):327-332.(in Chinese)
[10] SIMON J D,PELES D N.The red and the black[J].AccChemRes,2010,43(11):1452-1460.
[11] 耿建軍,穆曉麗,孫樂天,等.內皮素受體B在不同毛色羊駝皮膚中的表達與定位[J].畜牧獸醫學報,2010,41(11):1478-1484. GENG J J,MU X L,SUN L T,et al.Expression and immunolocalization of endothelin receptor B in alpaca skin of different colors[J].ActaVeterinariaetZootechnicaSinica,2010,41(11):1478-1484.(in Chinese)
[12] SALDANA-CABOVERDE A,KOS L.Roles of endothelin signaling in melanocyte development and melanoma[J].PigmentCellMelanomaRes,2010,23(2):160-170.
[13] SLOMINSKI A,WORTSMAN J,PLONKA P M,et al.Hair follicle pigmentation[J].JInvestDermatol,2005,124(1):13-21.
[14] 張 暉,戈婷婷,彭沙沙,等.泰和烏骨雞皮膚黑色素與多泡脂肪細胞的超微結構研究[J].畜牧獸醫學報,2014,45(5):815-820. ZHANG H,GE T T,PENG S S,et al.Ultrastructural investigation on melanin and multilocular adipocyte in skin of taihe black-bone fowl[J].ActaVeterinariaetZootechnicaSinica,2014,45(5):815-820.(in Chinese)
[15] LAHAV R.Endothelin receptor B is required for the expansion of melanocyte precursors and malignant melanoma[J].IntJDevBiol,2005,49(2-3):173-180.
[16] KAYO S,EMI K N,EIJIRO A,et al.Epistatic connections between microphthalmiaassociated transcription factor and endothelin signaling in Waardenburg syndrome and other pigmentary disorders[J].FASEBJ,2008,22:1155-1168.
[17] FANG D,LEISHEARE K,NGUYEN T K,et al.Defining the conditions for the generation of melanocytes from human embryonic stem cells[J].StemCells,2006,24(7):1668-1677.
(編輯 程金華)
The Different Expression of Endothelin 3 in Sheep Skins
YANG Shan-shan1#,BAI Jun-ming1#,FAN Rui-wen1,GENG Jian-jun1,JIAO Ding-xing2,ZHOU Ying1,DONG Chang-sheng1*
(1.CollegeofAnimalScienceandVeterinaryMedicine,ShanxiAgriculturalUniversity,Taigu030801,China;2.QingheCountyAgriculturalBureauofHebeiProvince,Qinghe054000,China)
To investigate the function of endothelin 3(Edn3) in sheep skins and the regulation of hair color formation,the differential expression of Edn3 in skins of black versus white sheep was examined.Quantitative real-time PCR(qRT-PCR),Western blotting and immunohistochemistry methods were performed.The results showed that the quantity expression of Edn3 mRNA in black sheep was 2.89 times than in white sheep(P<0.01);the average protein expression of Edn3 in black sheep skin was higher than in white sheep skin on the optical density(P<0.01).The results of immunohistochemistry revealed that Edn3 was localized in the hair dermal papilla,lower of hair bulb and outer root sheath in hair follicles of sheep with white hair color,but was localized in lower of hair bulb and outer root sheath in hair follicles of sheep with black hair color.The differential expression and localization of Edn3 in skin of white versus black sheep suggests a potential role in hair color regulation.
endothelin3(Edn3);skin;sheep
10.11843/j.issn.0366-6964.2015.11.026
2015-01-08
國家“863”計劃(2013AA102506);公益性行業(農業)科研專項(201303119);農業部“948”項目(2011-Z33)
楊姍姍(1987-),女,河北石家莊人,博士生,主要從事羊駝毛色研究,E-mail:shanshan0321@163.com;白俊明(1984-),男,山西忻州人,碩士,主要從事羊駝毛色研究,E-mail:baibai84aa@163.com。楊姍姍與白俊明為并列第一作者
*通信作者:董常生,教授,主要從事生物工程研究,E-mail:cs-dong@sxau.edu.cn
S852.1
A
0366-6964(2015)11-2111-06

