牛腸道病毒2型單克隆抗體的制備及其應用研究
郭金玉,張鶴曉,吳 丹,高志強,張 冉,張樂萃*
(1.青島農業大學動物科技學院,青島 266109;2.北京出入境檢驗檢疫局,北京 100026;3.北京森康生物技術開發有限公司,北京 101400)
牛腸道病毒2型(bovine enterovirus type 2, BEV-2)是小RNA病毒科、腸道病毒屬成員[1],通常引起輕度腹瀉或隱性感染,在一定條件下可引發顯著癥狀,影響奶牛的生產性能。BEV-2基因組為單股正鏈RNA,長為7430bp,僅有一個開放閱讀框(ORF),即RNA 5′末端只含有一個翻譯起始點,編碼2166個氨基酸,經降解產生4種結構蛋白(VP1~VP4)和7種非結構蛋白(2A、2B、2C、3A、3B、3C和3D)[2]。其中 VP1蛋白能誘導機體產生特異性的中和抗體。
單克隆抗體(McAb)是由一個淋巴細胞分泌的、針對同一抗原決定簇的抗體,它以高度特異性和敏感性在蛋白質的結構與功能研究中發揮著重要作用[3]。
作者利用表達的牛腸道病毒2型VP1+蛋白(包含整個VP1蛋白基因片段)為免疫原接種小鼠,通過篩選,制備了抗BEV-2的單克隆抗體,建立了BEV-2雙抗體夾心ELISA檢測方法,為ELISA試劑盒的開發奠定基礎。
1 材料與方法
1.1 材料
BALB/c小鼠購于北京維通利華實驗動物技術有限公司;新澤西型水泡性口炎病毒(VSV-NJ)由美國NVSL提供;牛腸道病毒2型(BEV-2病毒,毒株BJ001)、牛病毒性腹瀉病毒(BVDV)和牛白血病病毒(BLV)、SP2/0骨髓瘤細胞均由北京檢驗檢疫局檢驗檢疫技術中心提供;PEG4000購自北京天來生物醫學科技有限公司;HAT、HT培養基添加劑、Mouse Monoclonal Antibody Isotyping Reagents亞型試劑盒購自SIGMA公司;牛腸道病毒2型陽性血清是用病毒免疫陰性牛制備(中和效價為1∶128);新澤西型水泡性口炎病毒截短的G蛋白(VSV-NJ-G)、羊抗牛IgG-HRP、弗氏不完全佐劑(FIA)、弗氏完全佐劑(FCA)均由動物疫病診斷聯合實驗室制備。
1.2 免疫原的制備
將原核表達的重組蛋白質BEV-2VP1+純化復性后分裝,于-80℃保存,備用。
1.3 小鼠免疫程序及血清抗體效價的測定
選取6~8周齡健康雌性BALB/c小鼠4只,剪耳做標記。制定小鼠免疫程序,首免用抗原加FCA(1∶1)充分乳化,頸背部皮下注射,抗原含量50 μg;14d后進行二免,用抗原加FIA(1∶1)充分乳化,頸背部皮下注射,抗原含量50μg;間隔2周進行三免(同二免)。2周后,斷尾采血并分離血清,用間接ELISA檢測小鼠血清效價,血清效價在1/104以上即可融合,融合前3d小鼠腹腔注射加強免疫。
1.4 細胞融合及培養
取免疫小鼠的脾細胞與SP2/0細胞按5∶1的比例用PEG4000進行融合,用HAT選擇性培養基輕輕懸浮后混勻,鋪于準備好的飼養細胞上[4]。置于37℃、5%CO2條件下培養。
1.5 陽性雜交瘤細胞的篩選及亞克隆
用重組蛋白質BEV-2VP1+包被酶標板后,再用已經建立好的檢測BEV-2抗體的間接ELISA方法[5]篩選陽性雜交瘤細胞,待融合細胞覆蓋1/3孔底時,檢測細胞培養上清,篩選出的陽性孔再用BEV-2進行2次篩選,最終選出分泌BEV-2抗體的陽性細胞孔。
將篩選為陽性的雜交瘤細胞原始孔采用有限稀釋法進行亞克隆。克隆3~5輪,直至細胞100%檢測陽性,將其擴大培養并凍存。
1.6 腹水的制備
選取4只12周齡的小鼠,預先腹腔注射滅菌石蠟油500μL·只-1,7d后,注射密度約2×106mL-1的陽性雜交瘤細胞。待小鼠腹部膨脹,收集腹水,8000r·min-1離心5min,置于-20℃保存。
1.7 單抗的間接ELISA效價
將收集的雜交瘤細胞上清和小鼠腹水以1/10的比例進行倍比稀釋,并設立陰性對照,結果以陽性/陰性OD450nm(P/N)>2.0時的最高稀釋度確定為單克隆抗體的效價。
1.8 雜交瘤細胞分泌抗體的穩定性和親和力測定
將雜交瘤細胞反復凍存復蘇3次,并連續傳代培養至第6代,檢測凍存前、復蘇后及傳至第6代的雜交瘤細胞分泌McAb的穩定性。
利用亞型試劑盒測定兩株單抗的亞型,參考親和力測定文獻[6],測定其親和力。
1.9 病毒與腹水反應
將粗純的BEV-2病毒在56℃滅活30min。用pH 9.6碳酸鹽緩沖液將病毒(BEV-2)1∶100倍稀釋,同時設BVDV(1∶100倍稀釋)做陰性對照,包被至反應板,經封閉、洗滌后,加入1∶(103~107)稀釋的腹水,用羊抗鼠IgG-HRP檢測反應結果。
1.10 單抗特異性
將滅活后的病毒(BEV-2、VSV、BVDV 和BLV)用碳酸鹽緩沖液1∶100倍稀釋,分別包被酶標板,收集腹水進行ELISA測定。
1.11 免疫印跡分析
取純化的重組蛋白質VSV-NJ-G、BEV-2 VP1+進行SDS-PAGE電泳分離,轉印至PVDF,封閉后加入一抗(腹水1∶100倍稀釋)4℃孵育過夜,洗滌后加羊抗鼠IgG-HRP(1∶8000倍稀釋),最后洗滌3次,避光顯色1min,與底片一起置于暗盒中,曝光1~5min。
1.12 雙抗體夾心ELISA方法的建立
1.12.1 單抗和酶標抗體稀釋度的確定 將制備的單克隆抗體做1∶1000、1∶2000、1∶4000、1∶8000稀釋后加入酶標板,放置37℃孵育1h,4℃包被過夜;封閉后加入1∶100稀釋病毒抗原37℃孵育1h;再加入1∶100稀釋的BEV-2陽性血清;將羊抗牛IgG-HRP做1∶500、1∶1000、1∶2000稀釋。測定OD450nm值,選擇陽性值接近1.0時對應的單抗和酶標抗體稀釋度。
1.12.2 封閉液的確定 單抗最佳包被條件確定后,分別用1%明膠的PBST、1%卵清蛋白的PBST進行封閉,比較封閉效果。
1.12.3 酶標抗體和底物顯色時間的優化 將羊抗牛IgG-HRP按最佳稀釋度稀釋,分別作用0.5、1、2h;加入底物后分別在黑暗中顯色10、15、30 min,測其OD450nm。
1.12.4 臨界值的確定 用優化的雙抗體夾心ELISA方法檢測40份病毒分離均為陰性的正常牛腸道拭子,采集的腸道拭子樣品加入到1mL PBS緩沖液中,充分混勻,離心,取上清。計算臨界值。
1.12.5 雙抗體夾心ELISA特異性試驗 用優化的雙抗體夾心ELISA方法,檢測BVDV、IBRV、BLV、BEV-2,驗證雙抗體夾心ELISA方法的特異性。
1.12.6 雙抗體夾心ELISA敏感性試驗 采集30份牛腸道拭子,用細胞培養法分離病毒并與雙抗體夾心ELISA方法比較。
用BEV-2毒株感染MDBK細胞,進行3次病毒細胞半數感染量(TCID50)測定,以平均值作為該病毒的含量[7],按病毒含量將病毒稀釋為0.01、0.1、1、10、100、1000TCID50·0.1mL-1,用雙抗體夾心ELISA確定BEV-2的最小檢測量,與熒光定量RT-PCR檢測結果比較。
1.12.7 雙抗體夾心ELISA重復性試驗 根據測定的病毒TCID50,將BEV-2細胞培養物做十倍比稀釋:10-1、10-2、10-3、10-4,并用正常細胞培養液做陰性對照。在同一酶標板重復三次,計算板內變異系數(CV);在三個批次的酶標板(板1、板2、板3)重復,計算板間變異系數(CV)。
1.12.8 臨床樣品的檢測 采集牛腸道拭子、口腔拭子及糞便分泌物共236份臨床樣品,用雙抗體夾心ELISA方法檢測。從中選取25份陽性、20份陰性樣品用病毒分離鑒定方法復檢,并與雙抗體夾心ELISA方法的結果比較。
2 結 果
2.1 小鼠血清抗體效價的測定
結果顯示(表1),BALB/c小鼠的血清抗體效價均在1/104以上,4#號免疫效果最好,用于細胞融合。
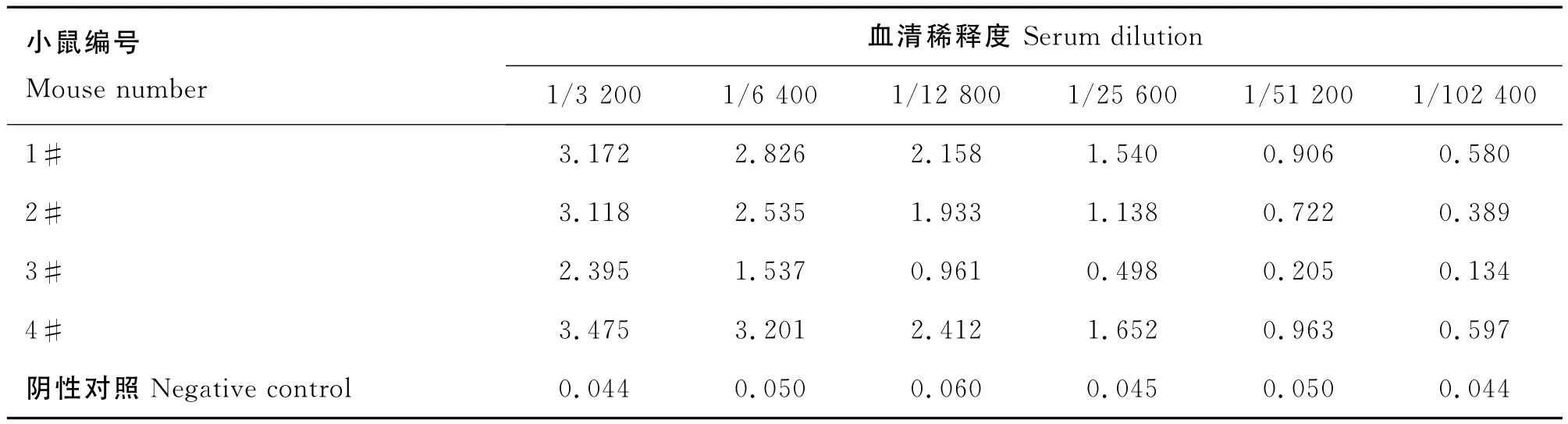
表1 小鼠血清抗體效價檢測Table 1 The antibodies level of serums of mices
2.2 陽性雜交瘤細胞株的篩選與建立
通過對雜交瘤細胞培養上清檢測,最終獲得2株分泌抗BEV-2VP1+蛋白 McAb的雜交瘤細胞株:1G1、5G6。經3次有限稀釋法亞克隆后,雜交瘤細胞陽性率達100%。
2.3 單抗的間接ELISA效價
經檢測,1G1、5G6兩株雜交瘤細胞上清產生的抗體效價為1/104、1/106。2株單抗的小鼠腹水效價比雜交瘤細胞上清效價高,1G1株單抗的效價為1/105,5G6株單抗的效價可達1/107(表2)。

表2 間接ELISA中2株單抗細胞上清及腹水效價Table 2 Supernatant and ascitic fluid titers of two McAbs in indirect ELISA
2.4 雜交瘤細胞分泌McAb的穩定性和親和力測定
兩株雜交瘤細胞上清在凍存前、復蘇后、傳代后的OD450nm無明顯變化,能穩定地分泌抗BEV-2的McAb(圖1)。
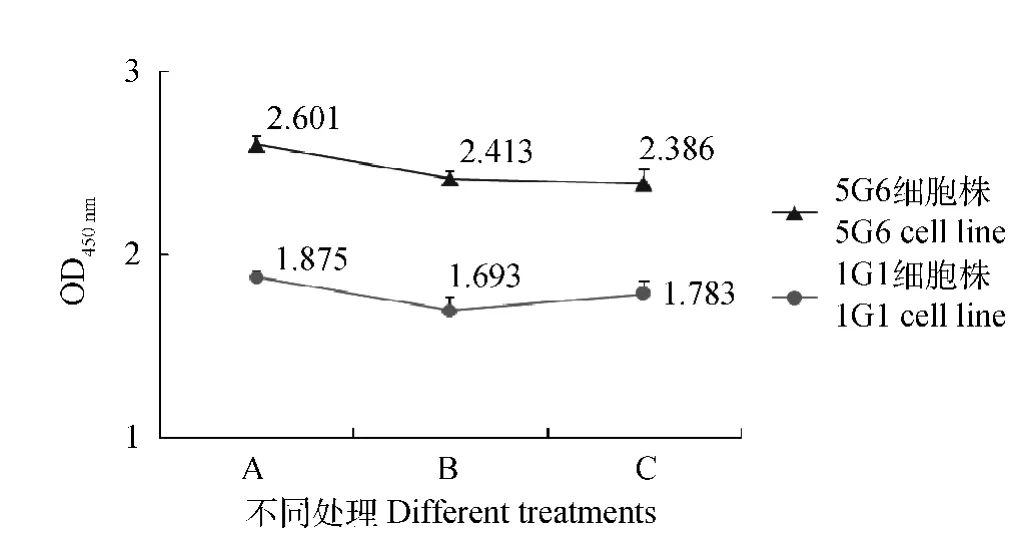
圖1 雜交瘤細胞分泌抗體穩定性測定Fig.1 The ability to secretory antibody of the hybridoma cell
利用亞型試劑盒測定1G1、5G6的亞型分別為IgG1及IgG2b,根據親和力測定文獻測定其親和力分別為6.5×109、2.0×1010,兩者都屬于高親和力抗體。選擇5G6做進一步試驗。
2.5 病毒與腹水5G6反應
檢測結果(表3)顯示,BEV-2與腹水5G6反應良好,效價可達1/105。
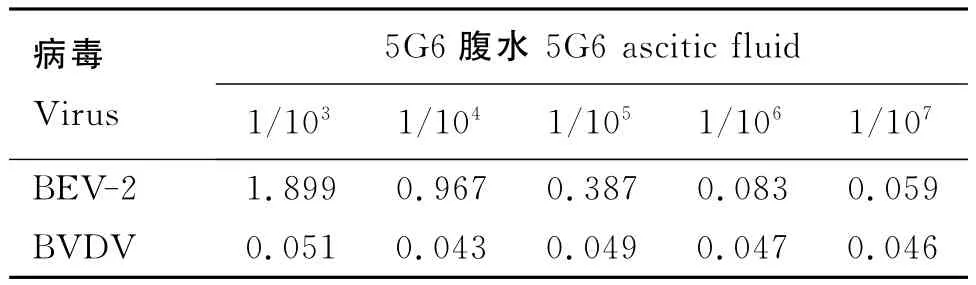
表3 病毒與腹水反應結果Table 3 Results of virus and ascitic fluid titers
2.6 單抗5G6的特異性
特異性試驗結果顯示(結果未展示),5G6細胞株小鼠腹水僅與BEV-2反應呈陽性,與其他病毒反應為陰性,具有良好的特異性。
2.7 單抗5G6的免疫印跡分析
Western blot鑒定結果表明,5G6株單克隆抗體能與大腸桿菌表達的BEV-2VP1+重組蛋白質發生特異性反應(圖2)。
2.8 單抗5G6雙抗體夾心ELISA方法建立
2.8.1 包被單抗濃度和酶標抗體濃度的確定經測定,確定單抗5G6最佳稀釋度為1∶4000,羊抗牛IgG-HRP稀釋度為1∶1000(表4)。
2.8.2 封閉液的確定 試驗結果證明,用1%卵清蛋白的PBST封閉時P/N最大,所以最終選擇1%卵清蛋白的PBST作為封閉液。

圖2 單克隆抗體的免疫印跡分析Fig.2 Analysis of monoclonal antibodies by Western blotting
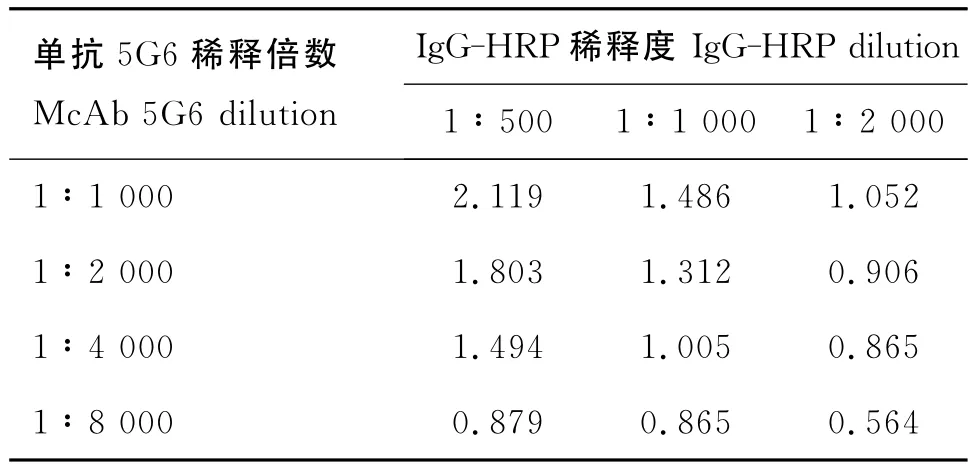
表4 5G6包被濃度和酶標抗體稀釋度的確定Table 4 Confirmation of 5G6coating concentration and IgGHRP using concentration
2.8.3 酶標抗體和底物顯色時間的優化 酶標抗體和底物反應時間的選擇試驗結果顯示,羊抗牛IgG-HRP反應時間為0.5h時;底物作用時間為15min。
2.8.4 臨界值的確定 通過計算,得出40份牛腸道拭子的平均值為0.1496,標準差為0.0541。因此,確定該方法的臨界值為0.31。
2.8.5 雙抗體夾心ELISA特異性試驗 用雙抗體夾心ELISA方法檢測BVDV、IBRV、BLV均無交叉反應,顯示了雙抗體夾心ELISA方法特異性較好。
2.8.6 雙抗體夾心ELISA敏感性試驗 通過表5結果計算,雙抗體夾心ELISA方法與病毒分離鑒定方法的陽性符合率為90%,陰性符合率為100%,總符合率為93.3%。
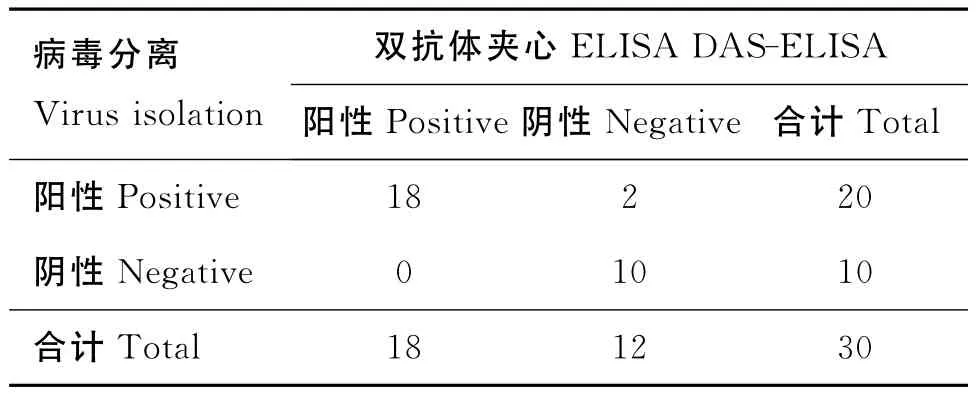
表5 病毒分離與雙抗體夾心ELISA比較試驗結果Table 5 Results of viral isolation compared with DAS-ELISA
經3次BEV-2病毒含量測定,確定其平均值為10-6.48TCID50·0.1mL-1。雙抗體夾心ELISA檢測結果表明:當BEV-2含量低于10TCID50·0.1mL-1的時,檢測結果陰性;當含量≥100TCID50·0.1 mL-1時為陽性。該方法對BEV-2的檢測極限為100TCID50·0.1mL-1。而熒光定量RT-PCR檢測方法的檢測極限為0.1TCID50·0.1mL-1,比雙抗體夾心ELISA的敏感性高(表6)。
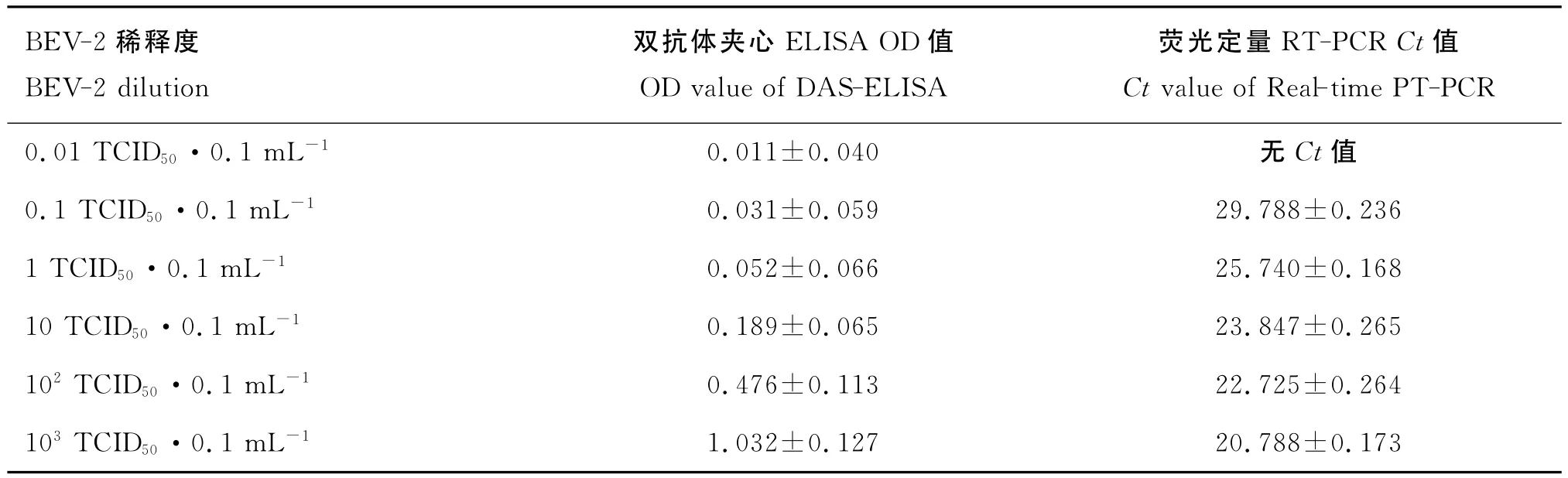
表6 敏感性試驗結果(x-±s)Table 6 Results of the sensitivity tests(x-±s)
2.8.7 雙抗體夾心ELISA重復性試驗 重復性試驗結果顯示,檢測的BEV-2細胞培養物變異系數(CV)均小于3%,表明該方法在板內、板間有良好的重復性。
2.8.8 臨床樣品的檢測 雙抗體夾心ELISA方法檢測236份臨床樣品,結果58份為BEV-2陽性,陽性率為24.6%。從中選取的45份樣品(25份陽性、20份陰性)進行細胞培養分離病毒(表7),兩者結果的總符合率為91.1%。
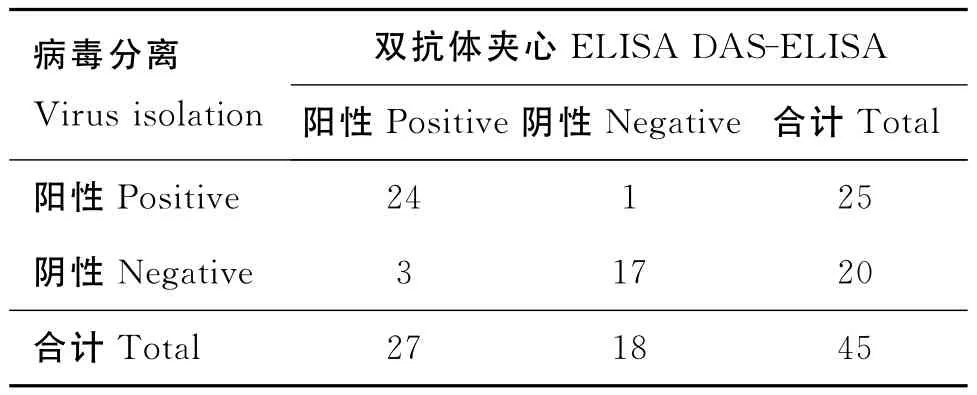
表7 病毒分離與雙抗體夾心ELISA符合率試驗結果Table 7 Results of the coincidence test between virus isolation and the DAS-ELISA
3 討 論
本研究以純化的重組蛋白質BEV-2VP1+作為抗原,對BALB/c小鼠進行常規免疫,通過2次細胞融合,接種768孔,用間接ELISA方法篩選后進行了3次亞克隆,最終獲得2株能夠穩定分泌抗BEV-2McAb的雜交瘤細胞株。經檢測,5G6株單克隆抗體具有良好的特異性。在國內,本試驗首次制備了BEV-2的單克隆抗體。用制備的5G6株單克隆抗體包被酶標板,通過一系列的優化,建立了BEV-2雙抗體夾心ELISA檢測方法。
制備單克隆抗體的關鍵環節是細胞融合。骨髓瘤細胞形態不飽滿、折光性較差,容易導致融合失敗,細胞死亡。因此,細胞生長狀態對融合起決定性作用,一定要保證骨髓瘤細胞的活力。除此之外,脾細胞的生長狀態、融合比例及方法、試驗過程中的操作都會影響細胞融合及雜交瘤細胞生長狀況。
在國外牛群中,BEV陽性率高達17.6%~80%。BEV通過糞便或經口傳播,傳染源主要為病牛和無癥狀的病毒攜帶者[8]。吳丹等也曾報道過北京部分地區牛群存在牛腸道病毒感染,她建立的TaqMan熒光定量RT-PCR檢測方法的敏感性為0.1TCID50·0.1mL-1。2014年侯佩莉等[9]報道山東也存在牛腸道病毒感染,并建立了RT-PCR檢測方法,其檢出敏感度也是10-1TCID50·0.1 mL-1。本試驗建立的雙抗體夾心ELISA方法敏感性沒有熒光 RT-PCR 高,為100TCID50·0.1 mL-1,但是該方法與BVDV、IBRV、BLV均無交叉反應,具有良好的特異性,而且雙抗體夾心ELISA方法檢測的是抗原,無需病毒RNA提取、反轉錄、擴增及電泳檢測等過程,使用常規儀器即可操作。與其他檢測方法相比操作簡便、成本低。
雙抗體夾心ELISA方法和病毒分離的符合率試驗顯示兩種方法符合率很高,總符合率達91.1%。病毒分離作為一種傳統的金標檢測方法,建立病原檢測方法時都與其進行比較。本研究建立的雙抗體夾心ELISA方法雖然存在一定的假陰性、假陽性,但較病毒分離相比,更適用于大批量樣品的初篩。這種方便快捷的檢測方法是生產實際中迫切需要的,適用于臨床檢測。
4 結 論
本研究在國內首次制備了2株抗BEV-2的單克隆抗體,首次建立了檢測BEV-2抗原的ELISA方法。該方法特異性強、敏感性高、重復性好,適用于大批量樣品的初篩,為我國出入境BEV的檢驗檢疫和國內外牛腸道病毒ELISA試劑盒的開發奠定了良好的基礎。
(References):
[1]SMYTH M S,MARTIN J H.Structural,biochemical and electrostatic basis of serotype specificity in bovine enteroviruses[J].Arch Virol,2001,146(2):347-355.
[2]MCCARTHY F M,SMITH G A,MATTICK J S.Molecular characterisation of Australian bovine enteroviruses[J].Vet Microbiol,1999,68(1-2):71-81.
[3]侯 強,彭伍平,孫 元,等.豬瘟病毒E2蛋白主要抗原區編碼基因的原核表達及其單克隆抗體的制備[J].中國獸醫科學,2008,38(1):1-5.HOU Q,PENG W P,SUN Y,et al.Expression of the truncated E2protein-encoding gene of classical swine fever virus in Escherichia coli and preparation of a monoclonal antibody against E2protein[J].Chinese Veterinary Science,2008,38(1):1-5.(in Chinese)
[4]K?HLER G,MILSTEIN C.Continuous cultures of fused cells secreting antibody of predefined specificity[J].Nature,1975,256(5517):495-497.
[5]郭金玉,高志強,張鶴曉,等.牛腸道病毒2型VP1+表達和間接ELISA方法的建立與應用[J].中國獸醫雜志,2014,50(11):40-43.GUO J Y,GAO Z Q,ZHANG H X,et al.Development and application of indirect ELISA for the detection of antibodies against bovine enterovirus type 2 based on VP1+protein expression[J].Chinese Journal of Veterinary Medicine,2014,50(11):40-43.(in Chinese)
[6]張小兵,吳 萌,閆靜輝.ELISA法快速測定 McAb培養上清中鼠源IgG質量濃度[J].河北省科學院學報,2008,25(2):49-52,76.ZHANG X B,WU M,YAN J H.Rapid measurement of the mouse IgG concentration by a sandwich ELISA[J].Journal of the Hebei Academy of Sciences,2008,25(2):49-52,76.(in Chinese)
[7]吳 丹,吳 濤,張鶴曉,等.牛腸道病毒TaqMan熒光定量RT-PCR檢測方法的建立[J].中國預防獸醫學報,2012,34(11):903-906.WU D,WU T,ZHANG H X,et al.Establishment of real-time RT-PCR method for detection of bovine enterovirus[J].Chinese Journal of Preventive Veteri-nary Medicine,2014,34(11):903-906.(in Chinese)
[8]BLAS-MACHADO U,SALIKI J T,SáNCHEZ S,et al.Pathogenesis of a bovine enterovirus-1isolate in experimentally infected calves[J].Vet Pathol,2011,48(6):1075-1084.
[9]侯佩莉,程洪兵,劉 曉,等.牛腸道病毒RT-PCR檢測方法的建立及初步應用[J].山東農業科學,2014,46(2):13-16.HOU P L,CHENG H B,LIU X,et al.Establishment and application of RT-PCR for detection of bovine enterovirus[J].Shandong Agricultural Sciences,2014,46(2):13-16.(in Chinese)

