胰腺癌微循環CT灌注成像分析
陜西省人民醫院CT室(西安 710068)
陳小龍 寇明清 馮永恒△ 黃明剛 楊 曉 劉 軍 高 芳 徐大萌
胰腺癌微循環CT灌注成像分析
陜西省人民醫院CT室(西安 710068)
陳小龍 寇明清 馮永恒△黃明剛 楊 曉 劉 軍 高 芳 徐大萌
目的:通過CT灌注成像對比分析胰腺癌及正常胰腺微循環的差異,旨在評價灌注成像診斷胰腺癌的價值。方法:利用320排動態容積CT對46例研究對象進行灌注成像,其中對照組(非胰腺疾病的患者20例及志愿者6例)26例,試驗組20例,灌注分析利用最大斜率法。分別測量胰腺癌組織、正常胰腺組織的時間-密度曲線(TDC)、血流灌注圖、組織血流量(AF),并記錄每位研究對象計算機自動生成的劑量長度乘積(DLP.e)。結果:胰腺癌組織AF值(44.65±18.70)ml/(min·100ml)、正常胰腺組織(139.23±17.77)ml/(min·100 ml)、殘留正常胰腺組織(156.76±33.39)ml/(min·100 ml)三組比較差異有統計學意義;胰腺癌組織的AF值低于對照組及殘留正常胰腺組織,比較有統計學意義,而對照組與殘留正常胰腺組織AF值差異無統計學意義;灌注掃描過程中研究對象所接受的X線劑量為15.48 mSv。結論:320排動態容積CT灌注成像輻射劑量低,可反映胰腺癌的血流灌注特征,具有重要的臨床參考價值。
胰腺癌(Pancreatic cancer)惡性程度高,起病隱匿,手術切除率低,預后很差,因此早期診斷、準確分期和手術可切除評估已成為胰腺癌影像診斷的主要目的。微血管的生成是腫瘤發生、發展和轉移的基礎,CT灌注成像在活體內可間接、無創地反映瘤體血管生成情況,從而明確其生物學特性,有助于胰腺癌的早期診斷及鑒別診斷。本研究應用320排動態容積CT對20例胰腺癌組織進行全器官灌注成像,并與正常胰腺灌注進行對比研究,旨在為臨床應用提供依據。
資料與方法
1 一般資料 2013年01月至2014年10月行上腹部灌注及增強的患者及健康志愿者46例作為研究對象,其中對照組26例,包含非胰腺疾病患者20例及健康志愿者6例,其中男性19例,女性7例,年齡23~76歲。試驗組20例,其中男性8例,女性12例,年齡55~85歲。所有病例經手術病理或臨床證實,其中胰頭癌15 例,頭頸部癌1例,體、胰尾癌4例。每次灌注掃描后等待約15min,行常規上腹部三期強化掃描。本研究經醫院倫理委員會批準,知情同意。
2 儀器與方法 檢查前4h禁食,檢查前于右側前臂留置淺靜脈留置針(飛瑪,20GA×1.16IN,Y型魯爾接頭自帶肝素帽及端帽)。取仰臥位,并用腹帶捆綁病人腹部,以減少腹部運動。采用德國生產的Ulrich Missouri(XD2001)全自動雙筒高壓注射器,以6~8ml/s的速度依次高壓團注碘普羅胺(370mg×100ml)30~40ml及生理鹽水20ml。應用東芝320排容積CT實施胰腺全器官灌注掃描。掃描參數:管電壓100kV,管電流100mA,旋轉時間0.5s,整個灌注掃描時間共48s或53s,圖像重建層厚0.5mm,層間距0.5mm,掃描范圍為160mm,共獲得19個容積數據包,6080幅灌注圖像。
3 圖像處理 使用東芝320排CT工作站處理灌注數據,獲得組織時間-密度曲線(TDC)、血流灌注圖及組織血流量(Artery blood flow,AF)。使用軟件Body Registration配對時,選擇腹主動脈強化開始下降前一期中靶器官最大層面為目標時相(Target phase),進行空間配對,以減少呼吸運動造成的位移[1]。對照組胰腺采集胰頭、胰體、胰尾部三個部位的AF值,每個部位取三個感興趣區(ROI),取三者的均值作為此研究對象最終的AF值。試驗組ROI設置在胰腺癌病變最大層面及殘留正常胰腺區域,每個區域測量三次,取均值作為癌組織及殘留正常胰腺組織最終的AF值,注意避開壞死、鄰近血管、胰管和胰腺邊緣。計算每位研究對象所接受的有效放射劑量(Effective dose),按照計算機自動生成的劑量長度乘積(Dose-length product,DLP.e)乘以系數(k = 0.015)進行計算。
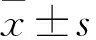
結 果
1 TDC分析 胰腺癌組織TDC呈平坦型,無明顯灌注峰;正常組及試驗組殘留正常胰腺組織TDC均呈速升速降,上升斜率較大,峰值較高;癌組織與正常組織TDC有明顯差別,正常組與試驗組殘留正常胰腺組織TDC一致。
2 不同組之間AF值的比較 結果見附表。三組之間AF值不全相等,兩兩比較胰腺癌組分別與對照組及自身殘留正常胰腺組織間有統計學意義(P<0.05),而對照組與自身殘留正常胰腺組織無統計學意義(P>0.05)。

附表 胰腺癌組織、對照組及自身殘留正常胰腺組織AF值比較 ml/(min·100ml)
注:*△、*▲之間比較P<0.001;△▲之間比較P>0.05
3 X線劑量 本研究灌注掃描過程中計算機自動生成的DPL.e是1031.7mGy·cm,所以每位研究對象所接受的X線劑量為15.48mSv。
討 論
隨著計算機科學及新技術的發展,影像學已經從單純的形態學診斷向功能、代謝以及更高層次的分子影像學發展,而功能成像中以灌注成像最為顯著[2]。CT灌注成像技術在胰腺癌診斷中的應用日趨增多,但由于既往CT探測器寬度不夠、單次掃描僅能覆蓋幾厘米的范圍,無法完成整個胰腺全器官的灌注成像。另外,掃描過程中的呼吸運動,掃描時間及所接受的射線劑量等問題也限制了胰腺灌注的應用。320排動態容積CT一次掃描寬度達到160mm,同時可獲得320層0.5mm層厚的完全同期的CT圖像,完成整個器官掃描最短僅需0.35s[3]。但本機型上市較短,用其對胰腺癌的灌注分析研究還比較少,因此本研究應用此設備成像及分析,旨在探討胰腺癌的微循環改變。
本設備采用最大斜率法對灌注數據進行分析,和去卷積法比較,該方法對圖像噪聲比不敏感,在保證能完成較為精確的對位的基礎上,可以不進行過多期相的掃描,大大降低了X線的劑量。然而這種分析方法對對比劑注射速度要求較高,根據BMI值大小,設定6~8ml/s的速度,并在5s內注射完對比劑,所以在操作過程中應避免高速注射對比劑外滲及血管爆裂的情況發生。本研究過程中,所有研究對象均能夠耐受檢查。本研究灌注掃描平均X線劑量為15.48mSv,與馬曉璇等[4]研究的X線劑量14mSv接近,并且研究灌注及平掃總的劑量(21.5~23.9mSv)與腹部三期強化劑量(24.7~33.0 mSv)接近或者更低。筆者統計14例平掃加增強掃描的患者及13例平掃加灌注掃描的患者所接受的劑量分別為(19.46±4.68 )及(21.09±0.91)mSv,經t檢查,無統計學意義。有報道[5-6]用螺旋掃描行上腹部CT灌注檢查時的輻射劑量是30.7及23.0mSv,因此,本研究采用的容積掃描,即便與常規腹部增強掃描相比,患者所接受的X線劑量并未增加,甚至減少,實現了低劑量掃描。
目前,此設備評價組織血液微循環僅有一個指標,即AF值,但AF值是最重要的評價微循環變化的指標之一,AF值指單位時間內流經一定量的組織、血管結構的血容量,相當于傳統意義上的血流灌注量,主要依據靶組織內造影劑TDC進行分析,反映靶組織的血流灌注特征,進而反映組織的微血管密度。本灌注軟件顯示AF值的單位是ml/(min·ml),而其它公司具有相似功能的灌注參數血流量(Blood flow,BF)的單位是ml/(min·g)[7],兩者之間的換算關系尚需進一步研究。
TDC反映對比劑在該器官中濃度的變化,從而間接反映了組織器官灌注量的變化。其上升斜率代表毛細血管內的血流速度,峰值表示毛細血管床的血容量,下降斜率表示血管內外對比劑的廓清速率。本研究顯示,胰腺癌組織與正常對照組TDC明顯不同。正常胰腺組TDC呈速升速降型,上升斜率較大,峰值較高,而胰腺癌TDC 呈平坦型,未見明顯的峰值,并且癌組織的AF值低于正常胰腺組織及癌旁殘留正常胰腺組織,與文獻[8-10]報道一致。本研究顯示正常胰腺組織和癌旁殘留正常胰腺組織AF值無統計學意義(P>0.05),因此提示癌組織與其殘留正常胰腺組織比較可以避免個體差異的影響,可更好的顯示二者間的血流灌注差異。而于興旭研究[11]胰腺癌組織的平均微血管密度及血管內皮細胞生長因子表達水平均明顯高于癌旁正常胰腺組織(無腫瘤浸潤的組織),因此認為腫瘤組織的灌注值與腫瘤內微血管的改變并不成正比。分析胰腺癌的灌注值取決于瘤體內腫瘤實質、纖維間質、殘存胰腺組織和壞死組織的微血管總和,而病理上腫瘤實質細胞散在分布于纖維間質和正常胰腺組織中,雖然腫瘤組織占有微血管的比例較正常組織高,但當腫瘤內混有大量少血供的纖維組織間隔時,腫瘤內微血管的絕對數量較正常胰腺相應的降低;另一方面腫瘤組織引起局部組織纖維化,小動脈內膜增生,導致血管硬化,加上腫瘤對血管的直接侵犯,引起血流減少,腫瘤壞死等因素,均可導致與正常胰腺相比癌組織AF值相對較低。
目前,東芝灌注軟件僅能提供單一的AF值,因此無法對血容量(BV)等其它灌注參數分析,也不能與其它公司的數據進行直接比較。本研究要求對比劑注射速率快,沒有考慮癌旁殘留正常胰腺組織所取ROI距離腫瘤的距離等都是本研究的不足之處;另外不同設備及灌注方法導致灌注參數差異很大,也阻礙了灌注成像的多中心標準化研究。這些都是今后進一步改進及研究發展的方向。
總之,320排動態容積CT能夠實現低劑量全胰腺灌注成像,并且能夠準確反映胰腺癌組織的血流動力學信息,為胰腺癌的診斷及鑒別診斷提供重要依據,因此預測其能夠為早期診斷提供有價值的信息,是常規CT增強掃描有益的補充手段。
[1] 馬曉璇,時惠平,于梅艷,等.640層容積CT低劑量胰腺全器官灌注成像技術探討[J].中華臨床醫師雜志,2012,6(4):1033-1036.
[2] Tsushima Y,Miyazaki M,Taketomi-Takahashi A,etal. Feasibility of measuring human pancreatic perfusion in vivo using imaging techniques[J]. Pancreas,2011,40(5): 747-752.
[3] 王琳琳,董振東.開啟動態容積時代:Aquilion one 320排CT[J].醫療衛生裝備,2010,31(1):13-16.
[4] 馬曉璇,時惠平,郭 薇,等.全器官CT灌注成像評價胰腺癌微循環的價值[J].中國醫學影像學雜志,2013,21(6):439-442.
[5] Goetti R,Leschka S,Desbiolles L,etal. Quantitative computed tomography liver perfusion imaging using dynamic spiral scanning with variable pitch: feasibility and initial results in patients withanceretastases[J]. InvestRadiol,2010,45(7): 419-426.
[6] Goshima S,Kanematsu M,Nishibori H,etal. CT of the pancreas: Comparison of anatomic structure depiction,image quality,and radiation exposure between 320-detector volumetric images and 64-detector helical images[J]. Radiology,2011,260(1): 139-147.
[7] 呂海波,周翔平,陳衛霞.在體測量急性胰腺炎的血流灌注特點[J].實用放射學雜志,2008,24(1):43-47.
[8] 徐 青,唐金華,徐化鳳.CT灌注成像輔助診斷胰腺癌[J].醫學影像學雜志,2011,21(9): 1362-1365.
[9] 米 華,王 冶.多排螺旋CT 灌注成像對胰腺疾病的診斷價值[J].臨床放射學雜志,2011,30(7): 998-1001.
[10] 張 鵬,陳克敏.胰腺癌多層螺旋CT灌注成像的臨床應用研究[J].重慶醫學,2013,42(27): 3289-3291.
[11] 于興旭,陳伏萍,王志銘,等.胰腺癌CT灌注成像與腫瘤血管生成的研究[J].中國臨床醫學影像雜志,2009,20(12):907-910.
(收稿:2015-05-12)
胰腺腫瘤/診斷 微循環 體層攝影術,X線計算機 灌注成像
R445.3
A
10.3969/j.issn.1000-7377.2015.11.013
△通訊作者:武警陜西總隊醫院CT室

