山羊卵巢維持基因FOXL2啟動子活性及調控區域分析
耿立英,張 宇,李祥龍*,周榮艷,李蘭會,王志剛
(1.河北科技師范學院,秦皇島 066600; 2.河北農業大學動物科技學院,保定 071000)
山羊卵巢維持基因FOXL2啟動子活性及調控區域分析
耿立英1,2,張 宇1,2,李祥龍1,2*,周榮艷2,李蘭會2,王志剛2
(1.河北科技師范學院,秦皇島 066600; 2.河北農業大學動物科技學院,保定 071000)
旨在研究山羊卵巢維持基因FOXL2啟動子活性以及探究該基因的調控機理。從NCBI數據庫調取FOXL2基因啟動子序列,用生物信息學軟件對其核心啟動子和轉錄因子進行預測分析。使用 PCR技術克隆FOXL2基因啟動子序列,并構建一系列缺失載體,瞬時轉染293T和A375細胞,利用雙熒光素酶基因檢測儀測定相對熒光素酶活性值。結果表明,該基因啟動子區域存在兩個典型的CpG島,分別位于(-920/+51(972 bp))和(+125/+555(430 bp))區域;經KpnⅠ和Hind Ⅲ雙酶切鑒定表明,重組載體質粒構建正確;在細胞中插入不同長度的FOXL2基因啟動子片段,隨著啟動子5′端截短,熒光素酶轉錄活性先升高再逐漸降低。(-934/+324)區域存在轉錄活性,(-32/+324)區段包含了轉錄的基本元件;(-934/-456)區域在轉錄過程中對FOXL2基因起負調控作用,(-456/-192)區域為正調控區域。
山羊;FOXL2基因;啟動子;活性
FOXL2(Forkhead box L2)屬于FOX叉頭框轉錄因子家族,在體細胞中廣泛表達。該基因在人類、鼠和山羊等物種中高度保守,人同源序列缺失則導致眼裂狹小綜合癥(BPES)[1],突變后FOXL2生物學結構與功能的改變,可能是小瞼裂綜合征的致病原因[2]。FOXL2被認為在性別分化中起到重要作用[3-5],是雌性的性別決定基因[6-7],對卵巢發育調控起關鍵作用[8-11],在小鼠和山羊的早期卵巢分化中,均發現了FOXL2基因的表達[12],其功能缺失會導致性別反轉[13-14]。FOXL2基因從正常山羊胚胎發育的初期開始表達,并且36 dpc表達呈上升趨勢,成年后表達消失[15]。山羊FOXL2基因受無角間性綜合癥(Polled intersex syndrome,PIS)區域調控表達,并與山羊間性形成具有緊密聯系[16]。山羊FOXL2基因上游長度為1 055 bp的啟動子區域曾被作為PIS區域調控重要元件被首度克隆,并插入到熒光素酶Luc報告基因載體,細胞轉染試驗驗證了該啟動子活性[17]。據報道FOXL2基因啟動子為典型的GC-rich啟動子,并且包含Sp1結合位點[17]。通常來說,這種類型的啟動子應該含有多個轉錄起始位點,且轉錄起始元件分布在100 bp范圍內[18]。除受啟動子元件的轉錄調控外,山羊基因接受位于1q23無角綜合癥(PIS)區域的調控。到目前為止,雖然已驗證了山羊FOXL2基因的啟動子區域,但對于山羊FOXL2基因的轉錄調控的正負調控區域尚不明確。
本試驗克隆了山羊FOXL2基因啟動子序列,并通過生物信息學分析構建了啟動子系列缺失報告基因載體,分析并探討該基因的轉錄活性區域,為進一步研究FOXL2基因表達調控奠定基礎。
1 材料與方法
1.1 樣品及試劑
健康、體況良好的唐山奶山羊血液樣品(正常64個,間性34個);DH5α菌種和綠色熒光蛋白質粒由實驗室保存;pMD?19-T載體為寶生物工程有限公司產品;pGL3-Basic、pGL3-Control和PRL-TK載體均由北京原平皓生物技術有限公司贈送。TransStartTaqDNA Polymerase、dNTPs和T4 DNA連接酶為全式金(北京)生物技術有限公司產品;限制性內切酶KpnⅠ和Hind Ⅲ購自Thermo公司;質粒DNA小量提取試劑盒和瓊脂糖凝膠回收試劑盒為上海生工生物工程有限公司產品;雙熒光素酶Luc報告基因檢測試劑盒為北京原平皓生物技術有限公司產品;脂質體轉染試劑Lipofectamine 2000為Invitrogen公司產品;1640固體培養基、0.25%胰蛋白酶和小牛血清購自GIBCO公司。
1.2 啟動子序列分析
利用NCBI數據庫調取山羊FOXL2基因啟動子序列(AY112725.2),使用軟件Primer 5.0設計引物擴增該區域序列并送至測序公司測序。利用在線Methprimer程序對山羊FOXL2基因啟動子序列進行CpG島預測(http://www.urogene.org/methprimer/);使用在線程序Neural Network Promoter Prediction(NNPP)(http://promotor.biosino.org/)和Promoter Scan(http://www-bimas.cit.nih.gov/molbio/proscan/)進行核心啟動子預測及轉錄因子分析[19]。
1.3 引物設計及載體構建
根據生物信息學分析結果,以FOXL2基因-1 000~+350區域(AY112725.2)為模板,對其5′端進行不同長度的缺失,并命名為P1(-934/+324)、P2(-456/+324)、P3(-192/+324)、P4(-104/+324)和P5(-32/+324)(圖1),引物序列設計了KpnⅠ和Hind Ⅲ兩種酶切位點(表1)。PCR擴增5個啟動子缺失片段并切膠純化回收,連接到pMD?19-T載體,利用引物兩端酶切位點,再將目的片段從克隆載體上切割下來,并連接到表達載體pGL3-Basic上。酶切鑒定篩選的陽性克隆送至測序公司測序。
1.4 山羊FOXL2基因啟動子轉錄活性的檢測
293T和A375細胞均使用添加10%小牛血清的1640培養基培養。轉染前1 d以1.5×105個·孔-1的密度接種于24孔培養板過夜培養,用于轉染。293T和A375細胞脂質體與質粒總量比分別為1∶0.5和1∶0.25。設計陽性對照組為pGL3-promoter質粒與pRL-TK質粒共轉染,陰性對照組為pGL3-Basic質粒與pRL-TK質粒共轉染,試驗組為pGL3-Basic/Px質粒與pRL-TK質粒共轉染,具體轉染與雙熒光素酶檢測熒光值步驟參照熒光素酶檢測試劑盒操作說明進行。試驗重復3次,每次3個平行。
1.5 數據處理
將所測得螢火蟲熒光素酶蛋白表達量檢測值F除以內參海參熒光素酶蛋白表達量檢測值R,所得即為螢火蟲熒光素表達量的相對值F/R,再除以陰性對照pGL3-Basic的相對熒光素酶檢測的背景值,以消除不同轉染批次的系統誤差。試驗數據使用SPSS17.0進行統計學分析。

圖1 山羊FOXL2基因啟動子不同長度片段擴增示意圖Fig.1 Amplifying schematic diagram of different length fragments in goat FOXL2 promoter region
表1 山羊FOXL2 基因啟動子擴增引物
Table 1 Primers for promoter amplification of goatFOXL2 gene
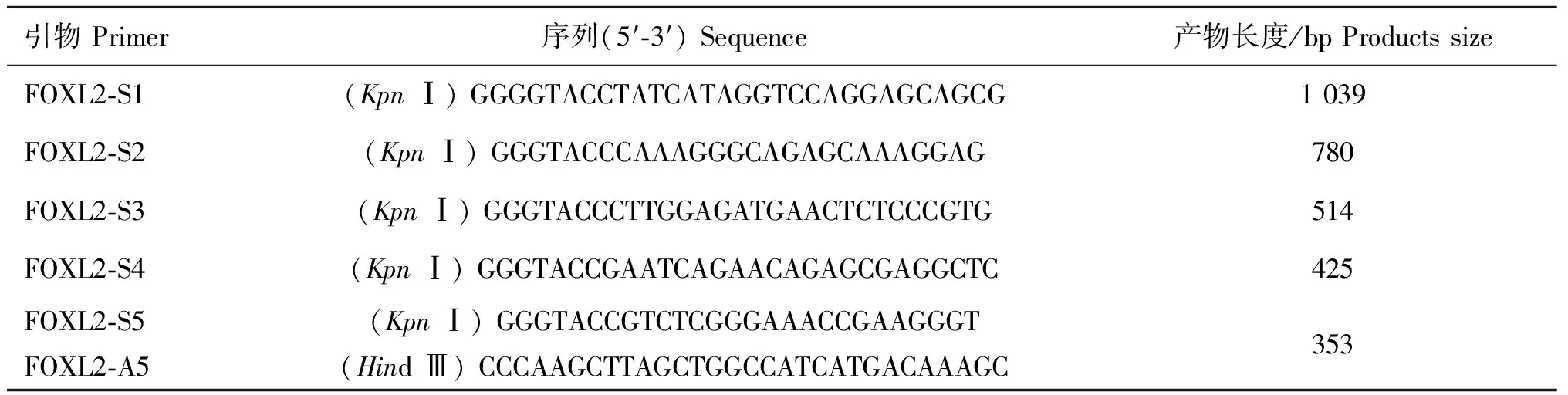
引物Primer序列(5′?3′)Sequence產物長度/bpProductssizeFOXL2?S1(KpnⅠ)GGGGTACCTATCATAGGTCCAGGAGCAGCG1039FOXL2?S2(KpnⅠ)GGGTACCCAAAGGGCAGAGCAAAGGAG780FOXL2?S3(KpnⅠ)GGGTACCCTTGGAGATGAACTCTCCCGTG514FOXL2?S4(KpnⅠ)GGGTACCGAATCAGAACAGAGCGAGGCTC425FOXL2?S5FOXL2?A5(KpnⅠ)GGGTACCGTCTCGGGAAACCGAAGGGT(HindⅢ)CCCAAGCTTAGCTGGCCATCATGACAAAGC353
2 結 果
2.1FOXL2基因啟動子全長片段的獲得
以正常唐山奶山羊基因組為模板,進行PCR擴增測序后,克隆得到的目的片段與NCBI提交的山羊FOXL2基因序列(AY112725.2)相似性為99%(圖2),說明擴增片段來源正確,可用于后續試驗。
2.2FOXL2基因啟動子生物信息學分析
將測序得到的FOXL2-SA序列2 149 bp(-1 537/+612)提交到Methprimer程序進行預測分析(圖3)。該區段存在兩個典型的大小分別為972和430 bp的CpG島,分別位于616~1 588 bp(-920、+51)區段和1 662~2 092 bp(+125、+555)區段。因此可以確定,FOXL2基因啟動區域通過CpG島招募重要轉錄因子發揮啟動轉錄作用,而高甲基化狀態的CpG島反過來影響其對轉錄因子的招募,從而降低下游基因轉錄活性,即影響基因表達。
NNPP啟動子程序的預測結果顯示了3個閾值超過0.85的候選核心啟動子區段,分別為-978~-929 bp、+257~+307 bp、+294~+444 bp,預測得分分別為0.85、0.86和0.86(表2)。

圖2 FOXL2基因在NCBI中的比對結果Fig.2 Result of blast in NCBI of FOXL2 gene

圖3 FOXL2基因CpG島預測結果Fig.3 Result of predicting for CpG island of FOXL2 gene
表2 Neural Network Promoter Prediction啟動子預測結果
Table 2 The promoter prediction result by neural network promoter prediction

起始位置Startingposition終止位置Endposition得分Score啟動子序列Promotersequence560(-978)610(-929)0.85TTACCCCATAAATATAAATCTCACATCTTATATCTGTGCATACCTGTTTC1794(+257)1844(+307)0.86CGGCGCCAGCGGAAAAGAGCAGGGACTGCCCGGCCGCGGCGCGCCGGCTT1931(+294)1981(+444)0.86GGCGCCGGCGCCGCCCAGCCCGGGCAAGGGCGGCGGCGGCGGTGCGGGGG
使用Promoter Scan程序預測FOXL2-SA啟動子結合位點,結果顯示,+43~+293 bp區段的啟動子分值最高達到了61.71(預測閾值為53.0),并且在此區域預測出Sp1、EARLY-SEQ1、T-Ag、AP-2、UCE.2、KROX24、EGR-1、UCE.1、MT-I.6和GCF轉錄因子,其中Sp1和AP-2出現頻數最高,分別為7和4次。-276~-526 bp區段預測分值為54.06,也超出了閾值53.0分。此段區域中包括了GCF、UCE.2、AP-2、Sp1、T-Ag、H4TF1、JCV、EARLY-SEQ1、PuF和SIF轉錄因子,其中Sp1出現6次,AP-2出現5次(表3)。這些轉錄因子分布集中的區域,預示著對FOXL2基因表達起著重要調控作用,+43~+293 bp區域可能為FOXL2基因核心啟動子區。
2.3 缺失啟動子基因載體的構建
依據上述生物信息學分析結果,選取-934/+324區間作為最長克隆片段,其他片段分別為對其5′端進行不同長度的缺失,構建命名如下質粒:pGL3-Basic/P1(-934/+324)、pGL3-Basic/P2(-456/+324)、pGL3-Basic/P3(-192/+324)、pGL3-Basic/P4(-104/+324)和pGL3-Basic/P5(-32/+324)。最長片段pGL3-Basic/P1覆蓋了兩個CpG島和所有轉錄因子富集區域;pGL3-Basic/P2為第一個CpG島部分缺失片段,但包含Promoter Scan程序預測的兩個核心啟動子區域;pGL3-Basic/P3(-192/+324)缺失了Promoter Scan程序預測的一個核心啟動子區域;pGL3-Basic/P4(-104/+324)保留了轉錄起始位點前100 bp區域;pGL3-Basic/P5(-32/+324)缺失了轉錄起始位點前所有片段。
將構建完成的Luc報告基因載體使用限制性內切酶KpnI和Hind III進行雙酶切鑒定,如圖4所示,所有正常長度的目的基因片段均被切割下來,因此所構建的重組載體質粒含有所克隆目的片段。
2.4 細胞轉染及活性分析
使用Luc報告基因載體瞬時轉染293T和A375細胞,轉染48 h后裂解并收獲細胞,細胞裂解液用于測定雙熒光素酶活性并且計算Luc報告基因相對活性值。經過數據校正后,綜合多次測定結果,用SPSS17.0軟件分析缺失啟動子片段啟動子活性。試驗結果表明,本試驗所構建的各個缺失啟動子片段的載體與pGL3-Basic空載體相比都具有明顯的啟動活性(P<0.01)。
表3 Promoter Scan預測啟動子結果
Table 3 Promoter prediction by Promoter Scan

轉錄因子Transcriptionfactor正/反義鏈Sense/Antisensestrand位置/bpPosition權重Weight轉錄因子Transcriptionfactor正/反義鏈Sense/Antisensestrand位置/bpPosition權重WeightSp1+433.013GCF+-2762.284Sp1-483.061UCE.2--3151.278EARLY?SEQ1-505.795AP?2--3341.108Sp1-506.819Sp1--3503.292T?Ag+521.086AP?2--3501.355AP?2+901.355Sp1+-3553.361AP?2+921.108UCE.2+-3611.216Sp1+1182.755GCF+-3642.284Sp1-1232.772T?Ag--4701.086UCE.2+1241.278H4TF1--4921.679UCE.2-1271.216JCV--4941.427AP?2-1381.091AP?2+-4951.091AP?2-1401.672AP?2+-4951.064KROX24+1832.151AP?2+-4971.672Sp1+1873.013Sp1--4986.661EGR?1-1912.294Sp1--49810.681Sp1-1923.061Sp1--4993.013UCE.2+2231.278Sp1+-5043.061UCE.2-2261.216EARLY?SEQ1+-5065.795UCE.1-2361.700UCE.2--5161.278MT?I.6+2408.606PuF--5261.082GCF+2562.361SIF+-5261.161GCF-2622.284
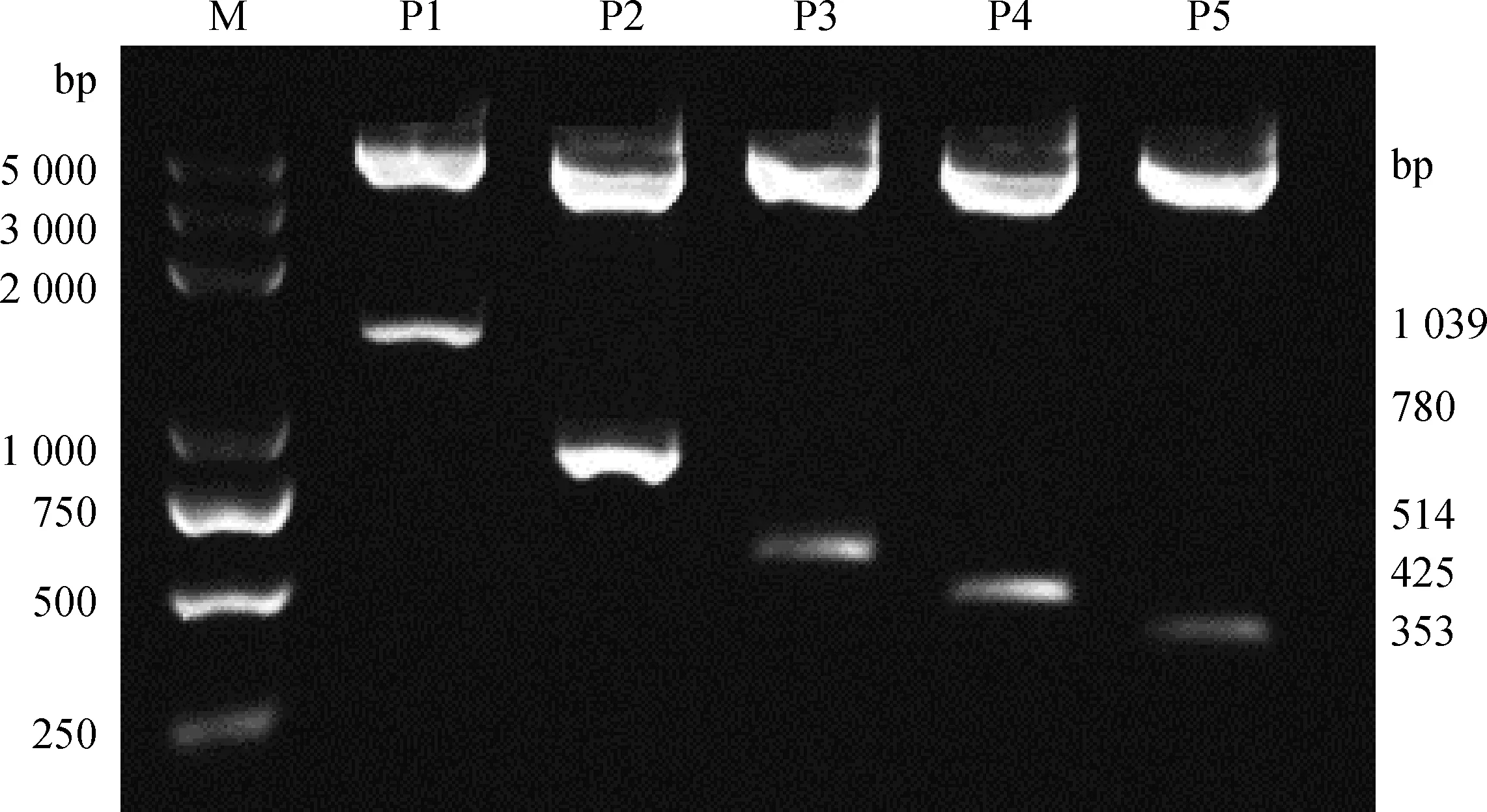
P1~P5.Luc報告基因載體雙酶切產物;M.DNA相對分子質量標準DL5000P1-P5.Luc reporter gene vector double enzyme products;M.DL5000 DNA marker圖4 重組質粒酶切檢測結果Fig.4 Result of recombinant plasmid by digestion
由圖5可以看出,FOXL2基因啟動子隨5′端截短,熒光素酶轉錄活性先升高再逐漸降低,并且在293T和A375細胞中的變化趨勢幾乎相同,說明試驗結果具有可信度。缺失啟動子片段在兩種細胞中表達的共同特點是:pGL3-Basic/P5區段的啟動子活性均為5個區段中活性最低的片段,但是這個缺失片段在兩種細胞中與陰性對照相比仍然具有啟動子活性,且統計學差異極顯著(P<0.01);同時pGL3-Basic/P2與pGL3-Basic/P1片段相比,啟動子活性極顯著升高(P<0.01),其余缺失片段與pGL3-Basic/P2片段相比,啟動子活性極顯著降低(P<0.01)。結果表明,pGL3-Basic/P5缺失片段具備轉錄的基本元件;pGL3-Basic/P1片段中的(-934/-456)區域在轉錄過程中可能起了負調控的作用;pGL3-Basic/P2片段中的(-456/-192)區域為山羊FOXL2基因正調控區域。在A375細胞中各個缺失啟動子片段熒光素酶的表達量均相應高于293T細胞,因此與293T細胞相比,A375細胞的內環境更適合于FOXL2基因啟動子的轉錄。

**.P<0.01圖5 FOXL2啟動子缺失片段在293T和A375細胞中的活性比較Fig.5 Comparative activity of different promoters of FOXL2 in 293T and A375 cells
3 討 論
本試驗通過 5′RACE從 1 個月的山羊卵巢中成功克隆了FOXL2基因啟動子序列,并確定翻譯起始密碼子。對所得序列進行生物信息學分析發現,該基因啟動子區域存在兩個典型的大小分別為972和430 bp的CpG島,分別位于(-920/+51)區段和(+125/+555)區段。該啟動子為典型的GC-rich啟動子,并且包含 Sp1 結合位點,與M.Pannetier等人研究結果一致[17]。FOXL2基因啟動子是通過CpG島招募重要轉錄因子發揮啟動轉錄作用[20]。CpG島通常存在于基因啟動子區域,基因末端常存在一些富含“CG”雙核苷酸區域。CpG島不僅是基因的一種標志,可通過CpG島甲基化來參與基因表達調控和影響染色質結構[21]。FOXL2基因CpG島的范圍幾乎包含了轉錄起始位點上游1 000 bp和下游500 bp,暗示該區域存在較為廣泛的調控作用。
使用Promoter Scan程序預測FOXL2-SA啟動子結合位點,結果給出了2個候選核心啟動子區域,并且(+43/+293)區段預測分值高于(-276/-526)區段。其中兩個區段中Sp1和AP-2轉錄因子出現頻率最高,預示著這兩種轉錄因子對FOXL2基因表達起著重要調控作用。+43~+293區域可能成為FOXL2基因核心啟動子區。
綜合對核心啟動子及轉錄因子預測結果,推測出3個候選核心啟動子區域分別是(+40/+300)區段、(-500/-200)區段和(-950/-900)區段。依據CpG島位置、核心啟動子預測位置和轉錄因子預測位置設計不同的啟動子缺失片段,并連接至熒光素酶Luc報告基因載體,所構建的Luc報告基因載體分別為pGL3-Basic/P1(-934/+324)、pGL3-Basic/P2(-456/+324)、pGL3-Basic/P3(-192/+324)、pGL3-Basic/P4(-104/+324)和pGL3-Basic/P5(-32/+324),利用綠色熒光蛋白報告基因載體分別瞬時轉染293T和A375細胞,發現所構建的缺失啟動子片段均具備啟動子活性,該結論與CpG島存在范圍相一致。其中在細胞中插入FOXL2基因不同長度的啟動子片段,熒光素酶的轉錄活性有顯著差異:隨著5′端的截短,熒光素酶的轉錄活性先升高再逐漸降低。pGL3-Basic/P2片段與其他片段相比,啟動子活性極顯著升高,說明pGL3-Basic/P2片段中的(-456/-192)區域為山羊FOXL2基因正調控區域;pGL3-Basic/P5區段的啟動子活性為5個區段中活性最低的片段,說明缺失了轉錄起始位點前所有片段的pGL3-Basic/P5片段為仍具備轉錄活性的基本元件,并且該結果與Promoter Scan程序的預測結果相一致。(-934/-456)區域的缺失使啟動子轉錄活性顯著上升,在轉錄過程中起了負調控的作用,(-456/-192)區域的缺失使啟動子活性顯著下降,可知該區域為FOXL2基因正調控區域[22]。
本研究克隆了山羊FOXL2基因的啟動子片段,并通過生物信息學分析構建了啟動子缺失報告基因載體,通過瞬時轉染293T和A375細胞的體外嘗試分析并探討了該基因的轉錄活性區域,為進一步研究FOXL2基因表達調控奠定基礎。有關FOXL2基因啟動子的活性功能驗證還有待于在更多種類細胞中進行試驗。
4 結 論
山羊FOXL2基因(-934/+324)區域存在轉錄活性,(-934/-456)區域缺失使啟動子轉錄活性顯著上升,在轉錄過程中起負調控作用,(-456/-192)區域缺失使啟動子活性顯著下降,為FOXL2基因正調控區域。
[1] BEYSEN D,RAES J,LEROY B P,et al.Deletions involving long-range conserved nongenic sequences upstream and downstream ofFOXL2 as a novel disease-causing mechanism in blepharophimosis syndrome[J].AmJHumGenet,2005,77(2):205-218.
[2] 朱建瑩,李艷艷,孫 巖,等.突變前后FOXL2 基因的生物信息學分析研究[J].中華臨床醫師雜志(電子版),2013,7(8):3351-3356. ZHU J Y,LI Y Y,SUN Y,et al.The bioinformatics study of normal and mutational humanFOXL2 gene[J].ChineseJournalofClinicians(ElectronicEdition),2013,7(8):3351-3356.(in Chinese)
[3] LI M H,YANG H H,LI M R,et al.Antagonistic roles of Dmrt1 andFoxl2 in sex differentiation via estrogen production in tilapia as demonstrated by TALENs[J].Endocrinology,2013,154(12):4814-4825.
[4] GENNOTTE V,MéLARD C,D′COTTA H,et al.The sensitive period for male-to-female sex reversal begins at the embryonic stage in the Nile tilapia and is associated with the sexual genotype[J].MolReprodDev,2014,81(12):1146-1158.
[5] BAHAMONDE P A,MCMASTER M E,SERVOS M R,et al.Molecular pathways associated with the intersex condition in rainbow darter(Etheostomacaeruleum) following exposures to municipal wastewater in the Grand River basin,ON,Canada.Part B[J].AquatToxicol,2015,159:302-316.
[6] PISARSKA M D,BARLOW G,KUO F T.Minireview:roles of the forkhead transcription factorFOXL2 in granulosa cell biology and pathology[J].Endocrinology,2011,152(4):1199-1208.
[7] BOULANGER L,PANNETIER M,GALL L,et al.FOXL2 is a female sex-determining gene in the goat[J].CurrBiol,2014,24(4):404-408.
[8] GEORGES A,L′HTE D,TODESCHINI A L,et al.The transcription factorFOXL2 mobilizes estrogen signaling to maintain the identity of ovarian granulosa cells[J].Elife,2014,3:e04207.doi:10.7554/eLife.04207.
[9] GEORGES A,AUGUSTE A,BESSIéRE L,et al.FOXL2:a central transcription factor of the ovary[J].JMolEndocrinol,2014,52(1):R17-R33.
[10] LI G L,ZHANG M Z,DENG S P,et al.Effects of temperature and fish oil supplementation on ovarian development and foxl2 mRNA expression in spotted scat Scatophagus argus[J].JFishBiol,2015,86(1):248-260.
[11] QIN N,LIU Q,ZHANG Y Y,et al.Association of novel polymorphisms of forkhead box L2 and growth differentiation factor-9 genes with egg production traits in local Chinese Dagu hens[J].PoultSci,2015,94(1):88-95.
[12] ELZAIAT M,JOUNEAU L,THéPOT D,et al.High-throughput sequencing analyses of XX genital ridges lacking FOXL2 reveal DMRT1 up-regulation before SOX9 expression during the sex-reversal process in goats[J].BiolReprod,2014,91(6):1-14,153.[13] AUGUSTE A,CHASSOT A A,GRéGOIRE E P,et al.Loss of R-spondin1 and Foxl2 amplifies female-to-male sex reversal in XX mice[J].SexDev,2011,5(6):304-317.
[14] PANNETIER M,ELZAIAT M,THéPOT D,et al.Telling the story of XX sex reversal in the goat:highlighting the sex-crossroad in domestic mammals[J].SexDev,2012,6(1-3):33-45.
[15] PAILHOUX E,VIGIER B,CHAFFAUX S,et al.A 11.7-kb deletion triggers intersexuality and polledness in goats[J].NatGenet,2001,29(4):453-458.
[16] 張晶晶.無角間性奶山羊FOXL2基因及PIS區域變異研究[D].保定:河北農業大學,2010. ZHANG J J.Variation of PIS region andFOXL2 gene in the polled intersex dairy goat[D].Baoding:Agricultural University of Hebei,2010.(in Chinese)
[17] PANNETIER M,RENAULT L,JOLIVET G,et al.Ovarian-specific expression of a new gene regulated by the goat PIS region and transcribed by aFOXL2 bidirectional promoter[J].Genomics,2005,85(6):715-726.
[18] 夏江東,程在全,吳渝生,等.高等植物啟動子功能和結構研究進展[J].云南農業大學學報,2006,21(1):7-14. XIA J D,CHENG Z Q,WU Y S,et al.Advances of the studles on function and composition of plant promoter[J].JournalofYunnanAgriculturalUniversity,2006,21(1):7-14.(in Chinese)
[19] ZHONG S,HE X,BAR-JOSEPH Z.Predicting tissue specific transcription factor binding sites[J].BMCGenomics,2013,14:796.doi:10.1186/1471-2164-14-796.
[20] TRAN S,WANG Y,LAMBA P,et al.The CpG island in the murine foxl2 proximal promoter is differentially methylated in primary and immortalized cells[J].PLoSOne,2013,8(10):e76642.
[21] ZHOU X Y,SUN J F,HE Y H,et al.Correlation of the methylation status of CpG islands in the promoter region of 10 genes with the 5-Fu chemosensitivity in 3 breast cancer cell lines[J].ChineseJournalofOncology,2010,32(5):328-333.
[22] MCLNTOSH A L,ATSHAVES B P,HOSTETLER H A,et al.Liver type fatty acid binding protein(L-FABP) gene ablation reduces nuclear ligand distribution and peroxisome proliferator-activated receptor-alpha activity in cultured primary hepatocytes[J].ArchBiochemBiophys,2009,485(2):160-173.
(編輯 郭云雁)
Activity and Regulation Region Analysis of Promoter of GoatFOXL2 Gene
GENG Li-ying1,2,ZHANG Yu1,2,LI Xiang-long1,2*,ZHOU Rong-yan2,LI Lan-hui2,WANG Zhi-gang2
(1.HebeiNormalUniversityofScience&Technology,Qinhuangdao066600,China;2.CollegeofAnimalScienceandTechnology,AgriculturalUniversityofHebei,Baoding071000,China)
The research was designed to study the activity of goat ovarian maintenance geneFOXL2 promoter and explore the gene’s regulation mechanism.FOXL2 promoter sequence was retrieved from the NCBI database,bioinformatics software was adopted to predict its core promoter and transcription factors.PCR technology was used to cloneFOXL2 gene promoter sequence and construct a series of deletion vectors,293T and A375 cells were transiently transfected,dual luciferase gene detector was used to measure the relative luciferase activity value.The results indicated that there were 2 typical CpG islands in the gene promoter region,which were located at (-920/+51(972 bp)) and (+125/+555(430 bp)) regions;the result ofKpnI andHind Ⅲ dual enzyme digestion test suggested that the recombinant plasmid was constructed correctly;FOXL2 gene promoter fragments with different lengths were inserted into the cells.When the promoter 5′was truncated,luciferase transcriptional activity firstly increased and then decreased.The result indicate that (-934/+324) region has transcriptional activity,(-32/+324) region contain the basic elements of transcription;(-934/-456) region negatively regulatesFOXL2 gene during the transcription process,(-456/-192) region is a positive regulatory region.
goat;FOXL2 gene;promoter;activity
10.11843/j.issn.0366-6964.2015.12.005
2015-01-06
河北省高校創新團隊領軍人才培育計劃(LJRC004)
耿立英(1974-),女,山東平原人,副教授,博士生,主要從事動物遺傳育種研究,E-mail:rosegengly@126.com
*通信作者:李祥龍,教授,博士,博士生導師,主要從事動物遺傳育種研究,E-mail:lixianglongcn@yahoo.com
S827;S813.3
A
0366-6964(2015)12-2153-08

