匯集白膜層制備單人份血漿懸浮去白混合濃縮血小板應用研究
趙鳳綿 戚海 張愛紅 牛宏偉 韓衛 劉敬閃 李建民 陳筱麟 張金彩 陳紅霞
目前,我國臨床應用的濃縮血小板以單采血小板為主,隨著臨床對單采血小板需求量的飆升,血站與臨床的供需矛盾越來越凸顯,科學合理、安全有效利用手工采集全血中血小板資源、緩解單采血小板供應不足的問題是血站亟需考慮的問題。因從單袋全血中提取單人份手工血小板的血小板含量低,患者需要輸注數袋才能達到血小板的治療效果,輸注過程繁瑣,反復穿刺易交叉感染,不能濾除白細胞易導致由白細胞引起的輸血反應等等,諸多弊端限制了手工血小板在臨床應用。歐洲國家普遍輸注混合濃縮血小板,甚至有些國家混合濃縮血小板在臨床占有絕對的比例。為滿足臨床輸注血小板的需求,綜合利用手工采集全血中的血小板資源,進一步提升血小板的質量和更理想的提高手工血小板的治療效果,我們開展了利用匯集白膜層方法、用單人份男性獻血者血漿作為懸浮介質、制備去白混合濃縮血小板研究,為我國建立手工濃縮血小板的匯集、濾除白細胞的操作規程和標準提供科學依據。
1 資料與方法
1.1 一般資料 選擇我中心符合《獻血者健康檢查要求》、2011年10月至2012年2月共計445名隨機獻血者捐獻的400 ml/袋全血。
1.2 設備與試劑 (1)日本久保田KUBOTA994L大型離心機;(2)泰爾茂SC-201A TSCD無菌導管接口機;(3)美國COULTER/AC.TC 5diff A血細胞計數儀;(4)英國西門子865血氣分析儀及配套試劑盒(批號:72497,54154);(5)顯微鏡和Nageotte白細胞計數板;(6)美國BD公司FACSCantoⅡ流式細胞儀,抗CD62p(Chrono-log,批號 09),抗 CD41(Chrono-log,批號 35),同型對照mouse IgG1 FITC、IgG1 PE;(7)美國Chronolog590-4D血小板凝聚儀和配套的血小板聚集誘導劑:ADP(批號3407),膠原(批號3414);(8)瑞士SunRise-Basic TECAN酶標儀;(9)山東威高一次性去白全血采血袋Q-400聯袋(1108241,1112151);(10)南京雙威FTS-PL白細胞過濾器(110412)(試驗Ⅰ組);成都雙陸KF-WFP-B-IU白細胞過濾器(110813)(試驗Ⅱ組,);單采血小板作為對照組;(11)去白混合濃縮血小板中任一男性獻血者血漿;(12)南京雙威二聯空袋(110605);(13)Turk’s溶液(自配)。
1.3 方法
1.3.1 去白混合濃縮血小板制備:將采集的400 ml/袋新鮮全血,保存在(22±2)℃,在4~6 h內重離心,分離出白膜層(BC)(30~40 ml,其中血漿15~20 ml,BC 和紅細胞15~20 ml),在(22±2)℃條件下靜置,次日將7袋檢驗合格并且同血型的BCs通過無菌導管接口機匯集在二聯空袋內,并加入提前挑選的其中一名男性獻血者的血漿200 ml(包括沖洗BC袋子所用),輕輕混合均勻后離心,分離出混合濃縮血小板;將混合濃縮血小板通過無菌導管接口機與白細胞過濾器相連接,調節流量調節器,使混合PRP以快速滴狀經過濾盒,過濾時間控制在12 min左右。過濾完畢熱合去掉濾器,即得去白混合濃縮血小板(以下簡稱“產品”)。
1.3.2 血小板和紅細胞殘留量計數:用血細胞計數儀測定試驗Ⅰ組、試驗Ⅱ組過濾前/后產品的血小板計數和紅細胞混入量,根據容量計算每袋產品的血小板含量。
1.3.3 白細胞殘余量測定:制備當天,試驗Ⅰ組和試驗Ⅱ組的產品均用Nageotte計數法測定白細胞殘留量。用試管取產品 100 μl,加入 900 μl Turk,s溶液混勻,靜置10 min,再次震蕩試管后吸取約600 μl混合液滴入Nageotte計數板中,室溫沉降15 min后,在顯微鏡下計數1個滿格子(5 μl)上的白細胞,樣品按1∶10稀釋,計算結果為每格中 WBCs/μl。計算公式:每袋中白細胞個數=白細胞實測值×10×103×容量/100。
1.3.4 血小板抗低滲休克反應(HSR)測定
1.3.4.1 樣本的制備 每袋產品均用無菌接口機將母袋與二聯空袋相連接,取產品10 ml后熱合與母袋離斷,離心分離出貧血小板血漿(PPP)用于稀釋樣本用;另接一空袋取產品10 ml,吸取適量,根據血小板計數用PPP稀釋成濃度為(250~300)×109/L的樣本。
1.3.4.2 HSR 的測定 用 SunRise-Basic TECAN 酶標儀測定試驗Ⅰ組和試驗Ⅱ組制備當天產品的HSR,波長630nm。樣本與蒸餾水按1∶2比例混合,用蒸餾水調零,測定最小吸光度T0和該樣本15 min后的吸光度T15;樣本與產品自身的 PPP按1∶2比例混合,用PPP調零,測最大吸光度Tmax,HSR恢復率=(A15-A0)/(Amax-A0)×100%。
1.3.5 pH值和代謝產物的測定:用血氣儀和配套試劑盒測定試驗Ⅰ組和試驗Ⅱ組產品制備當天的pH值,葡萄糖 (mmol/L)、乳酸鹽 (mmol/L)、PCO2(mm Hg)、PO2(mm Hg)和碳酸氫鹽以及鈉離子、鉀離子、氯離子的含量。
1.3.6 血小板聚集功能測定:用590系列電阻聚集儀測定血小板聚集率,當電極插入裝有磁棒和血小板濃縮液的反應杯中時,在電極的表面立刻附著一層血小板,加入誘導劑后大量血小板進一步聚集。在此電極回路中,因血小板聚集電阻增加,電流減少,儀器通過檢測電阻的變化來確定血小板的聚集率。分別用ADP(10 μmol/L)和膠原(2 μg/ml)測定試驗Ⅰ組和試驗Ⅱ組產品第1天的電阻值。測定前將產品用PPP稀釋至濃度為(250~300)×109/L的樣本。
1.3.7 用流式細胞儀測定試驗Ⅰ組和試驗Ⅱ組產品的血小板CD62p陽性率。取2支流式細胞儀專用試管,分別標記為對照管和測定管并分別加入同型對照mouse IgG1 FITC、IgG1 PE;測定管再加入CD41-FITC、CD62p-PE;加入處理好的標本,混勻避光反應20 min;用1%多聚甲醛4℃固定血小板,10 min后用流式細胞儀測定 CD62p陽性表達率(用流式細胞儀內置的Cellquest軟件分析)。
1.4 質量標準 依據GB18469-2012《全血及成分血質量要求》中去白單采血小板的要求:血小板含量≥2.5 ×1011/袋,紅細胞混入量≤8.0 ×109/袋,pH 值為6.4 ~7.4。白細胞混入量≤5.0 ×106/袋,無細菌生長。
1.5 統計學分析 應用SAS 9.0統計軟件,計量資料以±s表示,組間行獨立樣本t檢驗,組內行成對樣本t檢驗,P<0.05為差異有統計學意義。
2 結果
2.1 2組過濾前后血小板回收率情況 2組產品過濾后回收率在90%以上,差異有統計學意義(P<0.05)。見表1。
表1 2組過濾前后血小板回收率情況±s

表1 2組過濾前后血小板回收率情況±s
組別 濾前(×1011/袋) 濾后(×1011/袋) 回收率(%) t值 P 值 細菌培養試驗Ⅰ組(n=35) 2.90 ±0.39 2.62 ±0.26 90.34 ±2.32 4.996 0.000無菌生長試驗Ⅱ組(n=25) 2.93 ±0.35 2.71 ±0.29 92.49 ±1.17 7.023 0.000無菌生長
2.2 2組去白混合濃縮血小板的質量變化情況 2組產品血小板的含量和紅細胞的殘留量均符合單采血小板的標準,產品白細胞的殘留量比去白細胞單采血小板標準低數10倍,比普通單采血小板低數千倍。見表2。
表2 2組去白混合濃縮血小板的質量變化情況±s

表2 2組去白混合濃縮血小板的質量變化情況±s
項目 試驗Ⅰ組(n=35) 試驗Ⅱ組(n=25) t值 P值容量(ml)294.00 ±37.00 290.00 ±34.00 0.347 0.730血小板含量(×1011/袋) 2.62 ±0.26 2.71 ±0.29 1.258 0.213 MPV(fl) 6.78 ±0.53 6.93 ±0.29 1.329 0.189 RBC 混入量(×109/袋) 6.16 ±2.98 6.13 ±2.11 0.047 0.963 WBC混入量(×106/袋)0.15 ±0.14 0.15 ±0.16 0.231 0.818
2.3 3組去白混合濃縮血小板的功能變化情況 t1、p1分別為試驗Ⅰ組與對照組的值,t2、p2分別為試驗Ⅱ組與對照組的值,t3、p3分別為試驗Ⅰ組與試驗Ⅱ組的值,差異有統計學意義(P<0.05)。抗低滲休克反應試驗Ⅰ組高于對照組,差異有統計學意義(P<0.05);試驗Ⅱ組低于試驗Ⅰ組和對照組,差異有統計學意義(P<0.05)。活化標志物CD62p試驗Ⅰ組合試驗Ⅱ組均低于對照組,差異有統計學意義(P<0.05)。膠原誘導的聚集率比ADP誘導的聚集率高(P<0.05)。見表3。
表3 3組去白混合濃縮血小板的功能變化情況±s
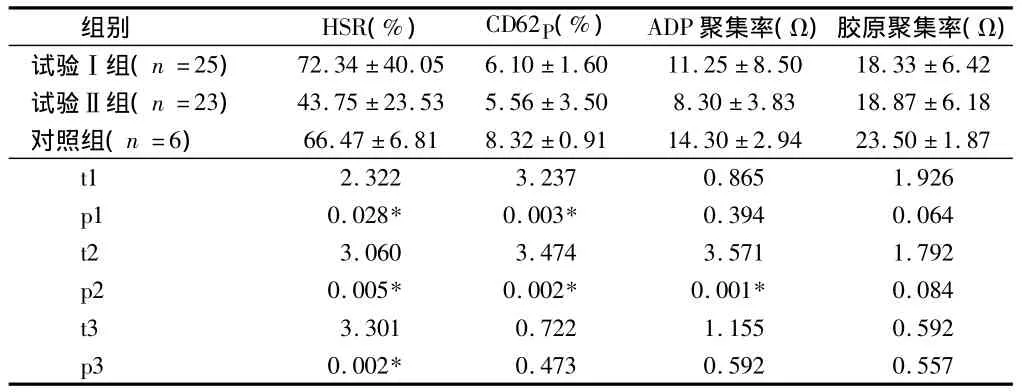
表3 3組去白混合濃縮血小板的功能變化情況±s
組別 HSR(%) CD62P(%) ADP聚集率(Ω)膠原聚集率(Ω)試驗Ⅰ組(n=25) 72.34 ±40.05 6.10 ±1.60 11.25 ±8.50 18.33 ±6.42試驗Ⅱ組(n=23) 43.75 ±23.53 5.56 ±3.50 8.30 ±3.83 18.87 ±6.18對照組(n=6) 66.47 ±6.81 8.32 ±0.91 14.30 ±2.94 23.50 ±1.87 t1 2.322 3.237 0.865 1.926 p1 0.028* 0.003* 0.394 0.064 t2 3.060 3.474 3.571 1.792 p2 0.005* 0.002* 0.001* 0.084 t3 3.301 0.722 1.155 0.592 p3 0.002*0.473 0.592 0.557
2.4 3組去白混合濃縮血小板第1天代謝指標變化情況 t1、p1分別為試驗Ⅰ組與對照組的值,t2、p2分別為試驗Ⅱ組與對照組的值,t3、p3分別為試驗Ⅰ組與試驗Ⅱ組的值,差異有統計學意義(P<0.05)。兩試驗組的pH值符合GB18469-2012《全血及成分血質量要求》對混合濃縮血小板的要求,但均與對照組差異有統計學意義(P<0.05),兩試驗組之間差異也有統計學意義(P<0.05);乳酸鹽和PCO2比較,試驗Ⅱ組顯著大于試驗Ⅰ組,差異有統計學意義(P<0.05)。見表4。
表4 3組去白混合濃縮血小板第1天代謝指標變化情況±s
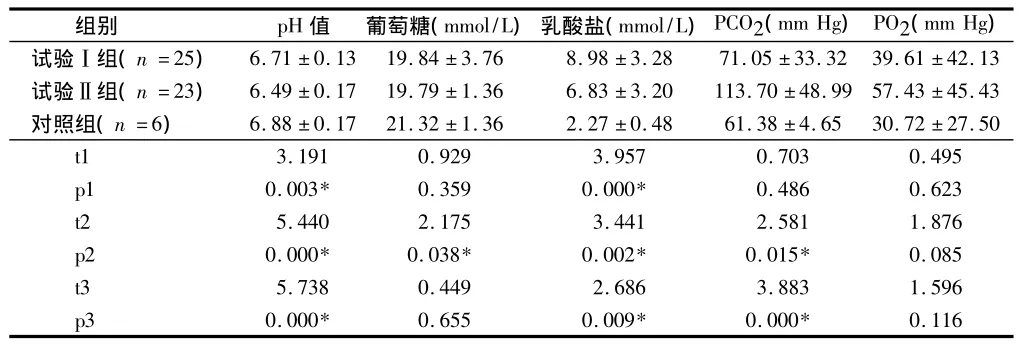
表4 3組去白混合濃縮血小板第1天代謝指標變化情況±s
組別 pH值 葡萄糖(mmol/L)乳酸鹽(mmol/L)PCO2(mm Hg)PO2(mm Hg)試驗Ⅰ組(n=25) 6.71 ±0.13 19.84 ±3.76 8.98 ±3.28 71.05 ±33.3239.61 ±42.13試驗Ⅱ組(n=23) 6.49 ±0.17 19.79 ±1.36 6.83 ±3.20 113.70 ±48.99 57.43 ±45.43對照組(n=6) 6.88 ±0.17 21.32 ±1.36 2.27 ±0.48 61.38 ±4.65 30.72 ±27.50 t1 3.191 0.929 3.957 0.703 0.495 p1 0.003* 0.359 0.000* 0.486 0.623 t2 5.440 2.175 3.441 2.581 1.876 p2 0.000* 0.038* 0.002* 0.015* 0.085 t3 5.738 0.449 2.686 3.883 1.596 p3 0.000* 0.655 0.009* 0.000*0.116
3 討論
我國利用手工采集全血中血小板資源與歐洲國家相比有很大差距。2004年歐洲國家混合濃縮血小板的應用比率范圍為10% ~98%。2007年德國臨床應用混合濃縮血小板占40%,2008年達到97%,3%的單采血小板只用于需要HLA/HPA配型的患者[1]。面對國內臨床對血小板需求量越來越大的現實,僅僅依靠單采血小板已不能滿足臨床需求,充分利用手工采集全血中血小板資源、制備去白混合濃縮血小板是解決血站與臨床血小板供需矛盾的有效途徑。
表1顯示,7袋BC匯集制備的產品,血小板含量能夠達到1個治療量,過濾后回收率在90%以上,表2顯示白細胞殘留量比標準要求的少數10倍,可以減少由白細胞引起的輸血反應。BCs在22℃過夜保存期間,BCs中的白細胞仍有吞噬細菌的能力,通過過濾去除白細胞也去除了可能污染的細菌,可以減少患者輸注后的敗血癥風險。
HSR是檢測血小板在低滲環境中發生腫脹后,由膜的完整性和能量代謝使腫脹的血小板恢復其原有形狀的能力,測定HSR可以預測血小板在體內的存活力[2]。表3顯示,試驗Ⅰ組的HSR顯著高于對照組,而試驗Ⅱ組顯著低于對照組,但2個試驗組的血小板HSR范圍為54% ~82%,在文獻報道的40% ~80%范圍內[2],表明酶標儀測定血小板HSR具有比較好的準確性,操作簡便,需要的樣本量少,重復性好,檢測速度快,一次可以對多份樣本測定。
CD62p是血小板活化的重要指標,CD62p存在于血小板α顆粒的內表面,血小板未發生活化時其外表面不表達CD62P,一旦血小板受到各種刺激被激活時,其顆粒膜與質膜發生融合,導致CD62p在質膜上表達而被檢測到,成為活化血小板標志。本研究測定的兩個試驗組的CD62p均比對照組有顯著性差異,也比文獻報道[兩種濾器分別是(8.06 ±4.11)和(10.34±3.26)][3]低。據報道匯集 BC 在離心過程中,有紅細胞和白細胞作緩沖,使血小板受到的切割力較小,減少了血小板的制備損傷,使以CD62p為代表的活性標志物減少[4]。
本研究是用電阻法測定血小板的聚集率,同一誘導劑測出的電阻越大,說明血小板的聚集功能越好。血小板聚集率大小與使用的聚集誘導劑的種類有關,ADP是弱的誘導劑,膠原是強誘導劑,膠原能夠使血小板產生相當多的α顆粒而使血小板聚集反應增加。表3顯示,膠原誘導的聚集率2個試驗組和對照組沒有顯著性差異,而且顯著高于ADP誘導的聚集率(P<0.05),并與文獻報道的電阻法測定正常人的聚集率(ADP 為6 ~13 Ω,膠原為 10 ~18 Ω)[5]相一致,但與 文 獻 報 道 的 比 濁 法 (ADP 70.55%[3],膠 原87.40%[6])低。比濁法和電阻法是兩種不同的測定血小板聚集率的方法,據報道兩種方法的測定結果不具有可比性,特別在臨床檢測中不建議兩種方法替代使用[5]。
表4顯示,2個試驗組的pH值符合GB18469-2012《全血及成分血質量要求》對混合濃縮血小板的要求,但與對照組比較,差異有統計學意義(P<0.05),兩試驗組之間差異也有統計學意義(P<0.05);乳酸鹽和PO2試驗Ⅱ組顯著大于試驗Ⅰ組(P<0.05)。這可能與BC過夜保存和使用的血小板保存袋有關:BC在過夜保存期間由于代謝產生CO2,當制成產品后,能呼吸的血小板保存袋(試驗I組)可以通透氣體,產生的CO2能夠從袋內逸出,O2也能夠進入保存袋內,維持了介質的pH值,不能呼吸的袋子(試驗Ⅱ組)產生的CO2不能逸出,使得CO2分壓越來越大,pH值下降。
在提取BC時盡量減少血漿量,使混合血小板中來自各個獻血者的血漿量盡量少,再用其中1名男性獻血者血漿作為懸浮介質,可以減少 TRALI發生率[7];血小板含量能夠達到1個治療量,方便臨床輸注,可以作為單采血小板供應不足的補充,使更多的需要輸注血小板的患者得到治療;能夠實現血液資源的綜合利用,減少浪費;為研究去白混合濃縮血小板的制備工藝和制定標準提供數據支持。
血站制定血小板的供應策略,既要考慮患者的特殊需求,又有考慮現有的資源條件,對于未產生同種免疫的患者,可以輸注去白混合濃縮血小板,對于含有HLA抗體或HPA抗體的患者來說,需要輸注與患者抗原相匹配的單采血小板。為保證產品的質量安全,不用第一次獻血者的血液制備本產品;從節約血液資源角度考慮,應該充分利用手工采集全血中的血小板資源,除非有特殊的臨床需求。一個血站單采血小板和去白混合濃縮血小板都應該開展,在全血采集量較少的季節比如節假日或患者的特殊需要應考慮供應單采血小板,在采血旺季應提倡供應去白混合濃縮血小板。
1 Schrezenmeier H,Seifried E.Buffy-coat-derived pooled platelet concentrates and apheresis platelet concentrates:which product type should be preferred.Vox Sanguinis,2010,99:1-15.
2 Murphy S,Rebulla P,Bertolini F,et al.In vitro assessment of the quality of stored platelet concentrates.Transfus Med Rev,1994,8:29-36.
3 王紅,劉嘉馨,雷宇,等.2種國產血小板濾器濾除白細胞對體外血小板功能的影響.中國輸血雜志,2011,24:232-236.
4 Murphy S.Platelets from pooled buffy coats:an update.Transfusion,2005,45:634-639.
5 喬蕊,李蕾,張捷.全血電阻法血小板聚集試驗監測抗血小板治療的應用評價.實用醫學雜志,2011,27:3050-3052.
6 趙鳳綿,梁曉虎,張愛紅.洗滌混合血小板的質量和部分體外功能的測定.中國輸血雜志,2006,19:375-377.
7 Hume HA.TRALI moving toward prevention.Transfusion,2009,49:402-405.

