mTORC2通路在苯丙胺致大鼠紋狀體損傷中的變化*
王海樹,何文姬,宿寶貴,潘三強(暨南大學醫學院人體解剖學系,廣東廣州 510632)
?
mTORC2通路在苯丙胺致大鼠紋狀體損傷中的變化*
王海樹,何文姬,宿寶貴,潘三強△
(暨南大學醫學院人體解剖學系,廣東廣州510632)
[摘要]目的:探討哺乳動物雷帕霉素靶蛋白復合物2(mTORC2)通路在苯丙胺致中樞神經損傷過程中的變化。方法:通過注射苯丙胺建立大鼠動物模型,采用open field方法測試大鼠的自主行為活動,用透射電鏡觀察大鼠紋狀體的超微結構,用Western blot方法檢測mTORC2信號通路的變化,用免疫組化方法觀察mTORC2陽性神經元的變化。結果:苯丙胺大鼠在行為學上出現刻板行為,紋狀體細胞和神經纖維的超微結構受損,磷酸化的mTORC2和蛋白激酶B(Akt)表達減少,并且磷酸化的mTORC2陽性細胞也減少。結論: mTORC2通路的抑制可能在苯丙胺致紋狀體結構的損傷中起重要作用。
[關鍵詞]苯丙胺;紋狀體;哺乳動物雷帕霉素靶蛋白復合物2;蛋白激酶B
[修回日期]2015-03-10
Change of mTORC2 pathway in amphetamine-induced injury in rat striatum
WANG Hai-shu,HE Wen-ji,SU Bao-gui,PAN San-qiang
(Department of Anatomy,School of Medicine,Jinan University,Guangzhou 510632,China.E-mail: tpsq@ jnu.edu.cn)
[ABSTRACT]AIM: To explore the change of mammalian target of rapamycin complex 2 (mTORC2) pathway in amphetamine (AMPH) -induced injury in the central nervous system in rats.METHODS: The animal model was established by intraperitoneal injection of AMPH (2.5 mg ·kg-1·d-1).SD rats were randomly divided into control,saline and AMPH groups.The rat autonomous behaviors were tested by open field experiment.The changes of the neurons and fibers in the rat striatum were observed under transmission electron microscope.The change of mTORC2 signaling pathway in the striatum was detected by Western blot.The immunohistochemical method was applied to observe the changes of mTORC2 positive neurons in the striatum.RESULTS: The stereotyped behavior in AMPH group at 7 d and 14 d was induced.The ultrastructural injury of the neurons and fibers in the striatum was observed in AMPH group at 14 d.In the striatum,p-Rictor (S1219) expression in AMPH group was reduced compared with control group (P<0.01),and the protein level of p-Akt (T308) in AMPH group at 14 d was decreased (P<0.01).The number of p-Rictor (S1219) positive cells in AMPH group at 7 d and 14 d was reduced compared with control group.The result was consistent with that of Western blot.CONCLUSION: The structural damage of the striatum induced by AMPH may be associated with the inhibition of mTORC2/Akt signaling pathway.
[KEY WORDS]Amphetamine; Striatum; Mammalian target of rapamycin complex 2; Protein kinase B
苯丙胺(amphetamine,AMPH)、3,4-亞甲基二氧基甲基苯丙胺(搖頭丸)和甲基苯丙胺(冰毒)都屬于苯丙胺類興奮劑(amphetamine-type stimulants,ATS),為合成類毒品。2013年聯合國毒品調查報告指出,ATS的吸毒者遠超過鴉片、可卡因和海洛因等的吸毒人數,僅次于大麻。短期使用ATS,可使身體產生致幻性、高熱,以及心、肝、腎等器官損傷,長期或過量濫用可致藥物依賴性、中樞損傷和精神錯亂等[1]。
哺乳動物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)屬于磷脂酰肌醇激酶相關激酶家族,是絲氨酸/蘇氨酸激酶的一種。mTOR在細胞內有mTOR復合物1(mTOR complex 1,mTORC1)和mTORC2兩種形式[2]。mTORC1對雷帕霉素敏感,近年來研究表明,精神類藥品、大麻、鴉片和酒精引起的成癮行為、神經調節與mTORC1密切相關[3-4]。mTORC2對雷帕霉素不敏感,由mTOR、Rictor、mLST8、mSin1、PRR5和Deptor組成。Rictor是mTORC2的特異性成分,在mTORC2復合物中起著發揮mTORC2蛋白激酶活性的作用[5],從而使下游的蛋白激酶B(protein kinase B,Akt)磷酸化進而激活Akt的各條途徑。
已知mTORC2與細胞的骨架運動有關[6]。但它與中樞神經系統損傷的關系及在成癮藥物中所起的作用目前并不清楚。故本文通過注射苯丙胺建立大鼠動物模型,探討mTORC2信號通路與苯丙胺致大鼠紋狀體損傷的關系。
材料和方法
1材料
從中山大學實驗動物中心購買SPF級雄性SD大鼠60只,體重160~180 g,將大鼠分為空白組、生理鹽水組,苯丙胺1 h、1 d、7 d和14 d組,每組10只。苯丙胺1 h組只給予苯丙胺注射1次,在給藥后1 h取材;苯丙胺1 d組、7 d組和14 d組分別每天給藥1次,并于末次給藥后24 h內取材;而空白組、生理鹽水組與苯丙胺14 d組一同取材。
在大鼠腹腔注射3.5%水合氯醛,麻醉后,用4℃生理鹽水80 mL和4%多聚甲醛40 mL灌注心臟,取腦后放入4%多聚甲醛中進行后固定,作為免疫組化實驗材料。而用生理鹽水灌注后,用2%戊二醛和4%多聚甲醛40 mL進行灌注,取腦后固定,作為透射電鏡實驗材料。Western blot實驗材料則在灌注生理鹽水后,立即取紋狀體,迅速放入-80oC保存。
2方法
2.1動物模型制作和行為學實驗苯丙胺用生理鹽水按1 g/L配置,給藥劑量為2.5 mg ·kg-1·d-1苯丙胺,生理鹽水組注射同等劑量的生理鹽水,正常對照組未給予任何處理。藥后進行刻板行為評分,參照Sams-Dodd方法[7]進行。以刻板行為評分≥2分以及刻板行為持續時間≥15 min為合格模型。此外,建模過程中每組選5只大鼠進行open field測試。選擇大鼠的運動軌跡、總路程、運動時間以及平均速度等指標進行比較。
2.2透射電鏡觀察將紋狀體部位修塊,行半薄切片,用甲苯胺藍染色定位,再修塊,行超薄切片,飽和醋酸雙氧鈾染色,飽和硝酸鉛染色,在透射電子顯微鏡下觀察,拍照。
2.3 Western blot實驗組織超聲裂解,用Bradford法測蛋白含量,取30 μg蛋白上樣,恒壓電泳,轉膜,孵育I抗(p-Rictor,1∶1 000,Millipore; p-Akt,1∶1 000,Cell Signaling; tubulin,1∶1 000,Bioworld),孵育II抗(goat anti-rabbit IgG,1∶5 000,Bioworld),ECL顯影,用凝膠成像系統進行曝光。
2.4免疫組織化學染色將腦行冰凍冠狀切片,片厚25 μm。用S-P試劑盒(福州邁新公司)進行反應,即:加A液孵育,0.01 mol/L PBS漂洗后,加B液孵育,加I抗(p-Rictor,1∶200) 4℃過夜,0.01 mol/L PBS漂洗后,加C液孵育30 min,0.01 mol/L PBS漂洗后,加D液孵育,最后DAB顯色。乙醇脫水,二甲苯透明,中性樹膠封片。隨機選擇不重疊的10個視野,用徠卡顯微圖像系統的Q-Win軟件計數陽性細胞數及計算面積,每個動物取5張組織切片。
3統計學處理
實驗數據用均數±標準差(mean±SD)表示,用SPSS 13.0軟件包對所得的數據進行統計學處理。對于計量資料做完全隨機分組的單因素方差分析,選擇Tukey法進行多重比較;而對于等級資料則采用Kruskal-Wallis檢驗進行比較,多重比較則采用Nemenyi法。以P<0.05為差異有統計學意義。
結果
1動物的行為學變化
1.1自主活動測試空白組與生理鹽水組比較,大鼠自主活動總距離(distance)與運動速度(velocity)的差別不顯著,但運動時間(time)與空白組相比增加,差異有統計學意義,說明生理鹽水注射對大鼠的活動時間還是有一定的影響,但是這種影響與苯丙胺相比較小;苯丙胺1 d、7 d和14 d組大鼠自主活動的總距離、速度和運動時間比空白組都顯著增加,見圖1。
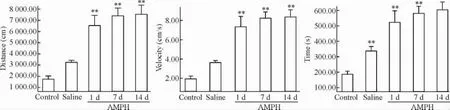
Figure 1.The changes of the autonomic activities in rats induced by AMPH.Mean±SD.n=5.**P<0.01 vs control.圖1給藥后各組大鼠自主活動度的比較
1.2刻板行為評分空白組和生理鹽水組相比刻板行為評分無顯著差異。而苯丙胺7 d組、14 d組與空白組比較,刻板行為評分增加,差異顯著(P<0.01),見表1。
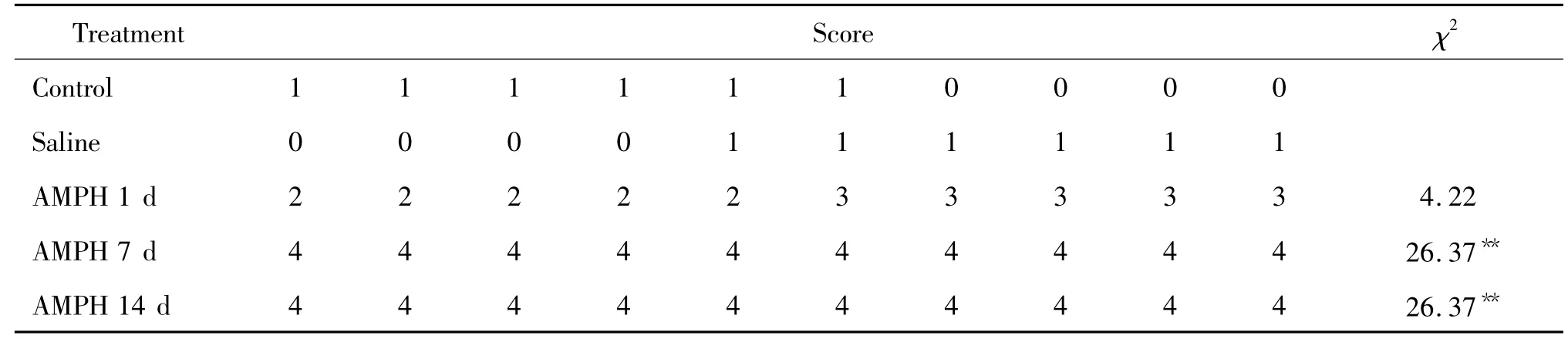
表1 各組SD大鼠刻板行為評分表Table 1.Stereotyped behavior scores of the rats induced by AMPH (n=10)
2苯丙胺對大鼠紋狀體神經元與神經纖維結構超微結構的損傷
空白組大鼠紋狀體的細胞結構清晰,胞核完整,髓鞘層次清楚(圖2A)。苯丙胺1 d組的胞體以及髓鞘結構與正常組相似(圖2B和2C) ;苯丙胺14 d組細胞核皺縮(圖2D),線粒體嵴斷裂、減少(圖2E) ;髓鞘變薄、變形(圖2F)。
3苯丙胺對mTORC2/Akt信號通路的抑制
在紋狀體部位,苯丙胺1 h組p-Rictor的表達有所下降,但與對照組相比無統計學差異(P>0.05)。苯丙胺1 d組、7 d組和14 d組p-Rictor的表達則受到嚴重抑制,比空白組明顯降低(P<0.05)。苯丙胺1 h組、1 d組和7 d組p-Akt(T308)的表達與對照組相比沒有明顯變化(P>0.05)。隨著時間延長,苯丙胺14 d組p-Akt(T308)的表達與空白組比較顯著下降(P<0.01),見圖3。
4苯丙胺對p-Rictor陽性細胞的影響
在紋狀體的p-Rictor(S1219)免疫陽性細胞胞核淡染,胞漿著色深。空白組和生理鹽水組之間的陽性細胞數比較無顯著差異。苯丙胺1 h組和7 h組p-Rictor的陽性細胞數與空白組相比有所減少,但無顯著差異(P>0.05)。苯丙胺7 d組和14 d組與空白組比較,紋狀體部位的p-Rictor陽性細胞數明顯減少,(P<0.01),見圖4。
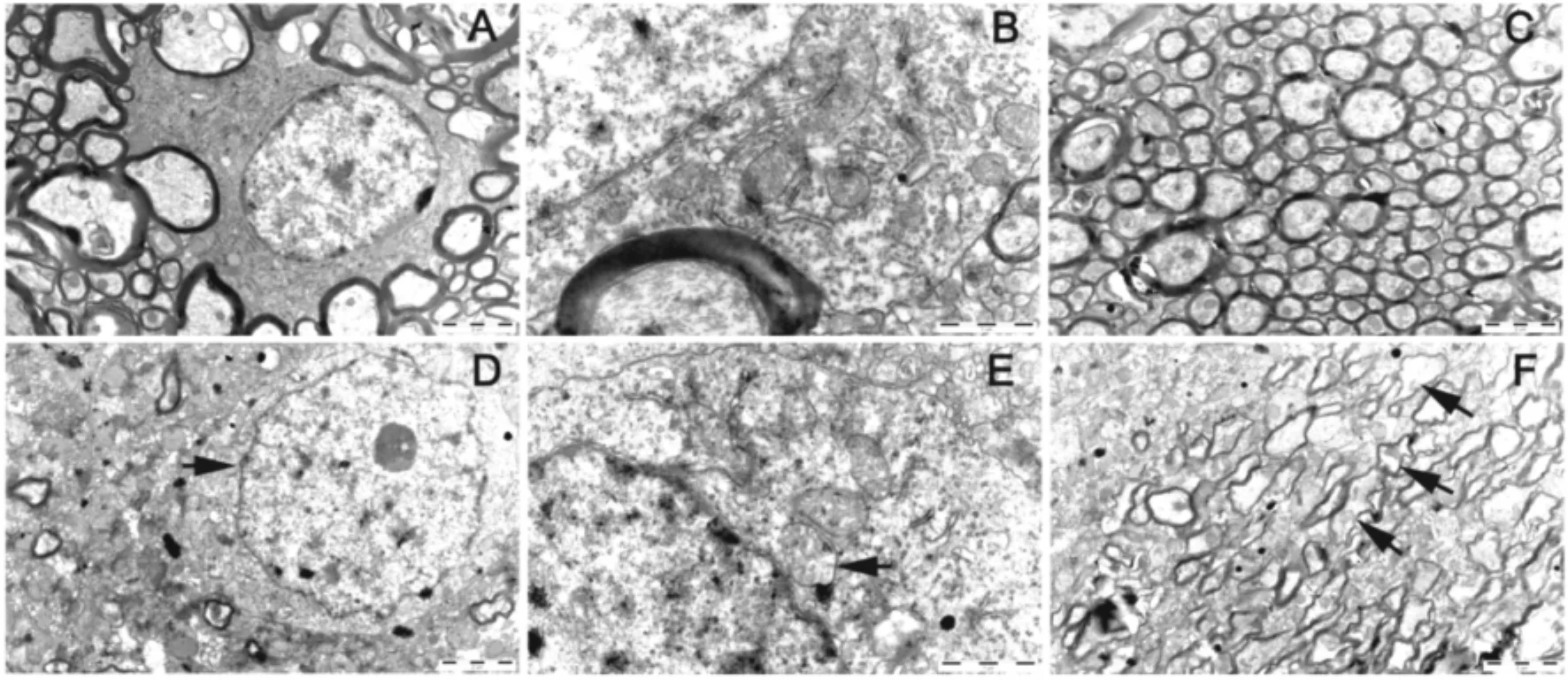
Figure 2.The ultrastructural changes of the neurons and fibers in the striatum.A: control group; B,C: AMPH group at 1 d; D~F: AMPH group at 14 d.The scale bar=2 μm.圖2大鼠紋狀體部位神經元和神經纖維超微結構的變化
討論
本研究顯示,注射苯丙胺后,大鼠行為活動出現異常,自主活動增加,隨著用藥天數的增加,第7天出現刻板行為,而且軌跡圖表明自主活動逐漸被刻板行為取代(未在結果中顯示)。自主行為活動增加與刻板行為的出現主要是腦內DA釋放增加所致,與黑質-紋狀體DA能神經通路密切相關[8]。因此,紋狀體的研究對揭示苯丙胺的中樞毒性機制有重要意義。透射電鏡發現苯丙胺14 d大鼠紋狀體的神經元結構受到損傷,細胞核固縮,線粒體嵴斷裂。說明給予苯丙胺14 d時大鼠的紋狀體受到了較嚴重的損傷。目前認為,苯丙胺對神經元的毒性作用與腦內DA的過量釋放引起的氧化反應密切相關[1]。研究表明,苯丙胺類興奮劑可以通過DA轉運體進入神經末梢,從而取代神經末梢囊泡內的DA,導致DA大量釋放,通過單胺氧化酶和自身的氧化作用,產生超氧化物陰離子和過氧化氫,最終導致神經元的死亡[9]。此外,由于苯丙胺類興奮劑具有親脂性,因此,可以進入線粒體,促使線粒體依賴的凋亡[10],線粒體功能異常可導致能量代謝障礙、鈣離子穩態失調以及產生活性氧等神經元損傷過程。
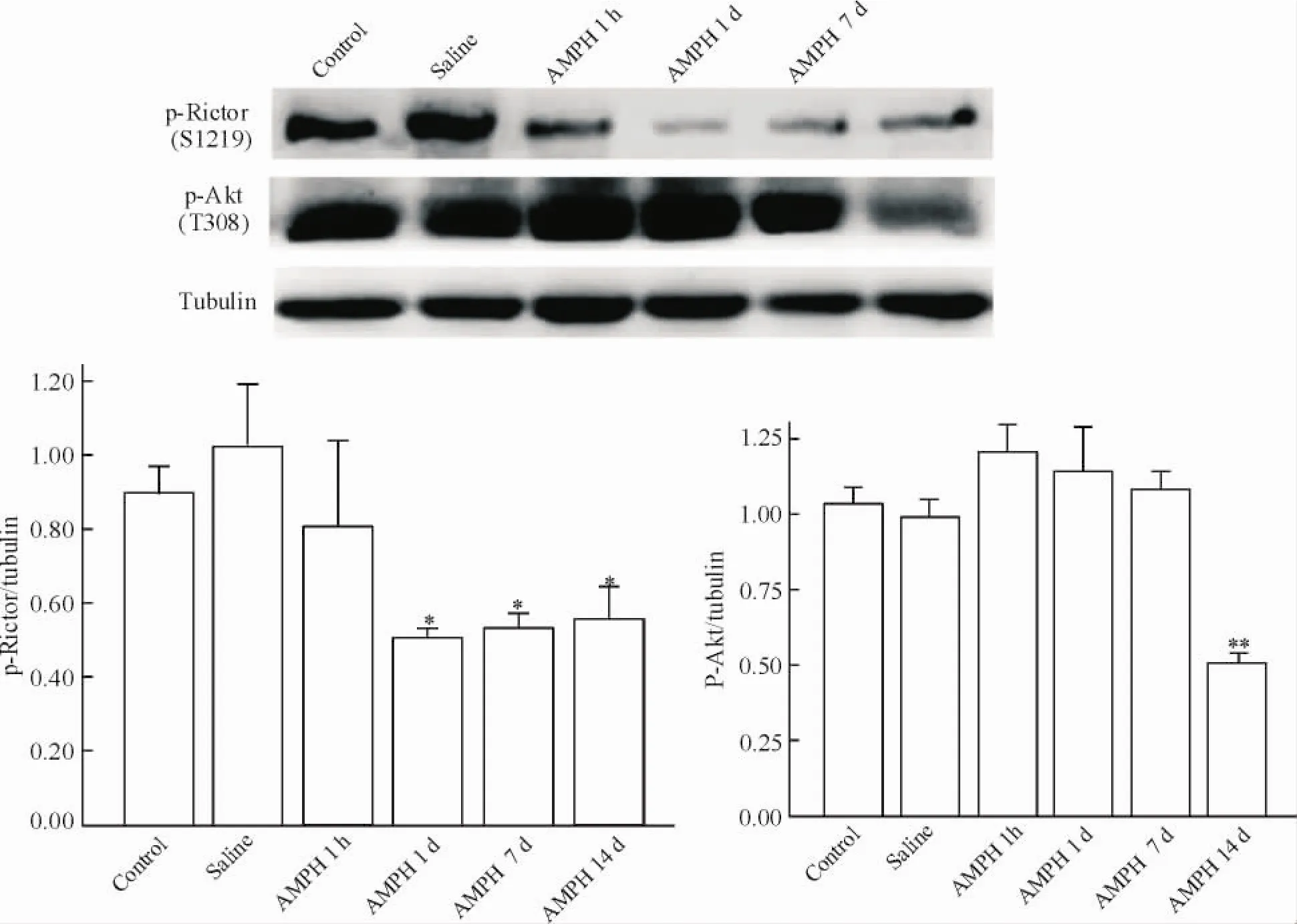
Figure 3.The results of Western blot showed the protein levels of p-Rictor (S1219) and p-Akt (T308) in the striatum.Mean±SD.n=3.*P<0.05,**P<0.01 vs saline.圖3 Western blot示紋狀體p-Rictor及p-Akt蛋白的表達
本研究發現注射苯丙胺1 d后,紋狀體部位mTORC2磷酸化的表達顯著減少,注射至14 d,mTORC2磷酸化的表達也一直處于減少狀態,這說明短期和長期使用苯丙胺都能抑制mTORC2的活性。免疫組化顯示磷酸化mTORC2免疫陽性細胞的數量在7 d后顯著減少,與Western blot結果基本一致。表明mTORC2受到抑制之后,紋狀體的神經細胞才出現損傷,同時提示mTORC2的抑制可能與神經細胞的損傷密切相關。目前,國內外還未見類似報道。由于mTORC2的上游分子不清楚,至今對mTORC2的功能及其信號通路都了解的非常少,因而,對該結果的原因及其機制還不清楚。現已知mTORC2可能通過蛋白激酶C調節肌動蛋白的聚合而影響神經細胞的形態[11],敲除mTORC2的Rictor基因會導致雄性小鼠壽命縮短30%至40%[12]。另外,mTORC2可以直接磷酸化Akt[13]。由于Akt的功能與細胞的增殖和存活有關,它功能的失調會導致癌癥、糖尿病、心血管疾病和神經系統的疾病[14],而且Akt的抑制與神經元的損傷有密切關系[15],故本文檢測了mTORC2下游分子Akt磷酸化的變化。結果表明,注射苯丙胺1 h、1 d和7 d,紋狀體部位Akt (Thr308)磷酸化的表達沒有明顯變化,注射苯丙胺至14 d,Akt(Thr308)磷酸化的表達則顯著減少。Akt的抑制沒有與mTORC2同時發生,而是在mTORC2抑制之后,提示Akt(Thr308)的磷酸化可能對mTORC2的抑制不敏感,呈延后現象。有1篇與本文用藥劑量接近的文獻報道[17],給小鼠注射2 mg/kg苯丙胺,至第8天才觀察到紋狀體Akt磷酸化的表達下降,也說明了苯丙胺可以抑制Akt的活性,但需要較長的時間。此外,Akt的上游分子除了mTORC2外,還有PI3K、CTMP、PHLPP和PP2A 4個分子,推測其中一些分子也可能受到了苯丙胺的影響,導致Akt變化的復雜性,所以Akt的變化沒有與mTORC2同時發生。
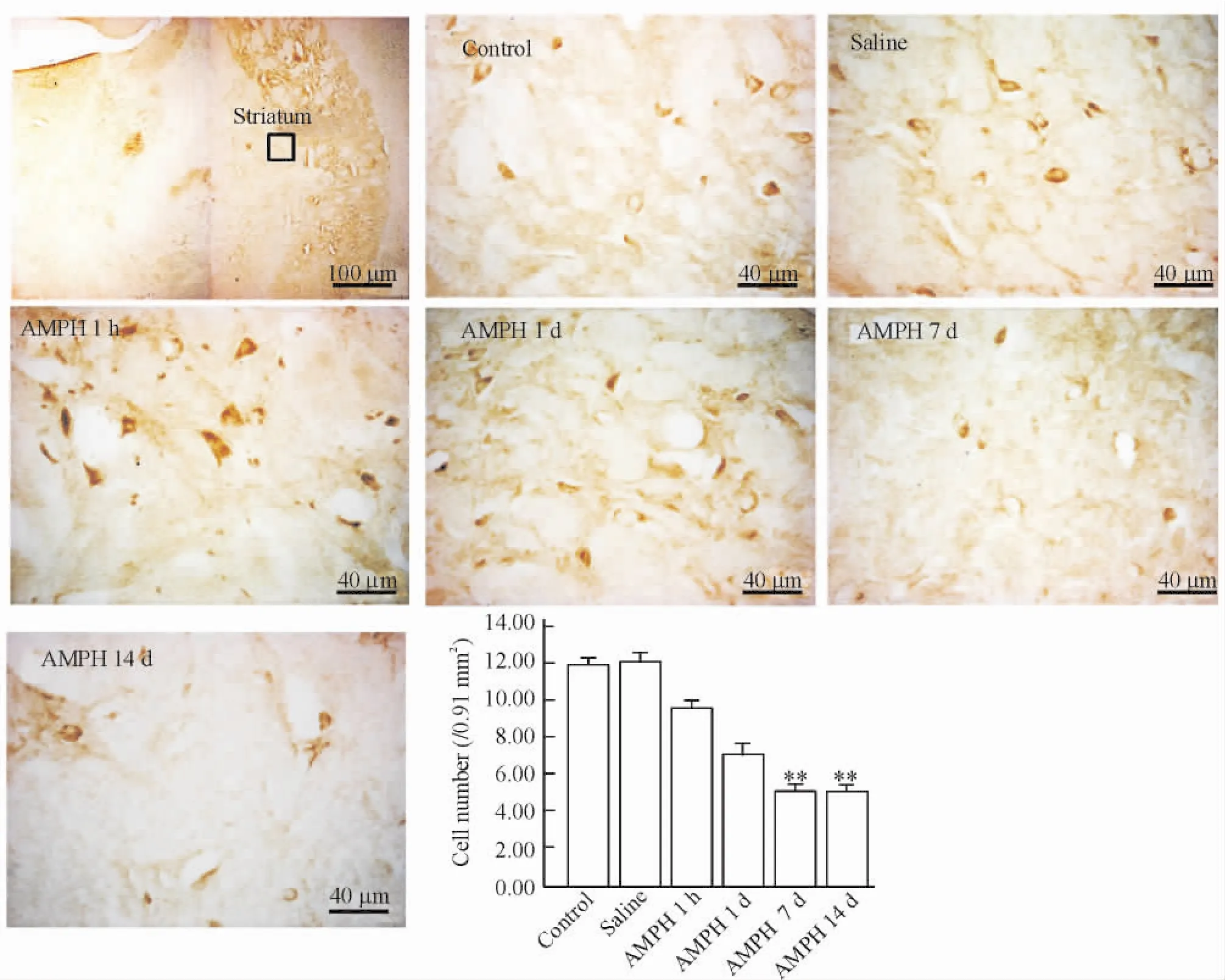
Figure 4.Immunohistochemical staining showed the p-Rictor positive neurons in the straitum.The box in the first image represents the region of magnification in the striatum.Mean±SD.n=5.**P<0.01 vs saline.圖4紋狀體p-Rictor免疫陽性細胞的表達
苯丙胺除了造成紋狀體神經元胞體的損傷,對神經纖維毒性更明顯,電鏡結果表明紋狀體的髓鞘變薄,結構扭曲變形。這可能是長期使用苯丙胺導致精神障礙的一個重要基礎。眾多研究表明精神分裂癥患者腦的髓鞘結構松散或變薄[18-19]。目前認為精神分裂癥患者的主要原因在于神經元之間的聯系出現病變以及神經纖維的髓鞘發生了損傷,因為髓鞘損傷會導致神經纖維傳導失常,從而破壞了神經元活動的同步性,以致神經元活動異常[20]。
綜上所述,苯丙胺進入中樞神經系統后,導致了紋狀體神經元胞體及其神經纖維的損傷,該損傷與苯丙胺抑制mTORC2/Akt信號通路可能密切相關。這提供了一個苯丙胺損傷中樞神經的新機理,同時也說明了苯丙胺可以作為mTORC2的上游分子,其具體作用機理尚不清楚,需要深入研究,以進一步闡明揭示苯丙胺的中樞毒性機制。
[參考文獻]
[1]Cadet JL,Krasnova IN,Jayanthi S,et al.Neurotoxicity of substituted amphetamines: molecular and cellular mechanisms[J].Neurotox Res,2007,11(3-4) :183-202.
[2]Bhaskar PT,Hay N.The two TORCs and Akt[J].Dev Cell,2007,12(4) : 487-502.
[3]Neasta J,Barak S,Hamida SB,et al.mTOR complex 1: a key player in neuroadaptations induced by drugs of abuse [J].J Neurochem,2014,130(2) :172-184.
[4]Barak S,Liu F,Ben Hamida S,et al.Disruption of alcohol-related memories by mTORC1 inhibition prevents relapse[J].Nat Neurosci,2013,16(8) :1111-1117.
[5]Shiota C,Woo JT,Lindner J,et al.Multiallelic disruption of the rictor gene in mice reveals that mTOR complex 2 is essential for fetal growth and viability[J].Dev Cell,2006,11(4) :583-589.
[6]Laplante M,Sabatini DM.mTOR signaling at a glance [J].J Cell Sci,2009,122(20) :3589-3594.
[7]Sams-Dodd F.Phencyclidine-induced stereotyped beha viour and social isolation in rats: a possible animal model of schizophrenia[J].Behav Pharmacol,1996,7(1) : 3-23.
[8]Yates JW,Meij JT,Sullivan JR,et al.Bimodal effect of amphetamine on motor behaviors in C57BL/6 mice[J].Neurosci Lett,2007,427(1) :66-70.
[9]Cunha-Oliveira T,Rego AC,Oliveira CR.Cellular and molecular mechanisms involved in the neurotoxicity of opioidand psychostimulant drugs[J].Brain Res Rev,2008,58(1) :192-208.
[10]Burrows KB,Gudelsky G,Yamamoto BK.Rapid and transient inhibition of mitochondrial function following methamphetamine or 3,4-methylenedioxymethamphetamine administration[J].Eur J Pharmacol,2000,398(1) : 11-18.
[11]Costa-Mattioli M,Monteggia LM.TOR complexes in neurodevelopmental and neuropsychiatric disorders[J].Nat Neurosci,2013,16(11) : 1537-1543.
[12]Lamming DW,Mihaylova MM,Katajisto P,et al.Depletion of Rictor,an essential protein component of mTORC2,decreases male lifespan[J].Aging Cell,2014,13(5) : 911-917.
[13]Sarbassov DD,Guertin DA,Ali SM,et al.Phosphorylation and regulation of Akt/PKB by the Rictor-mTOR complex[J].Science,2005,307(5712) : 1098-1101.
[14]Hers I,Vincent EE,Tavaré JM.Akt signalling in health and disease[J].Cell Signal,2011,23 (10) : 1515-1527.
[15]湯諹,李樹清,李凡,等.缺血后適應對樹鼩海馬CA1區神經元Akt信號轉導調控的機制研究[J].中國病理生理雜志,2011,27(3) :560-565.
[16]Mines MA,Jope RS.Brain region differences in regulation of Akt and GSK3 by chronic stimulant administration in mice[J].Cell Signal,2012,24(7) : 1398-1405.
[17]Uranova NA,Vikhreva OV,Rachmanova VI,et al.Ultrastructural alterations of myelinated fibers and oligodendrocytes in the prefrontal cortex in schizophrenia: apostmortem morphometric study[J].Schizophr Res Treatment,2011,2011:325789.
[18]Flynn SW,Lang DJ,Mackay AL,et al.Abnormalities of myelination in schizophrenia detected in vivo with MRI,and post-mortem with analysis of oligodendrocyte proteins [J].Mol Psychiatry,2003,8(9) :811-820.
[19]Haroutunian V,Katsel P,Roussos P,et al.Myelination,oligodendrocytes,and serious mental illness[J].Glia,2014,62(11) :1856-1877.
通訊作者△Tel: 020-85220251; E-mail: tpsq@ jnu.edu.cn
*[基金項目]國家自然科學基金資助項目(No.81470055)
[收稿日期]2014-12-11
[文章編號]1000-4718(2015)06-1042-06
[中圖分類號]R749
[文獻標志碼]A
doi:10.3969/j.issn.1000-4718.2015.06.014

