血管生成抑制素治療血管瘤的研究
符策奕,張澤華,張愛聯(lián),羅進賢
(1.海南省食品藥品檢驗所,海南 海口 570216;2.中國熱帶農(nóng)業(yè)科學(xué)院熱帶生物技術(shù)研究所,海南 海口 571101;3.中山大學(xué),廣東 廣州 510275)
血管生成抑制素治療血管瘤的研究
符策奕1,張澤華2,張愛聯(lián)2,羅進賢3
(1.海南省食品藥品檢驗所,海南 海口 570216;2.中國熱帶農(nóng)業(yè)科學(xué)院熱帶生物技術(shù)研究所,海南 海口 571101;3.中山大學(xué),廣東 廣州 510275)
目的 觀察血管生成抑制素治療血管瘤的效果。方法發(fā)酵畢赤酵母工程菌組成型表達重組血管生成抑制素,用SP-Sepharose Fast Flow(陽離子交換劑)柱進行蛋白純化;通過抑制雞胚絨毛尿囊膜(CAM)血管生成試驗和誘發(fā)血管內(nèi)皮細胞凋亡試驗,分析重組血管生成抑制素的生物學(xué)活性,在血管瘤模型(公雞肉垂)中注射血管生成抑制素,分析血管生成抑制素對血管瘤的藥效。結(jié)果血管生成抑制素在畢赤酵母中高效表達,經(jīng)過純化,收獲達98%的重組血管生成抑制素;重組血管生成抑制素具有抑制CAM血管生成和誘發(fā)血管內(nèi)皮細胞凋亡的活性;重組血管生成抑制素與血管瘤模型作用14 d后,瘤體血管生長抑制率為51%(P<0.01),血管瘤增殖抑制率為39%(P<0.05)。結(jié)論成功制備重組血管生成抑制素藥物,血管生成抑制素對于血管瘤模型具有顯著的藥效。
血管生成抑制素;治療;血管瘤;效果
血管瘤是以內(nèi)皮細胞增生為特征的腫瘤,是新生兒的常見病與多發(fā)病[1]。血管瘤以體表多見,也常生長于體內(nèi)臟器。血管瘤造成美容缺陷,也可導(dǎo)致功能障礙。血管瘤可有惡性進程特點,可出現(xiàn)諸多的并發(fā)癥,如潰爛、出血、感染等;生長在體內(nèi)的血管瘤壓迫周圍組織,影響臟器功能,如眶內(nèi)血管瘤影響視力[2],縱隔或肺部血管瘤影響壓迫氣道,肝臟或腹腔多發(fā)血管瘤造成臟器受壓[3]。雖然,部分血管瘤可自行衰退,但是,由于存在著不能自行衰退的危險,不僅是那些對身體機能造成危害的血管瘤,即使是那些位于不可能產(chǎn)生功能損害的部位以及慢生長的血管瘤的患者的家長都會選擇治療血管瘤。雖然目前有多種治療血管瘤的措施,例如手術(shù)、冷凍、激光、放射、硬化劑、物理、激素等,但是仍存在著美容效果不理想、并發(fā)癥比例高、副作用大或是不適合于治療體內(nèi)血管瘤等問題[1],尚有待于尋找高效安全的治療血管瘤的藥物。
血管生成抑制因子是具有抑制血管內(nèi)皮細胞增殖的蛋白質(zhì)。血管生成抑制因子對血管的抑制作用特異性高,在抗人癌的臨床試驗證明不產(chǎn)生毒性和抗藥性[4]。而血管生成抑制素是一種重要的血管生成抑制因子,相當(dāng)于纖溶酶原的K1-4功能區(qū)。前期的研究證明該蛋白具有抑制腫瘤血管增殖而達到抗癌的效果[5]。根據(jù)血管瘤的本質(zhì)是毛細血管的異常增生,本文應(yīng)用血管生成抑制素治療血管瘤,以探討其治療效果。
1 材料與方法
1.1 材料 重組了血管生成抑制素基因的畢赤酵母工程菌由中山大學(xué)羅進賢教授實驗室提供(其工程菌的特征是用畢赤酵母的磷酸甘油醛脫氫酶啟動子調(diào)控基因,磷酸甘油醛脫氫酶啟動子是組成型強啟動子[6])。人纖溶酶原抗血清和G418為Sigma公司產(chǎn)品,二抗為上海生物制品研究所產(chǎn)品,陽離子交換SP-Sepharose Fast Flow為Sweden產(chǎn)品,公雞由海南省文昌養(yǎng)雞場提供,人臍帶靜脈細胞購自中山大學(xué)細胞中心。
1.2 方法
1.2.1 重組蛋白的表達 參照Invitrogen公司提供的實驗操作手冊[7]。
1.2.2 重組蛋白的純化 采用陽離子交換層析純化重組蛋白。根據(jù)蛋白的氨基酸序列分別計算其等電點,配制相應(yīng)pH值的磷酸氫二鈉和檸檬酸溶液,用于SP-Sepharose Fast Flow陽離子交換柱的平衡和洗脫。洗脫分三個步驟進行,分別對應(yīng)0.3 mol/L、0.6 mol/L和1 mol/L濃度的Na+離子交換。過柱之后的洗脫液進行SDS-PAGE確認目標蛋白是否被洗脫以及洗脫時所用Na+的濃度。蛋白純度分析參考文獻[8]。
1.2.3 抑制雞胚容貌尿囊膜血管生成試驗 參考文獻[8]的方法。
1.2.4 誘發(fā)血管內(nèi)皮細胞凋亡試驗 參考文獻[8]的方法。
1.2.5 血管瘤模型中用藥 公雞肉垂是天然的血管瘤模型。將雄性2個月齡的10只公雞分為兩組,一組為實驗組,另一組為對照組,每組5只。在實驗組公雞的右側(cè)肉垂注射血管生成抑制素,其藥物用量為5μg/只肉垂,對照組公雞右側(cè)肉垂注射等體積的磷酸鹽緩沖液(PBS)。每2 d用藥一次,共維持用藥2個星期。在用藥期間觀察記錄公雞的體重和肉垂的增殖。計算受試肉垂的生長抑制率。在用藥兩星期后切下其右側(cè)肉垂進行組織切片染色,計數(shù)組織切片中血管的數(shù)量。計算受試肉垂中血管減少率。
1.3 觀察指標與評價方法 本文采用肉垂增殖差異性、體重差異性和血管數(shù)量差異性等數(shù)據(jù)對藥物有效性進行評價,上述數(shù)據(jù)來源為每一只試驗動物試驗前后的肉垂增殖長度差值、體重差值和血管數(shù)量差值。血管瘤生長抑制率=(1-實驗組給藥前后平均血管瘤長度差/對照組給藥前后平均血管瘤模型長度差)×100%;血管增長抑制率=(1-實驗組血管瘤中血管平均數(shù)/對照組血管瘤中血管的平均數(shù))×100%[9]。
1.4 統(tǒng)計學(xué)方法 采用SPSS Statistics 17.0數(shù)據(jù)處理軟件對測試數(shù)據(jù)進行分析。在分析兩組間的肉垂增殖差異性、體重差異性和血管數(shù)量差異性時均先進行正態(tài)性檢驗,并以均數(shù)±標準差(±s)的方式表示,再采用配對t檢驗對兩組的測試數(shù)據(jù)進行分析,以P<0.05表示差異有統(tǒng)計學(xué)意義。
2 結(jié)果
2.1 重組血管生成抑制素 將構(gòu)建的含血管生成抑制素基因的畢赤酵母工程菌接種于YPD培養(yǎng)基中,30℃振蕩培養(yǎng),2 d后取樣,離心取上清液走蛋白電泳(SDS-PAGE)檢查基因表達情況,結(jié)果如圖1所示。由圖1可見,與畢赤酵母發(fā)酵液上清比較,工程菌的發(fā)酵液上清出現(xiàn)符合血管生成抑制素分子量的38 kD的新的蛋白帶。將經(jīng)過重組蛋白純化的血管生成抑制素(純度達98%)進行蛋白印跡,蛋白印跡結(jié)果表明,這條新的蛋白帶能與人纖溶酶原抗血清特異結(jié)合,證明這條蛋白帶是重組血管生成抑制素。

圖1 畢赤酵母工程菌表達重組血管生成抑制素及其蛋白印跡分析
2.2 重組血管生成抑制素對血管內(nèi)皮細胞及CAM血管的作用 如圖2所示,僅加bFGF的對照組的雞胚絨毛尿囊膜(CAM)的載樣濾紙下形成血管叢(平均116條血管),而同時加bFGF和血管生成抑制素的雞胚CAM的載樣濾紙下則形成少血管區(qū)(平均17條血管),t檢驗結(jié)果表明,實驗組與對照組的數(shù)量比較差異具有顯著統(tǒng)計學(xué)意義。血管內(nèi)皮細胞凋亡結(jié)果如圖3所示。當(dāng)血管生成抑制素與人臍靜脈細胞作用24 h,PBS組的血管內(nèi)皮細胞凋亡率為3.5%,而血管生成抑制素組的血管內(nèi)皮細胞凋亡率為82%。血管生成抑制素組的血管內(nèi)皮細胞凋亡率極其顯著高于PBS組的凋亡率。以上實驗結(jié)果表明,在畢赤酵母中表達的血管生成抑制素具有誘發(fā)血管內(nèi)皮細胞凋亡和抑制血管生成的作用。

圖2 重組血管生成抑制素抑制雞胚CAM血管生成

圖3 重組血管生成抑制素誘發(fā)血管內(nèi)皮細胞凋亡
2.3 血管生成抑制素對血管瘤模型的藥效 主要考察血管瘤模型的增長情況,以及血管瘤模型中血管的數(shù)量。如表1所示,在兩周的治療時間里,血管生成抑制素實驗組的血管瘤模型增殖顯著慢于對照組(P<0.05),瘤模型增長抑制率為39%。如圖4和圖5所示,血管生成抑制素治療組的血管瘤模型中的血管數(shù)量極其明顯少于PBS對照組的血管數(shù)量(P<0.01),血管增殖抑制率為51%。表2為受試公雞實驗前后的體重變化,統(tǒng)計學(xué)分析結(jié)果表明兩組的體重增加差異無統(tǒng)計學(xué)意義。以上結(jié)果表明,血管生成抑制素具有抑制血管瘤的血管增殖以及抑制血管瘤發(fā)展的顯著效果。
表1 給藥前后血管瘤模型長度變化比較(±s,cm)
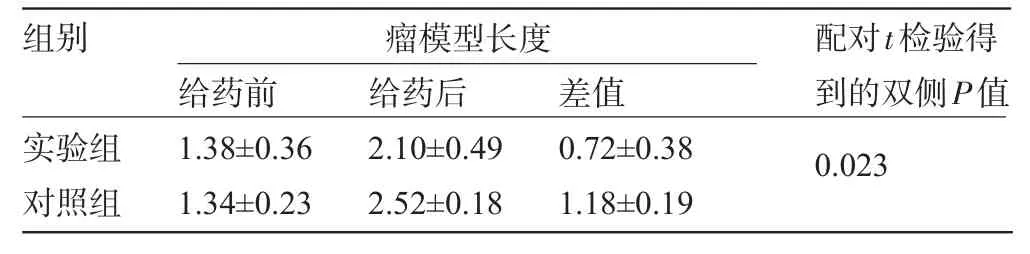
表1 給藥前后血管瘤模型長度變化比較(±s,cm)
實驗組對照組1.38±0.36 1.34±0.23 2.10±0.49 2.52±0.18 0.72±0.38 1.18±0.19 0.023
表2 受試公雞的體重變化比較(±s,g)

表2 受試公雞的體重變化比較(±s,g)
實驗組對照組350±47 420±48 625±73 745±60 275±31 325±47 0.103
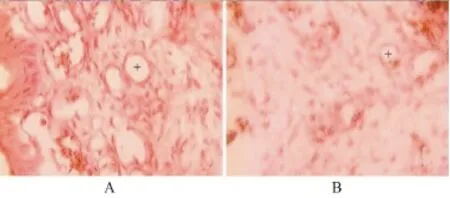
圖4 受試公雞肉垂組織切片(40×)

圖5 實驗后血管瘤中的平均血管數(shù)量
3 討論
在荷瘤的機體中能檢測到血管生成抑制素,但是含量甚微,因此,重組表達是獲得血管生成抑制素的主要途徑。畢赤酵母是廣泛應(yīng)用于表達外源蛋白的菌株,已經(jīng)報道應(yīng)用畢赤酵母的AOX1表達系統(tǒng)表達幾百種外源蛋白。其缺陷在于AOX1表達系統(tǒng)在調(diào)控外源蛋白表達時需要甲醇作為誘導(dǎo)劑,而甲醇是毒性易揮發(fā)物質(zhì)。而后,在畢赤酵母中發(fā)現(xiàn)了GAP啟動子,GAP啟動子是組成型強啟動子。由于GAP啟動子不需要甲醇等毒性物質(zhì)作為碳源,在重組藥物的制備中更為安全[6]。本文成功地實現(xiàn)用畢赤酵母的GAP啟動子調(diào)控表達血管生成抑制素,并經(jīng)純化獲得純度高的血管生成抑制素蛋白,建立了安全高效的生產(chǎn)重組血管生成抑制素的方法。
研究血管生成抑制因子治療腫瘤已經(jīng)有二十幾年的歷程,其作用機理是通過抑制腫瘤誘發(fā)的血管的增殖,切斷腫瘤的營養(yǎng)供給,通過餓死腫瘤而達到治療目的。可見,血管生成抑制因子對于腫瘤的作用是間接的,而血管瘤本身是由血管的異常增生而構(gòu)成,血管生成抑制因子對于血管瘤的作用是直接的作用,直接作用的療效應(yīng)該優(yōu)于間接作用的療效。雞冠及肉垂的真皮內(nèi),尤其是其淺層內(nèi)有許多管腔擴大了的毛細血管網(wǎng)。電鏡下可見連續(xù)性內(nèi)皮及基膜,毛細血管之間有較多的成纖維細胞及膠原原纖維,這樣的雞冠結(jié)構(gòu)與人的血管瘤十分類似,是良好的天然的血管瘤模型[10]。自從Ritter首次研究和應(yīng)用來亨雞的雞冠和肉垂作為血管瘤模型進行治療研究以來[10],國內(nèi)外陸續(xù)有關(guān)于以公雞的雞冠和肉垂作為血管瘤模型而應(yīng)用于血管瘤的治療研究[11-12]。應(yīng)用公雞肉垂這一天然的血管瘤模型,本文研究血管生成抑制素對于血管瘤的治療作用,證明血管生成抑制素能夠通過抑制血管瘤中血管的增殖而抑制血管瘤的發(fā)展,并且對于機體的生長發(fā)育沒有影響,這些結(jié)果體現(xiàn)了血管生成抑制素具有開發(fā)作為安全高效的治療血管瘤藥物的前景。在接下來的研究中,我們將以與人同為靈長類的猴子為載體,將人的血管瘤移植于猴子,作為人的血管瘤模型,深入研究血管生成抑制素治療人血管瘤的效果。為開發(fā)血管生成抑制因子作為治療血管瘤藥物提供進一步的依據(jù)。
[1]Mabeta P,Pepper MS.Hemangiomas-current therapeutic strategies [J].Int J Dev Biol,2011,55(4-5):431-437.
[2]Arora V,Prat MC,Kazim M.Acute presentation of cavernous hemangioma of the orbit[J].Orbit,2011,30(4):195-197.
[3]Papafragkakis H,Moehlen M,Garcia-Buitrago MT,et al.A case of a ruptured sclerosing liver hemangioma[J].Int J Hepatol,2011,11: 55-60.
[4]Eskens FA.Angiogenesis inhibitors in clinical development,where are we now and where are we going?[J].Br J Cancer,2004,90(1): 1-7.
[5]Kim HS,Jeong HY,Lee YK,et al.Synergistic antitumoral effect of IL-12 gene gcotransfected with antianiogenic genes forangiostatin, endostatin,and saxatilin[J].Oncol Res,2014,21(4):209-216.
[6]Zhang AL,Luo JX,Zhang TY,et al.Recent advances on GAP promoter derived expression system of Pichia pastoris.Mol Biol Rep [J].Mol Biol Rep,2009,36(1):1611-1619.
[7]Invitrogen Corp,San Diego.A manual of methods of expression of re-combinant proteins in Pichia pastoris[J].Article First Published Online,2008,31:421-423.
[8]Su DX,Zhang AL,Yi GH,et al.Inducible expression of calreticulin-N58 in Pichia pastoris by high density cell culture[J].Mol Biol Rep,2011,38(8):5003-5008.
[9]杜陽峰.核素標記不同性質(zhì)單抗聯(lián)合蘇拉非尼治療肝癌的動物實驗研究[D].南方醫(yī)科大學(xué),2008.
[10]Ritter EJ,Goldman L,Richfield D,et al.The chicken comb and wattle as experimental model for investigative argon laser therapy of hemangiomas[J].Acta Derm Venereol,1969,49(3):304-308.
[11]Hoffman WL,Anvari B,Said S,et al.Cryogen spray cooling during Nd:YAG laser treatment of hemangiomas.A preliminary animal model study[J].Dermatol Surg,1997,23(8):635-641.
[12]Ma K,Chen SH,Liu QF,et al.Effect of high frequency electrocoagulation by ultrafine-needle on the cutaneous capillary hemangiomas:a preliminary study on cock combs[J].Zhonghua Zheng Xing Wai Ke Za Zhi,2010,26(6):430-434.
Study on treating angeioma by angiostatin.
FU Ce-yi1,ZHANG Ze-hua2,ZHANG Ai-lian2,LUO Jin-xian3.1.Hainan Provincial Institute For Drug and Food Control,Haikou 570216,Hainan,CHINA;2.Institute of Tropical Bioscience and Biotechnology,Chinese Academy of Tropical Agricultural Sciences/Key Laboratory of Biology and Genetic Resources of Tropical Crops,Ministry of Agriculture,Haikou 571101,Hainan,CHINA;3.Sun Yat-sen University,Guangzhou 510275, Guangdong,CHINA
Objective To observe the effect of using angiostatin to treat angeioma.MethodsRecombinant angiostatin was constitutively expressed in Pichia pastoris by fermentation and then purified by SP-Sepharose Fast Flow(cation exchanger).Biological activity of the recombinant angiostatin was analyzed by the tests of suppression angiogenesis of chorioallantoic membrane of chick embry(CAM)and inducing apoptosis of vascular endothelial cells.The drug effect for angeioma was analyzed after injecting recombinant angiostatin into the angeioma model (cock wattle).ResultsAngiostatin showed high-efficiency expression in Pichia pastoris and 98%of recombinant angiostatin had been obtained after the purification.The recombinant angiostatin had activity on suppressing of angiogenesis on CAM and inducing of vascular endothelial cells apoptosis.It's 51%(P<0.01)of the inhibition rate of vascular growth in the angeioma model and 39%(P<0.05)of the inhibition rate of proliferation of the hemangioma model after 14 days of maintenance therapy.ConclusionDrug of recombinant angiostatin had been successfully prepared.Angiostatin possesses prominent effect on the treatment of angeioma.
Angiostatin;Treatment;Angeioma;Effect
R732.2
A
1003—6350(2015)08—1111—04
10.3969/j.issn.1003-6350.2015.08.0398
2014-10-24)
海南省重點科技計劃項目(編號:05204)
符策奕。E-mail:zhangailian6@163.com