宮腔鏡下重度宮腔粘連分解術后兩種防粘連方法效果比較
陳 麗,陳小芳,丁家怡,施蔚虹
(南通市婦幼保健院生殖醫學中心,江蘇 南通 226018)
宮腔鏡下重度宮腔粘連分解術后兩種防粘連方法效果比較
陳 麗,陳小芳,丁家怡,施蔚虹
(南通市婦幼保健院生殖醫學中心,江蘇 南通 226018)
目的 比較重度宮腔粘連患者行宮腔粘連電切術后兩種防止粘連方法的效果。方法62例重度宮腔粘連患者在宮腔鏡下行宮腔粘連電切術,分別采用不同的防止粘連方法。隨機將62例患者分為兩組,其中采用術后置入充水球囊5 d+換置宮內節育器方法者為A組(30例),而采用術后直接放置宮內節育器方法者為B組(32例),兩組術后均給予雌孕激素周期治療,觀察兩組術后第1、2、3個月的月經恢復情況及宮腔形態變化情況。結果A組30例患者中,月經第1、2、3個月的月經量增多者分別為24例(80%)、22例(73.3%)、23例(76.7%),宮腔內形態好轉者26例(86.7%),而B組32例患者中月經第1、2、3個月的月經量增多者分別為17例(53.1%)、15例(46.9%)、14例(43.8%),宮腔內形態好轉者19例(59.4%),提示術后月經恢復正常率A組高于B組(P<0.05),術后宮腔再粘連率低于B組(P<0.05)。結論重度宮腔粘連患者術后置入充水球囊5 d后換置宮內節育器預防術后再次粘連效果優于術后直接放置宮內節育器。
重度宮腔粘連;宮腔粘連電切術;防粘連;充水球囊
宮腔粘連是子宮腔、子宮峽部及宮頸管因宮腔操作或感染等原因造成的腔壁相關粘連[1],臨床主要表現為閉經或月經量減少、周期性腹痛、繼發性不孕及妊娠異常。宮腔鏡下宮腔粘連電切術(TCRA)在直視下有針對性的分離或切除宮腔內粘連[2],使患者恢復正常月經周期,目前已經成為治療宮腔粘連的標準方法[3],但術后宮腔內再粘連也成為臨床治療的棘手問題。為了防止宮腔再粘連,傳統方法是術后放置宮內節育器(IUD)3個月,并給予雌孕激素人工周期治療,以促進子宮內膜修復及增生,但臨床療效仍不是很滿意。有報道稱,先置球囊再置環較單純置環或單純置球囊更為有效預防再粘連[4]。我院從2009年1月起采用宮腔粘連電切術后先放置充水球囊(即Foley導尿管)5 d,后換置宮內節育器以預防再次粘連,與術后直接放置宮內節育器相比,取得較滿意的臨床效果,現報道如下:
1 資料與方法
1.1 一般資料 選取2009年1月至2012年12月在南通市婦幼保健院婦科收治的重度粘連患者62例,隨機將其分為A、B兩組,其中A組30例,年齡平均29.5歲,采用宮腔粘連電切術后先放置充水球囊(即Foley導尿管)5 d,后換置宮內節育器方法;B組32例,年齡平均30歲,采用術后直接放置宮內節育器方法。兩組患者平均年齡比較差異無統計學意義(P>0.05),具有可比性。
1.2 手術方法 所有患者均完善各項術前檢查和化驗,嚴格掌握手術指征,排除手術禁忌證,手術時間均安排在月經干凈后3~5 d(無性生活)。術前1 h給予陰道放置米索前列醇片400μg以軟化和擴張宮頸,選用腰硬聯合麻醉,取膀胱截石位,常規碘伏消毒外陰陰道,在B超監護下探宮腔方向和深度,再用擴宮棒逐號擴張至10號,膨宮壓力選擇110~120 mmHg (1 mmHg=0.133 kPa),均采用環狀或針狀電極電切粘連處,分離后均見宮腔內形態、大小基本正常,雙側輸卵管開口清晰。術畢A組為先放置充水球囊(球囊內注水4 ml),即Foley導尿管,5 d后換置宮內節育器;B組為術后直接放置宮內節育器。所有患者常規術后給予預防性抗感染治療3 d,采用雌孕激素人工周期(戊酸雌二醇片3 mg tid,療程21 d,第17天起加服黃體酮膠囊100 mg bid,療程5 d)治療3個月。術后隨訪第1、2、3個月的月經經量情況,并于術后第3個月月經干凈3~5 d再次宮腔鏡檢查宮腔內形態變化并取環。
1.3 隨訪與評價 所有患者均按要求進行隨訪,術后第1、2、3個月隨訪并記錄月經改善情況,術后第3個月月經干凈3~5 d再次宮腔鏡檢查宮腔內形態變化,并取環。評價宮腔形態變化標準如下:治愈,宮腔鏡下宮腔內形態正常,內膜表面光滑,雙側宮角或輸卵管開口清晰可見;有效,宮腔鏡下宮腔內形態基本正常,但仍見部分粘連,有一側宮角或輸卵管開口不清晰;無效,宮腔鏡下宮腔內形態與分離電切術前無明顯變化[5]。
1.4 統計學方法 采用SPSS16.0統計軟件進行數據統計分析,計數資料采用χ2檢驗,以P<0.05為差異有統計學意義。
2 結果
術后月經恢復正常率A組高于B組,術后宮腔再粘連率A組低于B組,差異均有統計學意義(P<0.05),見表1。
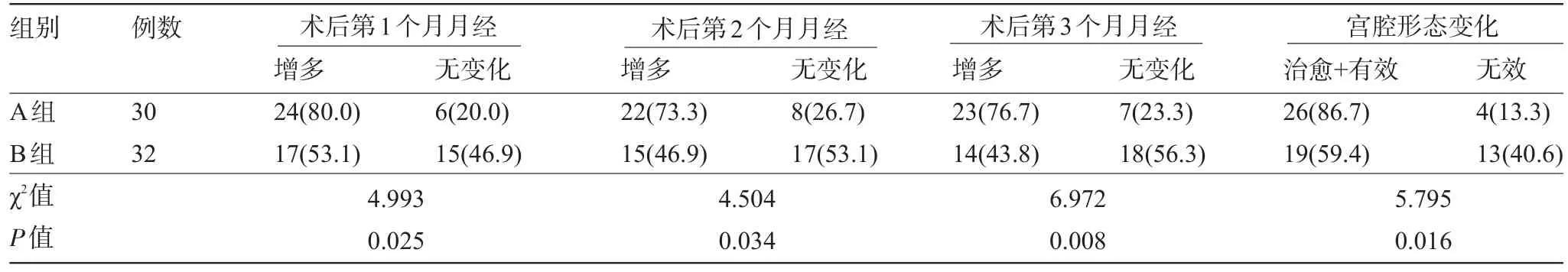
表1 兩組患者術后月經恢復情況及宮腔內形態變化比較[例(%)]
3 討 論
宮腔粘連是指子宮頸及宮腔因放射性、感染及手術操作等原因造成的子宮壁相互粘連。可引起月經量減少、痛經、流產、胎盤植入以及不孕等。大約90%的病例由于流產刮宮引起。宮腔粘連的分級常見4種[6]:(1)MARCH,1978年;(2)美國生殖協會(AFS),1988年;(3)歐洲婦科內鏡學會(ESGE),1995年;(4)臨床+宮腔鏡評分系統,2000年。目前,我院參照的是美國生殖協會(AFS),1988年版的半定型分型。近年來隨著微創技術的發展,宮腔鏡在診治宮腔粘連時顯示了巨大的優勢,可在直視下對宮腔粘連做出準確可靠的診斷,對粘連部位、范圍、程度及組織類型做出估計并同時進行治療,使宮腔恢復正常或基本正常形態,改善患者的月經及生育功能,是診斷宮腔粘連最準確的方法。但是宮腔鏡下粘連分解只能將粘連部位暫時分離,一旦鏡體退出,宮腔前后壁相貼,短時間內可能再次粘連。因此,采取有效的使創面暫時隔離的治療方法成為手術結局的關鍵,也是臨床治療的棘手問題。
為了防止宮腔再次粘連,傳統方法是在宮腔粘連分離術術后放置宮內節育器3個月,并給予雌孕激素周期治療以促進子宮內膜修復和增生,但臨床療效不甚理想,可能與宮內節育器面積有限,不能完全分離子宮前后壁,使子宮前后壁在宮環中間仍有再次粘連的空間和可能有關[6]。文獻報道,此方法對于預防宮腔粘連療效不足50%[7]。故對于重度宮腔粘連,本研究采用宮腔鏡下粘連分解術后先放置充水球囊5 d形成機械屏障,完全分離子宮各側壁,同時開始使用雌孕激素周期治療口服促進子宮內膜增生,迅速覆蓋粘連處之纖維疤痕,加速裸露區上皮化,子宮內膜沿著球囊表面修復、增生,充分引流宮腔內液體,有效防止宮腔內壁閉合后再次粘連[8]。為了防止留置球囊后感染,術后給予預防性抗感染治療,并于5 d后取出,換置宮內節育器進一步形成宮腔內機械屏障,以利于子宮內膜進一步修復、增生。
綜上所述,宮腔粘連電切術后放置Foley導尿管(形成充水球囊4 ml)5 d+換置宮內節育器對預防宮腔內再次粘連效果優于單純放置宮內節育器。雖然目前宮腔粘連分解術后應用生物制劑防粘連的報道也漸增多,如透明質酸鈉、幾丁糖、羊膜等,但臨床使用的安全性、費用問題仍有待于臨床進一步驗證。
[1]鄒明英.宮腔鏡在宮腔粘連診治中的應用[J].中國實用醫藥, 2008,3(11):40-41.
[2]夏恩蘭,夏恩菊,陳嚴軍.行宮腔鏡手術發生嚴重并發癥35例臨床分析[J].中華婦產科雜志,2001,36(4):596-599.
[3]夏恩蘭.婦科內鏡學[M].北京:人民衛生出版社,2001:106-169.
[4]劉明蘭,李 冰.宮腔粘連分離術后3種抗粘連方法預后分析[J].中國實用婦科與產科雜志,2007,23(11):869.
[5]林金芳,馮鐕沖,丁愛華.實用婦科內鏡學[M].上海:復旦大學出版社,2001:389-394.
[6]呂冉冉,李巧云.重度宮腔粘連分離術后預防再粘連的臨床研究[J].實用醫學雜志,2012,28(20):3388.
[7]Preutthipan S,Linasmita V.Reproductive outcome following hysteroscopic lysis of intrauterine adhesions:a result of 65 cases at Ramathihbodi Hospital[J].J medAssoc Thai,2000,83(1):42-46.
[8]方彩云.透明質酸鈉凝膠聯合球囊導尿管在重度宮腔粘連電切術后預防宮腔再粘連中的療效觀察[J].現代中西醫結合雜志,2013, 22(8):838-840.
R713
B
1003—6350(2015)08—1208—02
10.3969/j.issn.1003-6350.2015.08.0432
2014-08-14)
陳小芳。E-mail:yunshang116@126.com