高錳酸鉀復合鹽投加除錳試驗研究
胡文佳 黃麗梅

摘要:試驗采用混凝模擬試驗,人工配置含錳原水,分別投加混凝劑和不同量的高錳酸鉀,并改變高錳酸鉀的投加時間,經過不同混凝條件的混凝沉淀后測定上清液中的錳的質量濃度。結果表明,在適當的投加時間下,高錳酸鉀的投加量為理論值的80%~100%時對錳的去除率達到90%以上,且原水中存在的天然有機物對高錳酸鉀的除錳效果有一定的影響。
關鍵詞:高錳酸鉀;復合鹽;除錳試驗;混凝模擬試驗;混凝劑 文獻標識碼:A
中圖分類號:TU991 文章編號:1009-2374(2015)08- DOI:10.13535/j.cnki.11-4406/n.2015.
近年來,我國幾個大規模的地表水系中不同程度地受到了錳的污染,如長江儀征段水質錳的污染指數為0.77,江西樂安江水系每年錳的平均含量在0.3~0.4mg/L之間。在偏酸和中性pH值范圍內,Mn的主要溶解形態是Mn2+,并且不能被水中溶解氧直接氧化,因此在低pH值水域中Mn2+能以較高的質量濃度穩定存在;在Ph>8.4的水中,Mn2+能被水中的溶解氧氧化為非溶解狀態。目前常規給水處理工藝流程中缺乏有效的除錳措施,造成了出廠水中的錳含量超過國家標準,增加了水的色度,引起黃水、黑水現象,給企業和居民用水帶來了諸多不便。高錳酸鉀是一種有效應用于飲用水處理的強氧化劑,與O3,Cl2、ClO2等相比,高錳酸鉀具有不產生毒副產物、使用經濟方便等優點。此外,高錳酸鉀還原產物MnSO4H2O具有吸附水中Mn2+的能力。本研究利用實驗室混凝模擬裝置,針對原水中不同錳含量,對高錳酸鉀復合劑投加量進行試驗研究。
1 實驗部分
1.1 實驗原理
高錳酸鹽復合劑氧化除去錳,高錳酸鉀是一種強氧化劑,可在很寬的pH范圍內水中的二價錳離子可被高錳酸鉀迅速氧化為四價錳,反應式如下:
2Mn04-+3Mn2++2H2O→5MnO2↓+4H+
水中其他的一些物質也會使一部分高錳酸鉀氧化,這些還原性物質的多少可用CODMn含量的來量化。筆者對金沙蘭水庫原水CODMn含量進行調查分析,其值保持在1.5mg/L以內,即這些還原性物質對高錳酸鉀的消耗量也相對穩定。因此,本實驗以原水中錳含量的高低來確定高錳酸鉀的投加量。
1.2 試劑與儀器
聚合氯化鋁,10%,杭州蕭山三江凈水劑有限公司
錳標準試劑,國家標準物質GBW(E)080157
酸度計,Sartions PB-20
濁度儀,HACH 2100N
原子吸收分光光度計,PinAAcle 900T
混凝試驗攪拌機,ZR 4-6
1.3 實驗用水的制備
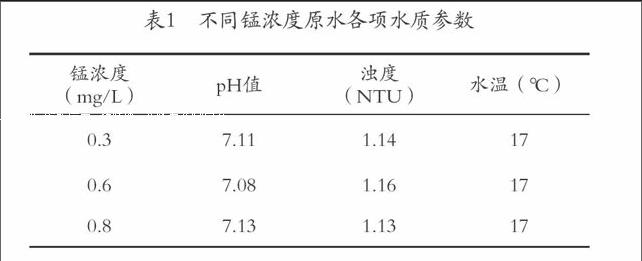
為模擬錳超標原水,本實驗從金蘭水庫取來原水,加入不同濃度的錳標準溶液,各項水質指標見表1:
1.4 試驗方法
試驗采用混凝杯罐試驗,操作程序根據水廠實際工藝條件設定:
取水樣1000mL分別于六個模擬混凝裝置中,選用一系列的藥劑投加量(每個混凝裝置中加入1%濃度的混凝劑PAC0.8mL以及一定量的高錳酸鉀復合鹽),經攪拌和沉淀后,分別取上清液及過濾后水樣測定水質。攪拌速率和攪拌時間按水廠實際工藝條件確定。具體參數
如下:
在400r/min的轉速下攪拌1min,然后加入不同量的高錳酸鉀復合鹽,在400r/min的轉速下快速攪拌2min,然后轉速降至200r/min,繼續攪拌5min,然后進行沉淀。為表述方便,以投加PAC的時刻為T=0時刻。
根據原水中錳濃度不同,調整高錳酸鉀復合鹽投加量,具體投加量如表2所示:
2 結果與討論
2.1 同高錳酸鉀投加量對除去除水中Mn2+效果的影響
水中高錳酸鉀氧化Mn2+,每氧化1mg/L的Mn2+,需要1.92mg/L的高錳酸鉀。所以理論所需高錳酸鉀投加量為[KMnO4]=1.92[Mn2+],即KMnO4濃度為原水中Mn2+濃度的1.92倍,設定該KMnO4投加量為100%投加量。
配置錳濃度為0.3mg/L、0.6mg/L、0.8mg/L的3種實驗原水,高錳酸鉀100%投加量分別為0.5mg/L、1.0mg/L和1.5mg/L。在T=0時刻投加0.8mLPAC和不同量的KMnO4,經過混凝后取上清液及濾后水測定Mn2+濃度,結果如圖1至圖3所示。
圖1、圖2、圖3分別為錳濃度為0.3mg/L、0.6mg/L、0.8mg/L下,投加不同量的KMnO4后Mn2+的去除率。
從圖中可以看出,在理論投加量的17%~100%范圍內,隨著投加量的增加,上清液及濾后水中Mn2+濃度逐漸降低,去除率逐漸提高,且基本呈線性變化趨勢;且當高錳酸鹽投加量在0.5mg/L時,Mn2+去除率最高分別為98.6%、96.7%和97.3%。投加量超過0.5mg/L后,上清液及濾后水中Mn2+濃度略有增加。在理論投加量內,Mn2+的去除率均超過了相應高錳酸鉀理論投加量下的去除值,這是由于混凝過程中形成絮體,其中含有的MnO2.H2O會對水中的Mn2+進行吸附。當超過0.5mg/L投加量后即超過100%理論投加量時,水中KMnO4出現剩余,因此導致上清液及濾后水中Mn2+含量的增加。
2.2 不同投加時間對除Mn效果的影響
配制Mn2+濃度為0.6mg/L的實驗原水,分別在不同時刻投加不同量的KMnO4,經過混凝沉淀測定上清液的Mn2+濃度,繪制不同投加時間對去除率的影響,如圖4,結果表明,在投加混凝劑進行混凝以后再投加KMnO4,其對Mn的去除效率明顯低于在投加混凝劑進行攪拌的同時以在投加混凝劑進行混凝之前投加KMnO4的去除率。在投加混凝劑進行攪拌前投加KMnO4對Mn的去除率稍高于在投加混凝劑進行攪拌的同時投加,提前投加KMnO4的好處在于保證了KMnO4與Mn2+的反應時間,在二者反應生成了懸濁和膠體狀的MnO2H2O,再加入PAC混凝,保證了MnO2H2O能充分形成絮體,因此去除率提高。在投加混凝劑進行混凝以后投加KMnO4,雖然原水中的Mn2+同樣可以反應生成MnO2H2O,但生成的MnO2H2O錯過了絮體形成的最佳時間,因此在混凝以后投加KMnO4對Mn的去除效果不
明顯。
2.3 投加KMnO4后對水質pH的影響
由化學反應式2Mn04-+3Mn2++2H2O→5MnO2↓+4H+可知,KMnO4除錳過程中會生成H+,配制ρ(Mn)=0.6mg/L的實驗原水,分別投加不同濃度KMnO4,測定pH值,結果如圖5所示,可以看出,去除水中的Mn2+,會影響水中的pH值,測定濾后水的濁度和色度,沒有明顯
變化。
2.4 水溫、余氯對除錳的影響
水溫對混凝效果有明顯影響,溫度低,不利于形成絮體,妨礙膠體凝聚。水溫也對水的氧化還原電位產生影響,從而影響除錳的效果。溫度對出水錳去除率的影響如圖6所示:
3 結語
第一,高錳酸鉀氧化混凝沉淀除Mn是一種有效地去除地表水中Mn2+的方法,去除率達到90%以上。使用高錳酸鉀復合鹽可以有效解決原水中錳含量超標問題。且高錳酸鉀復合鹽的投加量隨原水中錳含量的增加相應有所提高。
第二,應該在投加混凝劑的同時或之前投加高錳酸鉀,保證高錳酸鉀和Mn2+有充分的反應時間。
第三,地表水中含有部分還原性物質,會使一部分高錳酸鉀氧化,從而影響Mn2+的去除效果,可適當增加高錳酸鉀投加量。
第四,高錳酸鉀氧化、混凝沉淀除Mn適合現有的自來水廠進行工藝改進,特別適合于原水中Mn季節性超標的水廠。
參考文獻
[1] 王占生,劉文君.微污染水源飲用水處理[M].北京:中國建筑工業出版社,1999.
[2] 張杰,戴鎮生.地下水除鐵除錳現代觀[J].給水排水,1996,22(10).
[3] 袁德玉,楊開,楊小俊,等.高錳酸鉀去除地表水中錳的生產試驗[J].工業用水與廢水,2005,36(3).
作者簡介:胡文佳(1983-),女,浙江金華人,金華市自來水公司檢測中心工程師,碩士,研究方向:環境工程。
(責任編輯:秦遜玉)

