從全基因表達譜角度探討理沖湯抑制人子宮肌瘤細胞的作用機制
韓虹娟 李冬華 錢睿亞 許昕 黃玉華 倪婧 張武芳 耿建國 趙文景
子宮肌瘤(uterine leiomyoma)是女性生殖系統(tǒng)最常見的良性腫瘤,育齡期婦女發(fā)生較多,發(fā)病年齡多為30 ~50 歲,根據(jù)部位的不同,其癥狀以陰道出血、腹部包塊、白帶增多、疼痛及不孕不育等為主,嚴重影響婦女的生活質(zhì)量。迄今為止,子宮肌瘤的發(fā)病原因、病理機制尚不十分明確。西醫(yī)一般認為,其發(fā)生發(fā)展與雌、孕激素及其受體、生長因子、細胞凋亡、癌基因與抑癌基因、細胞免疫等有關(guān)[1]。中醫(yī)多認為子宮肌瘤的發(fā)生與正氣不足、瘀血內(nèi)停有關(guān),治療多選用扶正祛瘀法,且效果顯著。本研究旨在通過觀察扶正祛瘀法的代表方——“理沖湯”對體外培養(yǎng)人子宮肌瘤細胞基因表達譜變化的調(diào)控為切入點,探討理沖湯抑制肌瘤生長的分子機制,為臨床治療提供理論和實驗依據(jù)。
1 材料與方法
1.1 組織來源
取自北京婦幼保健院行子宮肌瘤剔除術(shù)的患者,將切除的肌瘤組織部分送病理檢查,選擇肌瘤組織中間部分做子宮肌瘤原代細胞培養(yǎng)。該患者在手術(shù)前3 個月未接受過激素和其他藥物治療,術(shù)后病理診斷為肌壁間肌瘤。
1.2 主要試劑和儀器設(shè)備
DMEM 培養(yǎng)基(Gibco 公司,批號:NXCO586);胎牛血清(Hyclone 公司,批號:608759);0.25%胰酶(Hyclone 公司,批號:T1300-100);I 型膠原酶(Gibco 公 司);PBS 液(Hyclone 公 司,批 號:NYE0891);TRIZOL 試劑(Invitrogen life technologies,USA,批號:66314);GeneChip(r)PrimeViewTMHuman Gene Expression Array(Affymetrix,USA);GeneChip?3'IVT Express Kit(Affymetrix,USA);Gene-Chip ? Hybridization,Wash,and Stain Kit (Affymetrix,USA);RNA 提取試劑盒(QIAGEN);基因芯片洗脫工作站(GeneChip Fluidics Station 450);基因芯片雜交爐(GeneChip Hybridization Oven 645);基因芯片掃描儀(GeneChip Scanner 3000 7G);PCR 儀(ABI geneAMP? PCR system 7500)。
1.3 藥物血清制備
1.3.1 材料 實驗動物:3月齡SD 大鼠24 只,雌性未孕,體質(zhì)量(220 ±20)g,SPF 級。購自首都醫(yī)科大學(xué)實驗科學(xué)動物部,合格證號為SCXK(京)2012-0001,飼養(yǎng)在首都醫(yī)科大學(xué)實驗動物部SPF 級動物室,正常光照條件,食、水可自由攝取,室溫控制在18 ~22℃之間。隨機將其分為空白對照組,理沖湯組,每組各12 只。
1.3.2 動物灌服藥物的制備 中藥煎煮:理沖湯(生黃芪9 g、黨參6 g、白術(shù)6 g、生山藥15 g、天花粉12 g、知母12 g、三棱9 g、莪術(shù)9 g、生雞內(nèi)金9 g),上述中藥飲片均購自北京同仁堂飲片有限責(zé)任公司。煎熬過程:按上述處方量取中藥飲片,先后水提2 次。第一次加藥材8 倍量水浸泡0.5 小時,煎煮1 小時,煎至將成,加陳醋少許[2];第二次加藥材的6 倍量水煎煮1 小時,煎至將成,加陳醋少許,合并煎液,過濾,減壓濃縮制成含生藥2.28 g/mL 的藥液,低溫(0 ~4℃)保存,用前搖勻。
1.3.3 給藥方法 理沖湯組每天灌服中藥用量為9.12 g/kg,為成人等效劑量,同時空白對照組的大鼠每天灌以等量生理鹽水。連續(xù)給藥3 天,每天分2 次灌服。
1.3.4 血清采集 取血之前禁食12 小時,末次給藥2 小時后,10%水合氯醛腹腔注射麻醉,行心臟取血,3000 r/min、20 分鐘離心分離血清。將同組內(nèi)的血清混合,56℃、30 分鐘滅活,0.22 μm 微孔濾膜除菌后分裝,-80℃保存?zhèn)溆谩?/p>
1.4 細胞培養(yǎng)及給藥方法
1.4.1 細胞原代培養(yǎng) 將子宮肌瘤組織剪碎至1 cm3大小,置于20 mL 含3%雙抗(青鏈霉素)的PBS 中,密閉冰浴運輸。用含3%雙抗的PBS 液對組織進行梯度清洗,在漂洗的過程中盡可能的去除血跡及組織外層可能被污染及壞死的部分;漂洗好后,用無菌吸管將組織小塊及其無血清培養(yǎng)基一起吸入到離心管中,待組織沉淀,棄上清,向管中加入0.2% I 型膠原酶10 mL,37℃水浴消化1.5 ~2 小時后,加入足量的完全培養(yǎng)基終止消化,離心、棄上清,再用70 μm 細胞篩過濾,收集濾液,加入適合濃度的完全培養(yǎng)基接種細胞于培養(yǎng)瓶中,37℃、5%CO2培養(yǎng)箱中進行孵育培養(yǎng)。以后每3 天換液1次。待細胞融合度達80%后,傳代。
1.4.2 含藥血清干預(yù) 取第三代細胞消化,調(diào)整細胞濃度至1 ×107/L,1 mL/孔,接種于24 孔細胞培養(yǎng)板內(nèi),分為空白對照組、理沖湯組。培養(yǎng)12 小時,待細胞貼壁,PBS 液清洗,空白對照組加入含20%無藥血清培養(yǎng)液1 mL,理沖湯組每孔加入20%理沖湯含藥血清[3]的培養(yǎng)液1 mL,37℃,5%CO2培養(yǎng)箱中培養(yǎng)48 小時。
1.5 實驗方法
含藥血清干預(yù)子宮肌瘤細胞培養(yǎng)48 小時后,吸棄培養(yǎng)液,PBS 清洗,每孔加入100 μL 的Trizol,反復(fù)吹打,目視細胞層裂解完全,吸至凍存管中,-80℃保存,干冰運輸,運用基因芯片表達譜檢測法(Affymetrix GeneChip PrimeViewTM Human Gene Expression Array)取待測樣品,進行樣品的RNA 抽提及純化,采用紫外吸收測定法及變性瓊脂糖凝膠電泳進行RNA 質(zhì)量檢測,合成cDNA,最后運用實時定量PCR 進行驗證。
1.6 統(tǒng)計學(xué)處理
基因芯片所有數(shù)據(jù)上傳并進行歸一化處理后運用Two Class Dif 軟件分析系統(tǒng)分析差異表達的基因,GO 分析用于確定差異表達基因的主要功能,并根據(jù)KFGG 和BioCarta 數(shù)據(jù)庫對差異表達基因進行相關(guān)通路分析,RT-PCR 采用ΔΔCt 計算方法。
2 結(jié)果
2.1 含藥血清干預(yù)
將第4 代子宮肌瘤細胞消化成細胞懸液,調(diào)整濃度至1 ×105/mL,每孔100 μL 接種于24 孔培養(yǎng)板,分為空白對照組、理沖湯用藥組,每組6 個復(fù)孔,培養(yǎng)12 小時,待細胞貼壁后,理沖湯組各孔分別加入濃度為20%的含藥血清1 mL,空白對照組各孔加入20%無藥血清1 mL,37℃、5%CO2培養(yǎng)箱中培養(yǎng),分別取含藥血清干預(yù)24 小時、36 小時、48 小時后,用倒置相差顯微鏡在白場下放大200 倍觀察:空白對照組細胞生長未受明顯影響,僅有輕度的肥大增生;理沖湯含藥血清干預(yù)下肌瘤細胞形態(tài)隨干預(yù)時間的變化均出現(xiàn)了明顯的改變,細胞胞漿減少并出現(xiàn)不同程度的萎縮,細胞輪廓變小變圓,細胞之間的連接也變得模糊不清,并且出現(xiàn)部分死亡,尤以48 小時達到抑制的高峰,如圖1所示。
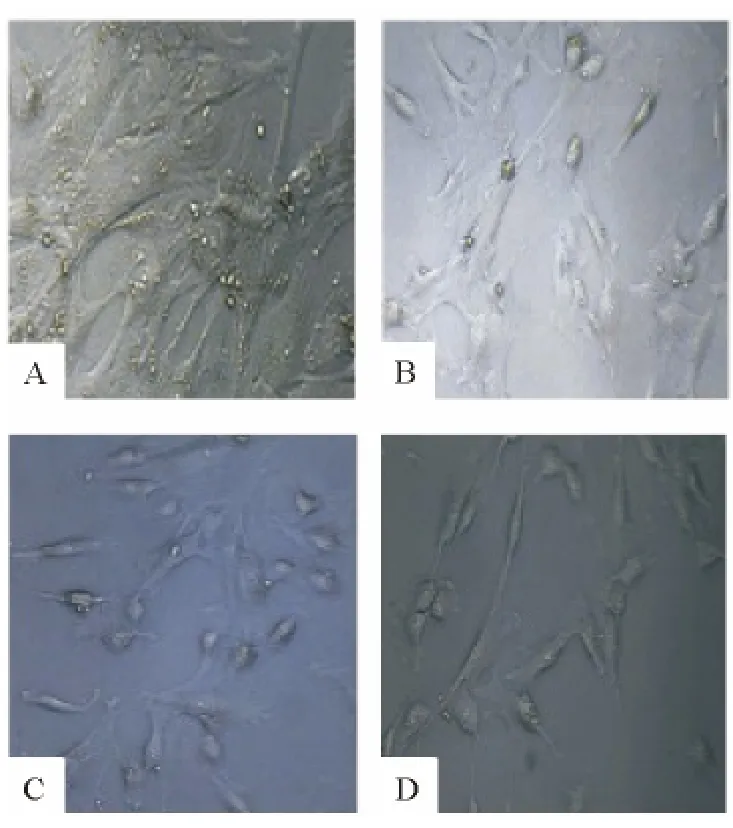
圖1 HE 染色光鏡下觀察含藥血清干預(yù)下細胞形態(tài)變化
2.2 RNA 質(zhì)量檢測
子宮肌瘤細胞總RNA 提取的樣品經(jīng)紫外吸收測定法檢測定量,空白對照組和理沖湯組樣品RNA 溶液的A260/A280 的比值均為1.8 ~2.1,各樣品中蛋白質(zhì)雜質(zhì)少。變性瓊脂糖凝膠電泳分析,各組28S 和18S核糖體RNA 的帶非常亮而濃,上面一條帶的密度大約是下面一條帶的2 倍,無其他大分子條帶,表明總RNA無蛋白質(zhì)污染,無降解,結(jié)果見表1、圖2。
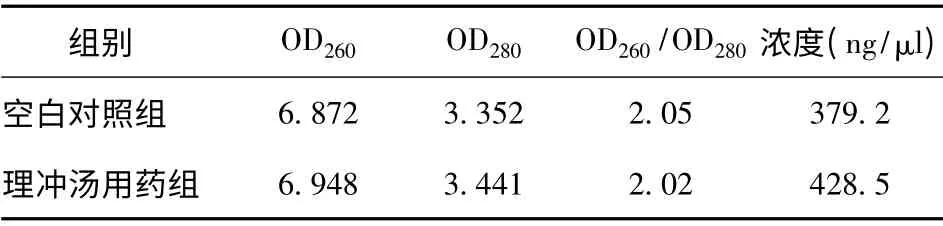
表1 各組RNA 純化后測的濃度
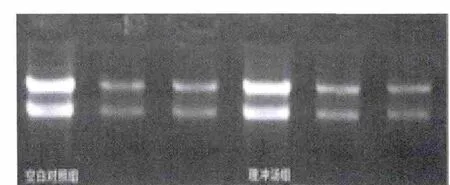
圖2 各組變性瓊脂糖凝膠電泳結(jié)果
2.3 基因表達譜分析
2.3.1 差異基因分析 根據(jù)理沖湯用藥組與空白對照組兩組間基因表達水平分析,選取P <0.05,上調(diào)基因Fold change>1.5 以及下調(diào)基因Fold change <0.5的差異基因,結(jié)果顯示,理沖湯組與空白對照組比較后差異表達基因數(shù)量為1154 個,其中上調(diào)基因630 個,下調(diào)基因524 個,見圖3、4 所示。

圖3 差異基因聚類分析圖
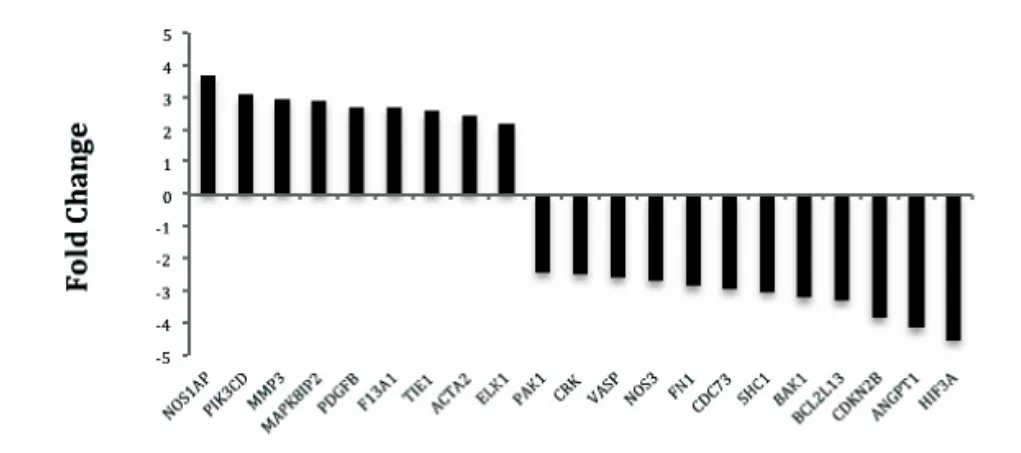
圖4 部分差異基因的變化值
2.3.2 GO 分析 將篩選出的差異表達基因進行GO 分析(P <0.05)發(fā)現(xiàn),富集的GO 功能共有119條,其中上調(diào)的差異基因調(diào)節(jié)的GOs 有45 條,主要涉及信號傳導(dǎo)、細胞凋亡的誘導(dǎo)、細胞增殖的負調(diào)節(jié)、血管生成的負調(diào)節(jié)等多方面的功能,其中下調(diào)的差異基因調(diào)節(jié)的GOs 有74 條,涉及有細胞周期及分化、細胞黏附的調(diào)節(jié)、細胞外基質(zhì)的改變和細胞遷移等方面的相關(guān)功能,見圖5、6,表2所示。
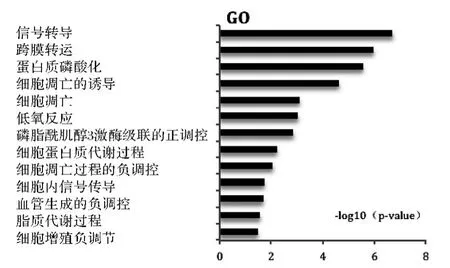
圖5 上調(diào)的差異基因調(diào)節(jié)的部分GOs
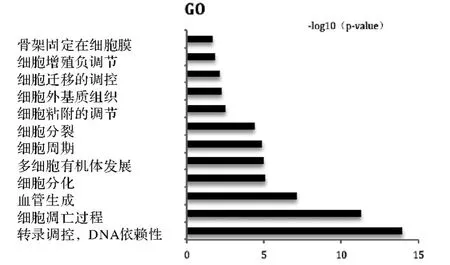
圖6 下調(diào)的差異基因調(diào)節(jié)的部分GOs
2.3.3 信號通路分析 對差異基因進行信號通路分析(P <0.05),結(jié)果顯示,差異基因富集的信號通路共有73 條,其中上調(diào)的差異基因調(diào)控27 條信號通路,包括有細胞凋亡、趨化因子信號通路、白細胞跨內(nèi)皮遷移、細胞因子及細胞因子受體的相互作用等信號通路;下調(diào)的差異基因調(diào)控46 條信號通路,包括MAPK 信號通路、Wnt 信號通路、TGF-β 信號通路p53 信號通路、T 細胞受體信號轉(zhuǎn)導(dǎo)途徑、PI3KAkt 信號通路、HIF-1 信號傳導(dǎo)途徑等,見圖7、8,表3所示。
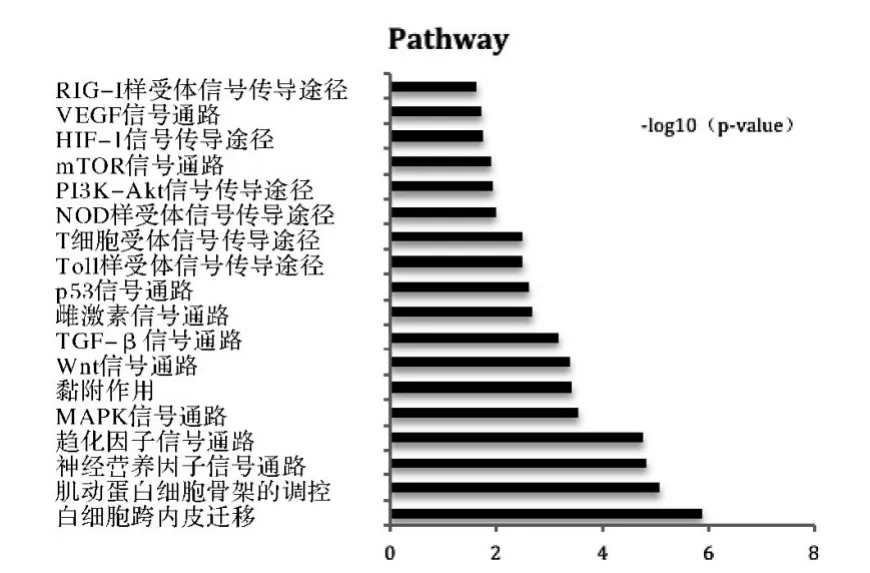
圖8 下調(diào)的差異基因調(diào)節(jié)的信號通路
2.3.4 實時定量PCR(RT-PCR)驗證 選取與子宮肌瘤密切相關(guān)的NOS3、SHC1、FN1、ANGPT1 等4個基因進行RT-PCR 驗證,結(jié)果顯示,4 個基因在實時定量PCR 與基因芯片的表達水平趨勢一致,故可提示基因芯片的結(jié)果基本可靠,見圖9所示。
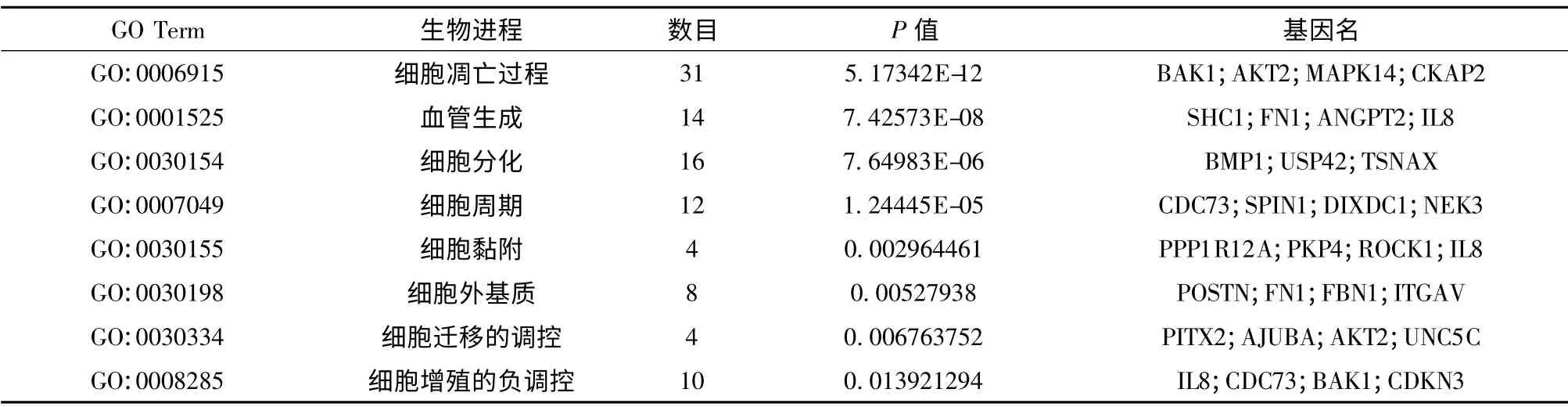
表2 部分差異基因GO 功能注釋結(jié)果
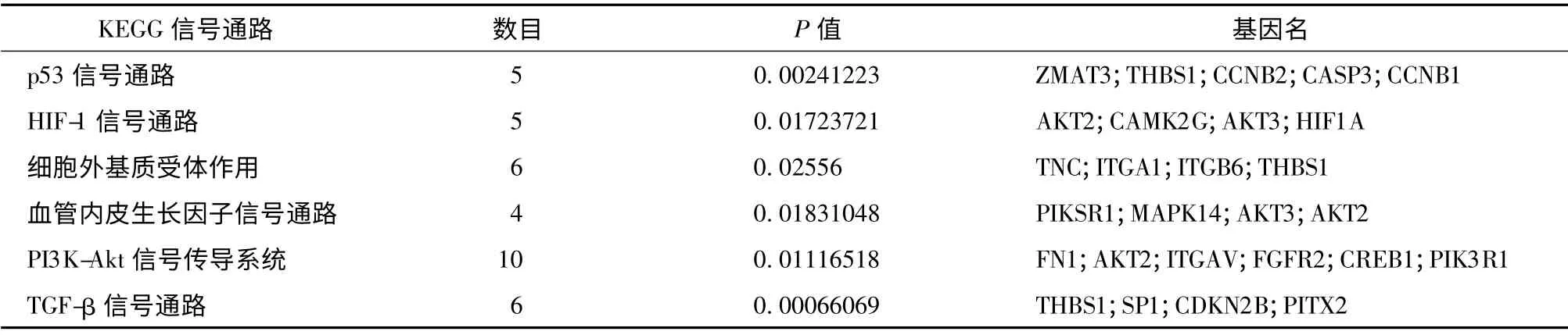
表3 部分差異基因KEGG 通路注釋
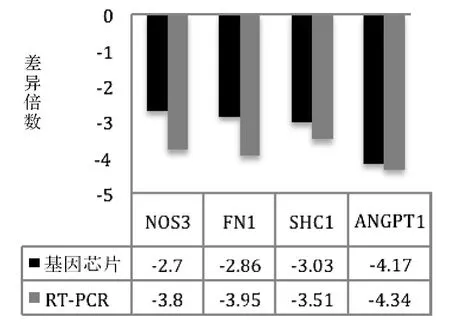
圖9 基因芯片檢測結(jié)果與實時定量PCR 結(jié)果比較
3 討論
“理沖湯”出自清代名醫(yī)張錫純先生之《醫(yī)學(xué)衷中參西錄》,是扶正祛瘀立法治療子宮肌瘤的代表方,方中黨參、黃芪、山藥、白術(shù)益氣健脾;三棱、莪術(shù)、雞內(nèi)金活血破瘀,消癥散結(jié);天花粉養(yǎng)陰解毒,知母涼潤,既可濟參芪之熱,又可滋腎水之枯。溫而不燥,涼而不寒,攻補結(jié)合。全方體現(xiàn)了扶正祛邪兼顧,消癥瘕而不傷正,益氣血而不礙散癥瘕的宗旨。中醫(yī)認為子宮肌瘤是“正虛”為本,“血瘀”為標(biāo),“本虛標(biāo)實”是其病機關(guān)鍵,因此,選用具有扶正益氣、祛瘀消癥功效的理沖湯是治療子宮肌瘤的理想方劑。
通過分析子宮肌瘤細胞在理沖湯的干預(yù)治療下基因表達譜的變化,發(fā)現(xiàn)與細胞凋亡相關(guān)基因Bcl-2、Bak1在理沖湯的治療干預(yù)下呈現(xiàn)表達下調(diào)。B 淋巴細胞瘤白血病-2 蛋白(B-cell lymphoma-2,BCL-2)是一種凋亡抑制基因產(chǎn)物,能夠延長細胞的壽命,并且它能通過與雌激素的相互協(xié)調(diào),共同導(dǎo)致子宮肌瘤的發(fā)生;同時,Palomba 等[4]的研究也證實,肌瘤組織的Bcl-2/Bak 陽性比率顯著高于同源的子宮肌層;Bcl-2 表達陽性率高的細胞壽命長、凋亡緩慢,細胞就會堆積導(dǎo)致腫瘤的發(fā)生[5],說明子宮肌瘤的發(fā)病機制與細胞增殖和凋亡的過程明顯相關(guān),而本課題結(jié)果也顯示子宮肌瘤細胞在理沖湯的干預(yù)下Bcl-2 基因的表達成下調(diào)趨勢,因此有理由認為,理沖湯抑制子宮肌瘤細胞的生長的作用與調(diào)控細胞凋亡的基因表達量下降有關(guān)。
子宮肌瘤的發(fā)生、發(fā)展不僅與細胞的增殖、凋亡調(diào)控紊亂有關(guān),也與局部微環(huán)境中的血管無序生長有關(guān)。如果沒有新生血管生成,腫瘤組織將保持休眠狀態(tài)或發(fā)生退化。血管生長因子在肌瘤的病理機制中主要作用于異常血管系統(tǒng)和纖維瘤的生長與存活,而異常的血管新生又是子宮肌瘤細胞得以不斷增殖的關(guān)鍵因素,因此,抑制相關(guān)血管生長因子的表達,成為了治療子宮肌瘤的潛在策略[6]。促血管生成素(angiopoietins,Ang)是近年來發(fā)現(xiàn)的血管生長因子,主要存在Ang-1、Ang-2、Ang-3 和Ang-4 四種亞型,其中Ang-1 與Ang-2 兩者較活躍。Nakayama等[7]運用免疫組化法檢測1317 例子宮肌瘤的Ang-1表達,其陽性率為76.5%,結(jié)果表明血管生成素在子宮肌瘤的生長、分化中起到重要作用。Ang-1 的作用機制是通過與內(nèi)皮細胞特異性絡(luò)氨酸酶受體(Tie-2)結(jié)合而誘導(dǎo)自身使之磷酸化,隨后促進新生血管周圍支持細胞的聚集,降低血管的通透性,從而促進新生血管穩(wěn)定性的增加。也有文獻顯示,Ang-1 的促血管生成作用也依賴于基礎(chǔ)水平血管內(nèi)皮生長因子(vascular endothelial growth factor,VEGF)的表達,在人臍靜脈內(nèi)皮細胞和成纖維細胞的共培養(yǎng)系統(tǒng)中,成纖維細胞分泌基礎(chǔ)量VEGF,在該系統(tǒng)中加入Ang-1 能促進血管管腔形成,而抗VEGF 和抗VEGFR-2 中和抗體能有效阻斷Ang-1 的作用[8]。理沖湯組的基因芯片分析結(jié)果顯示與血管生成相關(guān)的Ang-1 的表達明顯下調(diào),并且差異基因富集的信號通路也包括有對腫瘤血管生成起重要調(diào)控作用的VEGF信號傳導(dǎo)系統(tǒng),由此可以看出理沖湯治療子宮肌瘤的作用機制可能與下調(diào)Ang-1 的表達,調(diào)控血管生成相關(guān)信號通路,進而抑制腫瘤血管生成有關(guān)。
綜上分析,理沖湯對人子宮肌瘤的治療作用機制主要體現(xiàn)在兩個方面。一是,通過對細胞凋亡相關(guān)基因Bcl-2 等的表達抑制;二是,通過調(diào)控與腫瘤血管生成密切相關(guān)的Ang/Tie-2 信號傳導(dǎo)通路而實現(xiàn)的。因此,深入研究分析這些基因及其參與的信號傳導(dǎo)通路,將有利于進一步了解肌瘤的發(fā)病機制,從而能更好、更有目地的篩選預(yù)測目標(biāo)和干預(yù)位點,為今后在治療子宮肌瘤方面提供新的思路。
[1]Munro MG.Uterine leiomyomas,current concepts:pathogenesis,impact on reproductive health,and medical,procedural,and surgical management[J].Obstet Gynecol Clin North Am,2011,38(4):703-731.
[2]張錫純.醫(yī)學(xué)衷中參西錄[M].北京:人民衛(wèi)生出版社,2010:489.
[3]鄭九波,李冬華,韓虹娟,等.理沖湯對體外培養(yǎng)人子宮肌瘤細胞增殖和形態(tài)的影響[J].中醫(yī)藥導(dǎo)報,2012,18(10):12-15.
[4]Palomba S,Orio F Jr,Russo T,et al.Antiproliferative and proapoptotic effects of raloxifene on uterine leiomyomas in postmenopausal women[J].Fertil Steril,2005,84(1):154-161.
[5]Nakashima T,Tanaka R,Yamashita Y,et al.Aranorosin and a novel derivative inhibit the anti2 apoptotic functions regulated by Bcl-2[J].Biochemical and Biophvsical Research Communications,2008,377(4):1085-1090.
[6]Tal R,Segars JH.The role of angiogenic factors in fibroid pathogenesis:potential implications for future therapy[J].Hum Reprod Update,2014,20(2):194-216.
[7]Nakayama T,Inaba M,Naito S,et al.Expression of angiopoietin-1,2 and 4 and Tie-1 and 2 in gastrointestinal stromal tumor,leiomyoma and schwannoma[J].World J Gastrointestinal,2007,13(33):4473-4479.
[8]Saito M,Hamasaki M,Shibuya M.Induction of tube formation by angiopoietin-1 in endothelial cell/fibroblast co-culture is dependent on endogenous VEGF [J].Cancer Sci,2003,94 (9):782-790.

