風濕祛痛膠囊對大鼠佐劑性關節炎的治療作用及機制
孫璠璠 李 萍 朱志杰 王雨辰 張 月 盧澤原 于曉風 睢大筼
(1 吉林大學藥學院藥理教研室,長春,132001; 2 通化金馬藥業集團,通化,134000)
?
實驗研究
風濕祛痛膠囊對大鼠佐劑性關節炎的治療作用及機制
孫璠璠1李 萍2朱志杰2王雨辰1張 月1盧澤原1于曉風1睢大筼1
(1 吉林大學藥學院藥理教研室,長春,132001; 2 通化金馬藥業集團,通化,134000)
目的:研究風濕祛痛膠囊對大鼠佐劑性關節炎(AA)的治療作用及其可能機制。方法:Wistar大鼠72只,雄性,體重180~220 g,按體重隨機分為以下6組:正常組,AA模型組,風濕祛痛膠囊低、中、高劑量(0.25、0.5、1.0 g/kg)組,萬通筋骨片陽性藥(0.3 g/kg)組。除正常組外,各組大鼠于右后足跖皮下注射0.1 mL弗氏完全佐劑(FCA)制備AA模型。致炎后第2天開始給藥,每天灌胃給藥1次,連續21 d。測定致炎前及致炎后第2、5、8、12、15、18、21、23 d各大鼠致炎足及對側足的足跖容積;測定大鼠腹腔巨噬細胞(PMφ)吞噬功能;檢測血清中超氧化物歧化酶(SOD)活性,丙二醛(MDA)、一氧化氮(NO)、腫瘤壞死因子α(TNF-α)、白細胞介素1β(IL-1β)及白細胞介素6(IL-6)的含量;測定關節滲出液中前列腺素E2(PGE2)的含量;測定血液流變學變化情況。結果:風濕祛痛膠囊能夠顯著抑制大鼠原發及繼發性足跖腫脹,對巨噬細胞吞噬功能、紅細胞壓積及血沉有明顯的抑制作用,能夠顯著增強血清中SOD活性,降低血清中MDA、NO、TNF-α、IL-1β及IL-6的含量;明顯降低關節滲出液中PGE2的含量。結論:風濕祛痛膠囊對大鼠佐劑性關節炎有顯著的改善作用,其機制可能與抑制巨噬細胞吞噬功能、增強機體清除自由基的能力、降低血清中的炎性反應因子水平及改善血液流變學有關。
風濕祛痛膠囊;佐劑性關節炎;大鼠;自由基;炎性反應因子
風濕祛痛膠囊是由川黃柏、蒼術、威靈仙等19味中藥組成的復方制劑,具有燥濕祛風,活血化瘀,通絡止痛功能。用于痹病寒熱錯雜證,癥見肌肉關節疼痛,腫脹,關節活動受限,晨僵,局部發熱,風濕性關節炎、類風濕性關節炎見上述證候者。君藥黃柏為蕓香科植物黃皮樹的干燥樹皮,其苦寒沉降,清熱燥濕,瀉火解毒能力強,歸腎、膀胱經。現代研究表明[1],黃柏具有抗菌、抗炎、解熱、抗癌等多種藥理作用,在醫藥領域有著廣泛的應用和開發前景。蒼術為菊科蒼術屬植物,具有化濕運脾作用,用于燥濕健脾,散寒祛風,風濕痹痛及夜盲等病癥[2]。威靈仙為毛茛科植物,根部入藥用于祛風濕,通經絡,消痰涎,散癖積,對全身游走性風濕痛尤其適宜[3]。雞血藤,為五味子科、菟絲子科、大血藤科、蝶形花科等多種植物的別稱,常與地龍、黃芪、當歸、丹參等配伍,用于治療風濕所致的腰膝關節疼痛、風濕痹痛、肢體麻木[4]等。目前尚未見風濕祛痛膠囊對佐劑性關節炎治療作用的實驗研究報道。本文通過建立AA模型,觀察風濕祛痛膠囊對大鼠佐劑性關節炎的治療作用及潛在機制,為其臨床應用提供實驗依據。
1 材料及方法
1.1 主要試劑 風濕祛痛膠囊,由通化金馬藥業集團股份有限公司提供,批號:20140601;萬通筋骨片,規格:0.28 g/片,由通化萬通藥業股份有限公司生產,批號:140509H;佐劑用卡介苗,規格:60 mg/支,由中國藥品生物制品檢定所生產,批號:201301;SOD、NO測定試劑盒,由南京建成生物研究所提供,生產批號:20140909;MDA測試盒,由南京建成生物研究所生產,批號:20140915;IL-1β、TNF、IL-6測定試劑盒,由北京康源瑞德生物技術有限公司生產,批號:20140925。
1.2 大鼠AA模型的建立 制備FCA[5]:取10 mL熔化的無水羊毛脂與20 mL液體石蠟混合后共研磨1 h,經30 min高壓滅菌后即得弗氏不完全佐劑(FIA),置于4 ℃保存備用。臨用前取10.5 mLFIA于研缽中,將180 mg卡介苗(4.5 mL注射用水溶解)緩慢勻速滴入研缽,邊研邊滴,按同一方向與FIA共研磨約1.5 h,即制為弗氏完全佐劑,備用。正常組大鼠不做任何處理,其余大鼠于右后足跖皮下注射FCA 0.1 mL制備AA模型[6]。
1.3 動物分組及給藥 雄性Wistar大鼠72只,體重180~200 g,按體重隨機分為6組:正常(0.5%羧甲基纖維素鈉10 mL/kg)組,模型(0.5%羧甲基纖維素鈉10 mL/kg)組,風濕祛痛膠囊低、中、高劑量(0.25、0.5、1.0 g/kg)組,萬通筋骨片陽性藥(0.3 g/kg)組。造模后第2天開始灌胃給藥,1次/d,連續21 d。
1.4 測定足跖腫脹程度 于造模前及造模后第2、5、8、12、15、18、21、23 d測定大鼠左、右足跖容積,計算足跖腫脹率[7]。足跖腫脹率(%)=(致炎前足容積-致炎前足容積)/致炎前足容積×100%
1.5 測定腹腔巨噬細胞(PMφ)吞噬功能 造模后第24天,用3%戊巴比妥鈉麻醉大鼠,消毒腹部皮膚后向腹腔內注射15 mL含肝素預冷PBS灌洗,取8 mL腹腔液,離心(1 500 r/min,10 min)后棄上清,用預冷的PBS洗細胞2次后將細胞濃度調節至2.5×106/mL,以100 μL/孔加到96孔板中于培養箱孵育24 h,棄去上清液后以每孔100 μL加入0.075%中性紅染液,孵育15 min后棄去上清,溫PBS洗2次細胞,加巨噬細胞裂解液作用于4 ℃過夜。波長530 nm下用酶標儀測定吸光度[8]。
1.6 測定血液流變學指標 取1 mL已抗凝血加入壓積管中,放置離心機3 500 r/min離心30 min,計算紅細胞壓積。另取已抗凝血1.5 mL測定1 h、2 h血沉率。
1.7 測定相關生化指標 取血于室溫靜置后離心(2 000 r/min,10 min),分離血清于-80 ℃下保存備用。用生化試劑盒測定SOD活性,MDA及NO含量;用放射性免疫分析測定盒測定TNF-α、IL-1β及IL-6含量[9]。
1.8 關節浸出液中PGE2的含量測定 大鼠炎性腫脹足剪碎后浸泡于5 mL生理鹽水中約1 h后離心(2 500 r/min,10 min),取上清液0.3 mL,加2 Ml KOH-甲醇溶液(0.5 mmoL/L)于50 ℃下作用20 min,用甲醇將溶液體積加至20 mL。用紫外分光光度計測定吸光度(波長278 nm)。PGE2的含量表示為每克炎性組織的吸光度值[10]。
2 結果
2.1 風濕祛痛膠囊對足跖腫脹程度的影響 模型組大鼠左、右足腫脹率均顯著增高,與正常組比較,差異具有統計學意義(P<0.01~P<0.001)。風濕祛痛膠囊0.5 g/kg、1.0 g/kg于給藥后第6、10、13、16、19、21 d均可使大鼠右側足腫脹顯著降低,與模型組比較差異具有統計學意義(P<0.05),0.25 g/kg于給藥后第21 d可顯著降低右側足腫脹(P<0.05);風濕祛痛膠囊1.0 g/kg于給藥后第10、13、16、19、21 d顯著降低左側足腫脹(P<0.05),0.5 g/kg于給藥后第16、19、21 d顯著降低左側足腫脹(P<0.05),0.25 g/kg劑量對左側足腫脹無顯著影響(P>0.05),見表1、表2。

表1 風濕祛痛膠囊對右側原發性足腫脹的影響
注:與正常組相比,△P<0.001;與模型組相比,*P<0.05,**P<0.01。

表2 風濕祛痛膠囊對左側繼發性足腫脹的影響
注:與正常組比較,△P<0.01,△△P<0.001;與模型組比較*P<0.05,**P<0.01。

表3 風濕祛痛膠囊對血清MDA含量及SOD活性的影響
注:與正常組比較,##P<0.01;與模型組比較,*P<0.05,**P<0.01。
2.2 風濕祛痛膠囊對巨噬細胞噬功能的影響 模型組巨噬細胞吞噬功能明顯增強,與正常組比較差異具有統計學意義(P<0.05),風濕祛痛膠囊0.25、0.5、1.0 g/kg均可使巨噬細胞吞噬功能明顯降低,與模型組比較差異具有統計學意義(P<0.05),與陽性藥萬通筋骨片作用強度相似,見圖1。
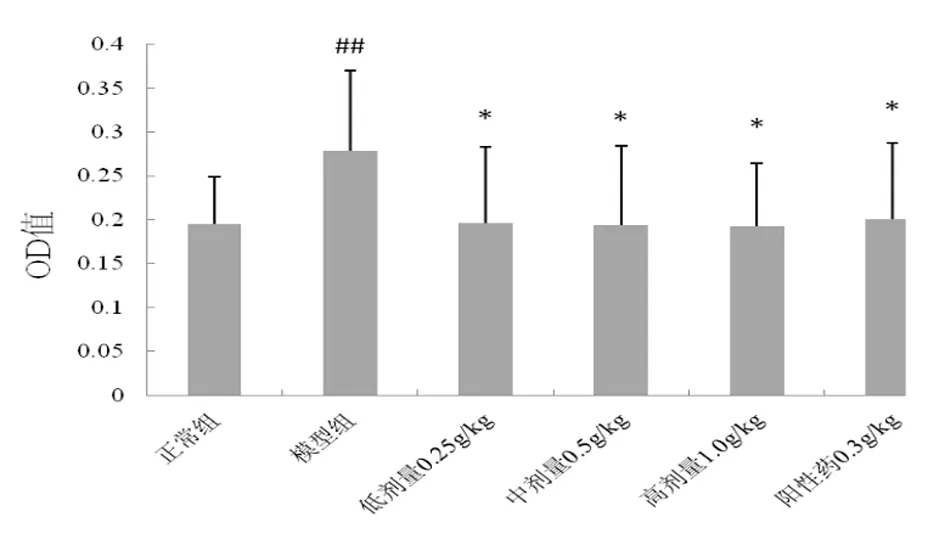
圖1 風濕祛痛膠囊對巨噬細胞吞噬功能的影響
注:與正常組比較,##P<0.01;與模型組比較,*P<0.05
2.3 風濕祛痛膠囊對PGE2在關節滲出液的含量影響 模型組大鼠關節滲出液中PGE2含量顯著升高,與正常組比較差異具有統計學意義(P<0.05),風濕祛痛膠囊0.5、1.0 g/kg可顯著降低PGE2含量,與模型組比較差異具有統計學意義(P<0.05),0.25 g/kg對PGE2含量無明顯影響(P>0.05),見圖2。
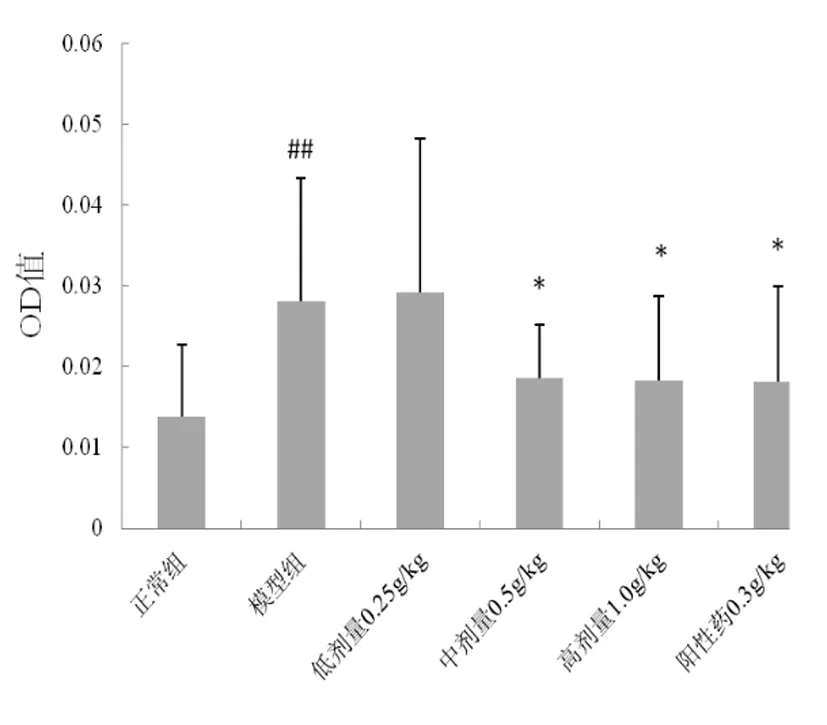
圖2 風濕祛痛膠囊對關節滲出液中PGE2含量的影響
注:與正常組比較,#P<0.01;與模型組比較,*P<0.05
2.4 風濕祛痛膠囊對血液流變學的影響 模型組紅細胞壓積及血沉均顯著升高,與正常比較差異具有統計學意義(P<0.05),風濕祛痛膠囊1.0 g/kg能顯著抑制紅細胞壓積,并使1 h及2 h血沉顯著下降,與模型組比較具有統計學意義(P<0.05),0.5 g/kg劑量能夠顯著降低1h血沉,但對紅細胞壓積及2 h血沉均無顯著影響,0.25 g/kg對紅細胞壓積及1 h、2 h血沉均無明顯影響(P>0.05),圖3及圖4。

表4 風濕祛痛膠囊對血清NO、IL-1β、TNF-α及IL-6含量的影響
2.5 風濕祛痛膠囊對血清MDA含量及SOD活性的影響 模型組血清MDA含量明顯增加,SOD活性明顯降低,與正常組比較差異具有統計學意義(P<0.01),風濕祛痛膠囊0.5、1.0 g/kg均可明顯降低血清中MDA含量,升高SOD活性,且與模型組比較差異具有統計學意義(P<0.05),0.25 g/kg可使SOD活性升高(P<0.05),但對MDA含量無明顯影響(P>0.05),見表3。
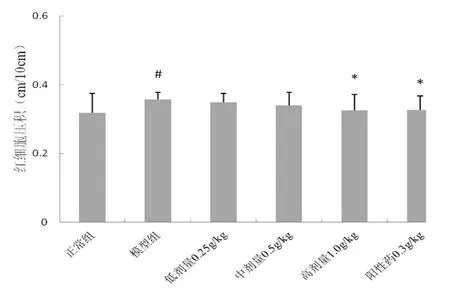
圖3 風濕祛痛膠囊對紅細胞壓積的影響
注:與正常組比較,#P<0.05;與模型組比較,*P<0.05
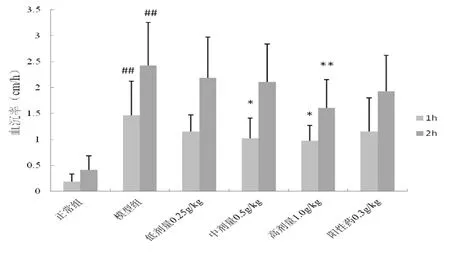
圖4 風濕祛痛膠囊對血沉的影響
注:與正常組比較,##P<0.01;與模型組比較,*P<0.05
2.6 風濕祛痛膠囊對血清NO、IL-1β、TNF-α及IL-6含量影響 模型組血清NO、IL-1β、TNF-α及IL-6含量均明顯增加,與正常組比較差異具有統計學意義(P<0.01或P<0.01),相比于模型組,風濕祛痛膠囊1.0 g/kg可使血清NO、IL-1β、TNF-α及IL-6的含量顯著升高(P<0.05或P<0.01),0.5 g/kg可明顯降低血清中IL-1β、TNF-α的含量(P<0.01),但對NO、IL-6均無明顯影響(P>0.05);0.25 g/kg可明顯降低血清中TNF-α的含量(P<0.05),對NO、IL-1β、IL-6均無明顯影響(P>0.05)。見表4。
3 討論
大鼠佐劑性關節炎(Adjuvant Arthritis,AA)模型在臨床表現、病理學、免疫學改變和病理機制等方面與人風濕性關節炎有許多相似特征,是研究風濕性關節炎病理機制和評價治療該疾病藥物的較理想動物模型[6]。本研究通過建立大鼠AA模型,詳細描述了大鼠AA模型的炎性反應表現特征,以及對與疾病過程相關因子進行了測定。
風濕性關節炎是一種常見的慢性、復發性的自身免疫性疾病,常表現為滑膜組織增生,血管生成,軟骨損毀,骨破壞及關節功能性殘疾。這種系統性疾病是由關節組織持續發炎引起的,進而產生疼痛、僵硬、腫脹及其他多種癥狀[11]。風濕性關節炎在全世界范圍內普遍流行,導致長期殘疾甚至過早死亡,嚴重影響人類生活質量。因此,繼續對該病進行病理生理性及藥理學研究,尋找新型治療藥物顯得尤為重要。通常情況下,臨床上治療風濕性關節炎采用非甾體類的化學合成藥物,例如布洛芬,醋氯芬酸及萘普生,同時配合甾體類激素如可的松和潑尼松。然而,這些藥物僅能暫時緩解炎性反應,減輕癥狀,對疾病的長期治療效果并不明顯[12]。而且,在疾病的治療過程中,由于嚴重的不良反應如胃腸道潰瘍、心血管并發癥、血液毒性及腎衰竭等的影響,許多患者對藥物不再產生任何反應或者不得不被強制終止治療,因此,采用這類藥物治療風濕性關節炎的成效是極有限的[13]。由于這些藥物的治療缺點,尋找新的高效、低毒抗風濕性關節炎藥物成為亟待解決的難題。本研究采用大鼠AA模型,研究風濕祛痛膠囊治療風濕性關節炎的效果及病理機制,結果表明,風濕祛痛膠囊能使大鼠佐劑性關節炎的關節腫脹程度,顯著抑制腹腔巨噬細胞的活化,降低紅細胞壓積及血沉,顯著降低關節滲出液中PGE2含量,能夠使血清中MDA、NO、IL-1β、IL-6及TNF-α含量顯著降低,顯著升高血清SOD活性。
本試驗證明,風濕祛痛膠囊具有良好的抗風濕性關節炎的作用,該作用機制主要與其能夠抑制巨噬細胞活化,降低血清中的炎性因子如IL-1β、IL-6、TNF-α等的含量,提高機體清除氧自由基的能力以及改善機體血液流變學性質等因素有關。
[1]張冠英,董瑞娟,廉蓮.川黃柏、關黃柏化學成分及藥理活性研究進展[J].沈陽藥科大學學報,2012,29(10):812-821.
[2]付紅梅,朱東海,方婧,等.蒼術的化學、分子生藥學和藥理學研究進展[J].中國中藥雜志,2009,34(20):2669-2672.
[3]章蘊毅,張宏偉,李佩芬,等.威仙靈的解痙抗炎鎮痛作用[J].中成藥,2001,23(11):808-811.
[4]符影,程悅,陳建萍,等.雞血藤化學成分及藥理作用研究[J].中草藥,2011,42(6):1229-1234.
[5]馮芳,丁志建,劉俊.佐劑性關節炎大鼠模型的實驗研究[J].天津藥學,2004,16(2):1-4.
[6]李儀奎.中藥藥理實驗方法學[M].2版.上海:上海科學技術出版社,2006:749-751.
[7]李培培,解國雄,宋珊珊,等.大鼠佐劑性關節炎模型表現特征及評價指標[J].中國免疫學雜志,2012,28(5):453-457.
[8]曾陽,馬繼雄,鮑敏,等.藏藥翁布總苷對大鼠佐劑性關節炎的治療作用[J].中國臨床藥理學與治療學,2010,15(12):1321-1325.
[9]高俊,丁真奇.細胞因子在類風濕性關節炎中作用的研究現狀[J].醫學綜述,2006,12(5):289-291.
[10]付雯雯.烏頭注射液對類風濕性關節炎的治療作用及其機制[D].長春:吉林大學,2013.
[11]Lingling Shen,Pingtao Wang,Junhao Guo,et al.Anti-arthritic activity of ethanol extract of Fagopyrum cymosum with adjuvant-induced arthritis in rats[J].Pharmaceutical Biology,2013,51(6):783-789.
[12]Xin-xin Zhang,Yoichiro Ito,Jin-ru Liang,et al.Therapeutic effects of total steroid saponin extracts from the rhizome of Dioscorea zingiberensis C.H.Wright in Freund's complete adjuvant induced arthritis in rats[J].International Immunopharmacology,2014(23):407-416.
[13]Ke Pan,Xiao Xia,Wen-Hua Guo,et al.Suppressive effects of total alkaloids of Lycopodiastrum casuarinoides on adjuvant-induced arthritis in rats[J].Journal of Ethnopharmacology,2015(195):17-22.
(2015-08-31收稿 責任編輯:王明)
Efficacy and Mechanism of Fengshi Qutong Capsule on Adjuvant Arthritis Rats
Sun Fanfan1, Li Ping2, Zhu Zhijie2, Wang Yuchen1, Zhang Yue1, Lu Zeyuan1, Yu Xiaofeng1, Sui Dayun1
(1DepartmentofPharmacology,SchoolofPharmacy,JilinUniversity,Changchun130021,China; 2TongHuaGolden-horseGroup,TongHua134000,China)
Objective:To observe the efficacy of Fengshi Qutong Capsule on adjuvant-induced arthritis (AA) rats and its possible mechanism.Methods:Male Wistar rats (weighing 180~220 g), with the amount of 72, were divided into six groups randomly: control group, AA group, low, medium, high doses (0.25, 0.5, 1.0 g/kg) of Fengshi Qutong Capsule groups as well as Wantong Jingu Pill (0.3 g/kg) positive control group. Except for the control group, the arthritis was induced by a single injection of 0.1 mL of Freund`s complete adjuvant(FCA) into the palmer subcutaneous tissue of the right hind paw. The second day after the onset of arthritis, all the rats were administrated by drugs once per day for 21 days. The swelling symptom of both hind paws on second, 5th, 8th, 12th, 15th, 18th, 21st, 23rd days were examined; arthritis indexes of non-injected paws were assessed; PMφ function was evaluated; the activity of SOD and the contents of MDA, NO, TNF-α, IL-1β, IL-6 in serum were measured as well as the content of PGE2in tissue fluid and the hemorheology changes.Results:The swelling symptom in right hind paw and left hind paw were significantly relieved among the Fengshi Qutong Capsule groups, the function of PMφ, the hematocrit and erythrocyte sedimentation rate declined significantly; the SOD activity increased while the contents of MDA, NO, TNF-α, IL-1β, IL-6 in serum significantly decreased; and Fengshi Qutong Capsule can also significantly help decrease the content of PGE2in inflammatory tissue fluid. Conclusion:Fengshi Qutong Capsule shows satisfactory therapeutic effects on AA rats, its mechanism may be related to the inhibition of PMφ activation, enhancement of the capability of scavenging free radicals, declination of inflammatory elements' levels and the improvement of the changes of hemorheology.
Fengshi Qutong Capsule; Adjuvant arthiritis; Rats; Free radicals; Inflammatory factors
吉林省創新型科技企業項目(編號:20130306048HJ)
睢大筼(1957—),男,吉林長春人,教授,博士生導師,主要從事心血管藥理研究,Tel:(0431)85619705,E-mail:suidy@jlu.edu.cn
R285.5
A
10.3969/j.issn.1673-7202.2015.12.025

