水稻抗白葉枯病基因xa5的原核表達及蛋白純化
范玉龍等
摘 要 水稻是重要的糧食作物,其產量高低與病蟲害等因素密切相關,由黃單胞桿菌引起的水稻白葉枯病是導致水稻產量減少的主要病害之一。控制白葉枯病最安全、經濟有效的方法是培育抗病品種,隱性抗病基因xa5是重要的水稻白葉枯病抗性基因。通過構建顯性及隱性xa5基因的原核表達載體(PGEX-4T-1-Xa5和PGEX-4T-1-xa5),轉化大腸桿菌BL21,經0.2 mmol/L IPTG 28℃ 誘導4 h,表達顯性Xa5和隱性xa5蛋白;結合western-blotting分析,結果表明表達的蛋白是帶有GST標簽的融合蛋白,最后利用谷胱甘肽親和層析柱將蛋白純化,為后期研究xa5基因的功能提供基礎。
關鍵詞 水稻 ;白葉枯病 ;xa5 ;原核表達 ;蛋白純化 ;western-blotting
分類號 S511
Abstract Rice is an economically important crop, the output of rice is closely related to the factors such as plant diseases and insect pests. Bacterial blight (BB) caused by Xanthomonas oryzae pv. Oryzae (Xoo) is one of three most destructive diseases in rice which cased output reduce. The cultivation of varieties with high resistance is considered as the most effective and economical option to control this disease. xa5 recessive resistance gene is an important rice bacterial leaf blight resistance genes. In this study, we construct prokaryotic expression vector(PGEX-4T-1-Xa5 and PGEX-4T-1-xa5), and translate it into BL21, then 0.2 mmol/L IPTG, 28℃, 4 h induced dominant Xa5 and recessive xa5 protein expression. Then in combination with western-blotting analysis, show that the expression of protein is a GST fusion protein and purification of the protein, These results laid a foundation for elucidating characteristic and function of xa5.
Keywords rice ; bacterial blight ; xa5 ; prokaryotic expression ; protein purification ; western-blotting
水稻是重要的糧食作物,全世界約1/2的人口以它為主要糧食[1]。水稻的產量高低與病蟲害等因素密切相關,水稻白葉枯病就是導致水稻產量減少的主要病害之一,白葉枯病發病時一般可造成水稻減產20%~30%,嚴重時會達到50%,甚至絕收[2]。控制白葉枯病最安全、經濟有效的方法就是培育抗病品種,抗性基因的發掘與克隆是培育抗病品種的基礎,因此對水稻白葉枯病抗性基因的研究一直是水稻白葉枯病研究的重點。截至2013年3月,經國際注冊確認和期刊報道的水稻白葉枯病抗性基因共38個[3]。已被定位的抗性基因有26個,并且Xa1、xa5、xa13、Xa21、Xa23、Xa26、Xa27 共7個基因已成功克隆[4]。
在已經發現的38個白葉枯病抗性基因中,有12個是隱性抗病基因,可見隱性抗病基因在白葉枯病抗性資源中起著重要作用。據報道,白葉枯病抗性基因xa5是具有重要研究價值和育種價值的一類新型的隱性抗病基因[5],目前的研究結果表明,xa5基因定位在第5 號染色體上[6];該基因的cDNA全長為906 bp,包含3個外顯子,編碼1個由106 個氨基酸組成的蛋白產物,且該蛋白產物是一個轉錄因子ⅡA的γ亞基(TFⅡAγ)[7-8]。xa5基因與已知抗病基因具有不同的結構,前期的研究結果已經明確了顯性Xa5和隱性xa5開放閱讀框(Open reading frame,ORF)區有2個堿基的差異是導致抗、感差異的功能突變位點[8-9],xa5在抗病品種IRBB5和感病品種日本晴中有2個堿基的差異,導致IRBB5中的第39位的纈氨酸在日本晴及IR24中變成谷氨酸,該氨基酸位點位于蛋白質三維結構的表面,可能與蛋白質之間的相互作用有關。后期Gu等[10]的研究結果發現,基因可影響顯性抗病基因Xa27的抗病性xa5,但目前對xa5基因的抗病機制知之甚少,在蛋白水平對xa5基因的研究報道也很少。鑒于此,本研究試圖表達xa5基因的原核表達蛋白,進而在蛋白水平對xa5基因的抗病機制進行闡釋,此研究將為其他隱性抗病基因機制的研究提供參考與模板,同時有助于生產上更好利用xa5基因培育抗病品種。
大腸桿菌表達系統是目前廣泛應用的一種基因表達系統,它具有遺傳背景清楚、基因操作方便、表達水平高及試驗成本低等優點[11]。因此,利用原核表達對基因進行分析已經成為實驗室中不可或缺的一種方法[12]。本研究成功構建了顯性Xa5基因的原核表達載體PGEX-4T-1-Xa5和隱性xa5基因的原核表達載體PGEX-4T-1-xa5,通過轉化大腸桿菌BL21,0.2 mmol/L的IPTG誘導表達特異蛋白,并利用western-blotting分析確定,最后利用GST標簽純化原核表達蛋白,為后期進一步研究xa5基因的功能奠定基礎。
1 材料與方法
1.1 材料
原核表達載體PGEX-4T-1及大腸桿菌BL21由本實驗室保存;大腸桿菌DH5α購自TaKaRa公司;異丙基-β-硫代半乳糖苷(isopropyl-β-D-thiogalactopyranoside,IPTG)購自中科瑞泰公司;Pyrobest DNA聚合酶和DNA Marker購自TaKaRa公司;限制性內切酶、T4 DNA 連接酶、蛋白markers、GST親和層析柱及谷胱甘肽還原酶購自Fermentas 公司;抗GST標簽鼠單克隆抗體和GST-羊抗鼠IgG購自武漢博士德生物公司。引物合成和測序委托上海生物工程技術服務有限公司完成。
1.2 方法
1.2.1 顯性基因Xa5和隱性基因xa5的PCR擴增及測序
以攜有顯性Xa5的日本晴植株的cDNA和攜有隱性xa5的IRBB5水稻植株的cDNA為模板,以pex-xa5-F-EcoRI(5′GAATTCATGGCCACCTTCGAGCTCTAC′3)和pex-xa5-R-XhoI(5′CTCGAGTTATTGGCTGAGTAGTTTGG′3)為引物,PCR擴增pex-Xa5的基因片段(命名為pex-Xa5)和pex-xa5的基因片段(命名為pex-xa5)。PCR反應程序為:94℃預變性4 min;94℃變性30 s,56℃退火30 s,72℃延伸30 s,30個循環;72℃延伸10 min,擴增產物回收連接到PMD-18T載體上,轉化大腸桿菌DH5α,挑取陽性克隆送測序公司測序。
1.2.2 PGEX-4T-1-Xa5和PGEX-4T-1-xa5原核表達載體的構建
將上述測序正確的陽性克隆的質粒用EcoRI和XhoI雙酶切,回收目的基因片段,與同樣經過EcoRI和XhoI雙酶切的原核表達載體PGEX-4T-1用T4連接酶連接,轉化大腸桿菌DH5α,在含100 μg/mL的氨芐青霉素(Amp)的LB培養基上生長,篩選陽性克隆,提取質粒,雙酶切鑒定,最后送公司測序。
1.2.3 PGEX-4T-1-Xa5 和PGEX-4T-1-xa5誘導表達及可溶性分析
將上述測序正確的重組質粒轉化大腸桿菌BL21感受態細胞,挑取單克隆菌斑,于含有100 μg/mL的氨芐青霉素(Amp)的LB液體培養基中37℃培養過夜,按照1∶100的比例取菌液至新鮮的LB液體培養基中,37℃培養至OD600為0.4左右時,加入終濃度為0.2 mmol/L的IPTG,28℃誘導表達4 h,收集菌體。用10 mmol/L Tris-HCl(pH 8.0)洗滌沉淀2次后重懸菌體,冰上用30%超聲強度破碎5 s,間隔5 s處理樣品10 min。4℃,12 000 r/min 離心10 min, 分離上清和沉淀。取超聲波處理后的上清和沉淀樣品各10 μL,對其進行SDS-PAGE電泳分析。
1.2.4 融合蛋白PGEX-4T-1-Xa5 和PGEX-4T-1-xa5的western-blotting分析
將融合蛋白上清及空載體表達上清進行SDS-PAGE電泳,利用電壓轉膜法,將蛋白轉移到醋酸纖維薄膜(PVDF膜)上,轉膜結束后,取出PVDF膜在TBS中漂洗5 min。接著將PVDF膜移至5%脫脂奶粉封閉液中封閉2 h,室溫慢搖。棄封閉液,TBST洗膜3次。分別用一抗(GST-tag)、二抗(羊抗鼠IgG)室溫輕搖,封閉孵育1 h,按武漢博士德試劑公司要求配制顯色劑,均勻滴加到PVDF膜上,曝光拍照[13]。
1.2.5 融合蛋白PGEX-4T-1-Xa5和PGEX-4T-1-xa5的純化
根據GE公司GST Fusion Protein Spin Purification Kit說明書標準進行改進。取融合蛋白上清10 mL,同時加入100 μL谷胱甘肽層析柱,在混合器上4℃混合2 h。500 r/min,4℃,離心2 min,棄上清,加2 mL PBS洗3次,最后加1 mL PBS混勻,轉移到1.5 mL離心管中,500 r/min,離心1 min,棄上清。加500 μL谷胱甘肽還原酶(濃度為50 mmol/L),混合器上,4℃混合0.5 h,4℃ 500 r/min離心2 min,取上清到1.5 mL離心管中,上清即為純化后的蛋白。取10 μL上樣緩沖液+10 μL上清,對其進行SDS-PAGE跑膠檢測。
2 結果與分析
2.1 顯性基因Xa5和隱性基因xa5的擴增
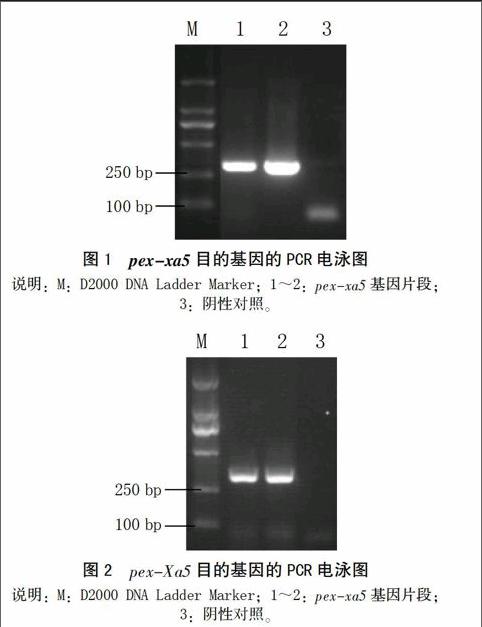
以攜有顯性基因Xa5的日本晴植株的cDNA和攜有隱性基因xa5的IRBB5水稻植株的cDNA為模板,以pex-xa5-F-EcoRI和pex-xa5-R-XhoI為引物,PCR擴增pex-xa5的基因片段(命名為pex-xa5)和pex-Xa5的基因片段(命名為pex-Xa5),結果得到330 bp的目的片段(圖1、2)。
2.2 原核表達載體PGEX-4T-1-Xa5和PGEX-4T-1-xa5的構建
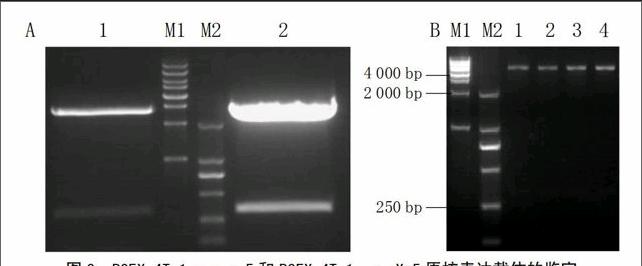
將上述PCR擴增得到的基因片段進行膠回收,并連接PMD-18T載體,轉化大腸桿菌DH5α,挑取陽性克隆,最后送公司測序,將測序正確的菌株搖菌并提取質粒。用EcoRI和XhoI雙酶切的結果見圖3-A,回收目的片段;接著與經過同樣2種酶酶切回收之后的原核表達載體PGEX-4T-1連接,轉化大腸桿菌DH5α,挑取陽性克隆搖菌并提取質粒;然后雙酶切鑒定(圖3-B),結果獲得330 bp的目的片段,說明目的基因已經插入到了PGEX-4T-1表達載體中;最后將陽性克隆的菌株送公司測序,測序結果表明插入基因未發生突變或移碼,說明原核表達載體PGEX-4T-1-Xa5和PGEX-4T-1-xa5構建成功。
2.3 目的蛋白的誘導表達
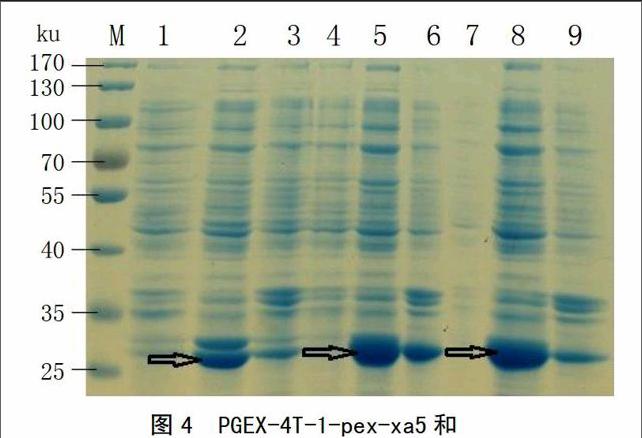
將構建成功的重組質粒PGEX-4T-1-pex-xa5、PGEX-4T-1-pex-Xa5及PGEX-4T-1空載體轉化大腸桿菌表達菌株BL21中,挑取單克隆菌落用0.2 mmol/L的IPTG進行誘導表達,對表達產物進行SDS-PAGE電泳分析(圖4)。結果發現,相對于對照而言,被誘導的PGEX-4T-1-pex-xa5和PGEX-4T-1-pex-Xa5中表達了30 ku左右的特異的融合目的蛋白,PGEX-4T-1空載體表達了其特有的26 ku左右的GST標簽蛋白,且都在上清中大量存在,說明表達的原核蛋白是可溶的。
2.4 western-blotting分析
將上述誘導表達的PGEX-4T-1-pex-xa5、PGEX-4T-1-pex-Xa5及PGEX-4T-1空載體蛋白進行western-blotting分析,結果出現了單一的條帶(圖5),進一步說明上述誘導表達的蛋白確實是帶有GST標簽的目的蛋白。
2.5 目的蛋白的純化
為了進一步研究上述表達的融合目的蛋白,利用谷胱甘肽層析柱過柱純化融合蛋白(圖6),純化的目的蛋白單一,無雜帶,可滿足后期的實驗要求。
3 討論與結論
本研究采用了最常用的PGEX-4T-1原核表達載體的原核表達系統,該系統表達的融合蛋白帶有GST標簽,可通過親和層析與固定在基質上的谷胱甘肽結合。GST與谷胱甘肽之間的高特異性結合確保了單個步驟就能獲得高純度的目的蛋白[14],因此,本研究利用已知的xa5的序列,設計引物,擴增得到顯性Xa5和隱性xa5基因序列,并成功構建了PGEX-4T-1-pex-xa5和PGEX-4T-1-pex-Xa5原核表達載體,為后期的融合蛋白的純化奠定基礎。
目前能夠影響外源基因在大腸桿菌中穩定表達的因素有很多,如大腸桿菌菌株、誘導劑濃度、溫度和誘導時間等[12]。前人通過原核表達獲得目的融合蛋白的研究已有很多,如鄧治等[15]通過構建pET28a-HbADF、轉化大腸桿菌BL21、1 mmol/L IPTG誘導表達了橡膠樹肌動蛋白解聚因子HbADF融合蛋白。Fan等[16]用0.8 mmol/L的IPTG,18℃誘導20 h后,獲得了可溶性表達的CAD蛋白。基于前人的研究基礎,本研究采用了適度低溫(28℃)及較低含量的IPTG(0.2 mmol/L),誘導4 h,成功誘導表達了30 ku左右的目標蛋白;經SDS-PAGE跑膠分析,該蛋白在上清中大量表達,說明表達的融合蛋白為可溶性蛋白,并未形成包涵體。充分說明試驗中所使用的誘導條件可很好的誘導xa5和Xa5基因的表達,并且蛋白表達量較高,可滿足后期的實驗要求。對表達的特異融合蛋白利用GST標簽抗體進行western-blotting分析,結果有特異性反應,說明構建的載體是帶有GST標簽的融合蛋白。為了后期能夠更好地研究和利用表達的融合蛋白,利用GST親和層析柱純化了目的蛋白,純化后的目的蛋白條帶特異且無雜帶,說明純化后的蛋白純度較好,可為后期在蛋白水平研究xa5基因的功能奠定基礎。
參考文獻
[1] Khush G S. What it will take to feed 5.0 billion rice consumers in 2030[J]. Plant Mol Biol, 2005,59(1):1-6.
[2] Mew T W. Current status and future prospects of research on bacterial blight of rice[J]. Annual Review of Phytopathology, 1987, 125(3):539-582.
[3] Wang C L, Fan Y L, Zheng C K, et al. High-resolution genetic mapping of rice bacterial blight resistance gene Xa23[J]. Molecular Genetics and Genomics, 2014, 289(5): 745-753.
[4] 陳小林,顏 群,高利軍,等. 水稻白葉枯病抗性基因Xa21的分子生物學研究進展[J]. 生物技術通報,2014,30(1):8-14.
[5] 鐘義明,江光懷,陳學偉,等. 水稻含隱性抗白葉枯病基因xa5的24kb片段的鑒定與基因預測[J]. 科學通報,2003,48(19):2 057-2 061.
[6] Blair M W, McCouch S R. Microsatellite and sequence-tagged site markers diagnostic for the rice bacterial leaf blight resistance gene xa-5[J]. Theoretical and Applied Genetics 1997, 95(1-2): 174-184.
[7] Jiang G H, Xia Z H, Zhou Y L, et al. Testifying the rice bacterial blight resistance gene xa5 by genetic complementation and further analyzing xa5 (Xa5) in comparison with its homolog TFIIAγ1[J]. Mol Genet Genomics, 2006, 275(4): 354-366.
[8] Iyer A S, McCouch S R. The rice bacterial blight resistance gene xa5 encodes a novel form of disease resistance[J]. Mol Plant-Microbe Interact, 2004, 17(7): 1 348-1 354.
[9] Iyer-Pascuzzi A S, Jiang H, Huang L, et al. Genetic and functional characterization of the rice bacterial blight disease resistance gene xa5[J]. Phytopathology, 2008, 98(3):289-295.
[10] Gu K Y, Tian D, Qiu C, et al. Transcription activator-like type III effector AvrXa27 depends on OsTFIIAγ5 for the activation of Xa27 transcription in rice that triggers disease resistance to Xanthomonas oryzae pv. oryzae[J]. Molecular Plant Pathology, 2009, 10(6):829-835.
[11] Xia L H, Bing X G, An X T, et al. Serum cystatin C assay for the detection of early renal impairment in diabetic patients[J]. Journal of Clinical Laboratory Analysis, 2004, 18(1):31-35.
[12] 李 波,倪志勇,李曉東,等. 棉花GhCOMT1基因原核表達載體構建及蛋白純化和western[J]. 西北植物學報,2012,32(10):1 971-1 976.
[13] 楊安鋼,劉新平,藥立波. 生物化學與分子生物學實驗技術[M]. 北京:高等教育出版社,2008:6.
[14] Gnidehou S, Gerbaud P, Ducarme G, et al. Expression in Escherichia coli and purification of human recombinant connexin-43, a fourpass transmembrane protein[J]. Protein Expr Purif, 2011, 78(2):174-180.
[15] 鄧 治,杜 磊,李德軍. 橡膠樹肌動蛋白解聚因子原核表達及純化[J]. 熱帶作物學報,2014,35(2):277-281.
[16] Fan L, Shi W J, Hu W R. Molecular and biochemical evidence for phenylpropanoid synthesis and presence of wall-link phenolics in cotton fibers[J]. Journal of Integrative Plant Biology, 2009, 51(7): 626-637.

