聯合自噬抑制劑增加PI3K/mTOR抑制劑NVP-BEZ235誘導的結腸癌細胞凋亡
斯慶圖娜拉
(鄂爾多斯市中心醫院,內蒙古鄂爾多斯017000)
聯合自噬抑制劑增加PI3K/mTOR抑制劑NVP-BEZ235誘導的結腸癌細胞凋亡
斯慶圖娜拉
(鄂爾多斯市中心醫院,內蒙古鄂爾多斯017000)
目的探討自噬對I3K/mTOR抑制劑NVP-BEZ235誘導的人結腸腺癌DLD1細胞凋亡的影響。方法PI3K/mTOR抑制劑NVP-BEZ235和(或)自噬抑制劑3-MA處理人結腸腺癌DLD1細胞,MTT法檢測細胞生存率,流式細胞術檢測細胞凋亡率的變化,Western Blot檢測凋亡相關蛋白的表達。結果 不同濃度的NVP-BEZ235作用于人結腸腺癌DLD1細胞24h后,MTT及流式細胞術結果顯示,明顯地抑制了細胞增殖,并增加了細胞凋亡率,同時觀測到凋亡相關蛋白Caspase-3表達升高;采用3-MA特異性抑制自噬活性后,明顯地增加了NVP-BEZ235誘導的細胞凋亡率;同時,檢測到凋亡相關蛋白Caspase-3的表達上調。結論 自噬在NVP-BEZ235誘導的人結腸腺癌DLD1細胞凋亡的過程中起保護作用,3-MA抑制自噬后,促進了NVP-BEZ235誘導人結腸腺癌DLD1細胞凋亡,聯合應用PI3K/mTOR抑制劑NVP-BEZ235和自噬抑制劑3-MA有望成為人結腸癌的新治療策略。
自噬;PI3K/mTOR抑制劑NVP-BEZ235;3-MA;凋亡;人結腸癌
(Chin J Lab Diagn,2015,19:1632)
隨著癌癥的發病率逐年增加,目前結直腸癌也已逐漸成為了常見的癌癥之一[1]。早期的結直腸癌患者能夠通過手術進行治療;而大部分結直腸癌被診斷時已處于晚期階段,因而化療成為輔助外科手術治療晚期結直腸癌患者的主要手段[2]。然而,化療對于晚期階段的結直腸癌治療的效果并不理想,并且逐漸出現化療藥物耐受現象。因此,研究出有效治療結直腸癌患者的新藥物成為主要的問題。
NVP-BEZ235,是一種新型的PI3K和mTOR的雙重抑制劑,能夠特異性的抑制PI3K和mTOR的活性[3]。最近幾年,在癌癥的研究中,PI3K/AKT/mTOR信號通路已經成為的研究的熱點[4]。PI3K/AKT/mTOR信號通路作為許多信號的上游因子,能刺激大量的下游效應器活化,因此能夠介導細胞存活和生長[4]。因此,這個信號的異常的活化在惡性腫瘤中也是常見[5]。PI3K和mTOR除了參與細胞增殖外,還可以抑制細胞自體吞噬(autophagy)的發生[6];自噬是細胞的溶酶體降解的通路,它能夠維護細胞的內穩態,對于細胞存活的調控是必要的[7]。自噬的一個關鍵的調控因子是mTOR,在生成因子和營養豐富的條件下,mTOR的抑制能夠誘導自噬的發生[8]。自噬發揮促存活或者促死亡的作用依賴于環境條件,因此在癌癥的治療上發揮了雙刃劍的作用。自噬吞噬的發生往往對于化療藥物引起的凋亡表現出一定的保護作用,因此,聯合應用NVP-BEZ235和自噬抑制劑可能可以明顯的提高NVP-BEZ235引起的結腸腺癌細胞凋亡。
1 材料與方法
1.1 材料
1.1.1 試劑 自噬抑制劑3-MA和噻唑藍MTT購自美國Sigma公司,PI3K/mTOR抑制劑NVPBEZ235購自LC Laboratories公司,AnnexinV/PI雙染的凋亡試劑盒購于Invitrogen公司,鼠抗人βactin單抗、兔抗人Caspase-3多抗購于Santa Crus公司,ECL顯色液購自Thermo Scientific公司。
1.1.2 細胞株 人結腸腺癌DLD1細胞株購于美國ATCC細胞庫,細胞培養于含有100U/ml青霉素和鏈霉素的RPMI-1640+10%FBS的培養液中,于37℃、5%CO2的細胞培養箱培養。
1.2 實驗方法
1.2.1 MTT法檢測細胞的增殖率 選取生長狀態良好的對數期人結腸腺癌DLD1細胞,以每孔含有8000個細胞的濃度接種于96孔板,待24h后細胞完全貼壁,換成含有不同藥物濃度的培養液,每孔200μl,待藥物處理24后,每孔中加入20μl的MTT(5mg/ml),于孵箱中孵育4-6h,選擇酶標儀上490nm波長測定各孔的吸光值,計算出細胞生存率。
1.2.2 流式細胞儀技術檢測細胞的凋亡率 選取生長狀態良好的對數期人結腸腺癌DLD1細胞,以5×105個細胞/孔接種于6孔板中,培養24h后待細胞貼壁后換含有不同藥物濃度的培養液處理24 h,用胰酶消化貼壁細胞,收集細胞,加入適量的AnnexinV/PI溶液,置于室溫,避光孵育15min;使用流式細胞儀檢測細胞的凋亡率,每組實驗重復進行3次。
1.2.3 Western blotting檢測凋亡相關蛋白的表達選取生長狀態良好的對數期人結腸腺癌DLD1細胞,按2×105/孔細胞接種于75ml細胞培養瓶中,置于細胞培養箱中培養24h,待細胞貼壁后換成含有不用藥物濃度的培養液作用24h后,收獲貼壁細胞和懸浮細胞,離心并用PBS洗滌細胞2次,加入RAPI裂解液,提取細胞中的蛋白,SDS-PAGE膠電泳后,用100V,120min將蛋白電轉移至PVDF膜上,用5%脫脂牛奶的PBST室溫封閉2h,再加入合適濃度的相應一抗,于4℃孵育過夜后,用PBST洗滌3次,15min,5min,5min后,加入相應的辣根過氧化酶標記的二抗室溫2h,再用PBST洗滌3次,15min,5min,5min后,使用ECL進行顯色。
1.2.4 統計學方法 采用SPSS13.0軟件對實驗數據進行方差分析,結果以x—±s表示,兩組數據間的比較采用t檢驗進行分析。與對照組相比,實驗組的數據以P<0.05為差異具有統計學意義。
2 結果
2.1 PI3K/mTOR抑制劑NVP-BEZ235對人結腸腺癌DLD1細胞生存率的影響
0nM、50nM、100nM、200nM的NVPBEZ235干預DLD1細胞24h后,MTT結果顯示,NVP-BEZ235對人結腸腺癌DLD1細胞呈明顯的濃度依賴關系,對細胞增殖的抑制作用隨著NVPBEZ235濃度的增加而增強,呈現明顯的劑量依賴的現象(圖1)。
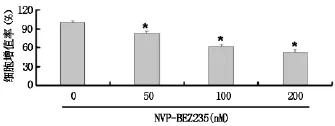
圖1 PI3K/mTOR抑制劑NVP-BEZ235對人結腸腺癌DLD1細胞生存率的影響
2.2 PI3K/mTOR抑制劑NVP-BEZ235對人結腸腺癌DLD1細胞凋亡率的影響
AnnexinV/PI染色后流式細胞術結果顯示,0 nM、50nM、100nM、200nM的NVP-BEZ235作用于人結腸腺癌DLD1細胞24h后,與對照組相比,細胞凋亡率隨著藥物濃度的增加而升高,并呈現明顯的濃度依賴性(圖2)。
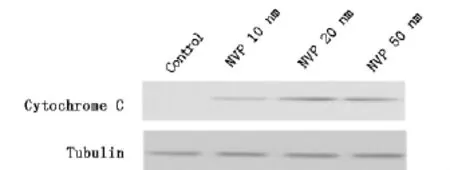
圖2 NVP-BEZ235對人結腸腺癌DLD1細胞凋亡的影響
2.3 PI3K/mTOR抑制劑NVP-BEZ235對人結腸腺癌DLD1細胞中凋亡相關蛋白的表達的影響
0nM、50nM、100nM、200nM的NVPBEZ235處理人結腸腺癌DLD1細胞24h后,與對照組相比,凋亡相關蛋白Cleaved Caspase-3的表達隨著藥物濃度的增加而明顯的增高(圖3)。
圖3 NVP-BEZ235對人結腸腺癌DLD1細胞Cleaved Caspase-3的表達的影響
2.4 自噬抑制劑3-MA增加了NVP-BEZ235對人結腸腺癌DLD1細胞增殖的影響
5mM的3-MA和(或)100nM的PI3K/mTOR抑制劑NVP-BEZ235作用人結腸腺癌DLD1細胞24h后,與對照組相比,3-MA組細胞的生存率沒有受到明顯的影響,而3-MA和NVPBEZ235的聯合組細胞的生存率明顯被抑制,且細胞的生存率明顯的低于單加NVP-BEZ235組(圖4)。

圖4 抑制自噬劑增加NVP-BEZ235對人結腸腺癌DLD1細胞增殖的抑制
2.5 自噬抑制劑3-MA促進了NVP-BEZ235誘導的人結腸腺癌DLD1細胞的凋亡
AnnexinV/PI染色后流式細胞術結果分析,自噬抑制劑3-MA增加了PI3K/mTOR抑制劑對人結腸腺癌DLD1細胞凋亡的影響。5mM的3-MA和(或)100nM的PI3K/mTOR抑制劑NVPBEZ235作用人結腸腺癌DLD1細胞24h后,與對照組相比,單加3-MA組細胞凋亡率無明顯差異;而3-MA和NVP-BEZ235聯合應用組細胞的凋亡率顯著高于單加NVP-BEZ235組(圖5)。

圖5 抑制自噬劑增加NVP-BEZ235引起的人結腸腺癌DLD1細胞凋亡
2.6 3-MA影響了NVP-BEZ235誘導的人結腸腺癌DLD1細胞凋亡相關蛋白的表達
5mM的3-MA和(或)100nM的PI3K/mTOR抑制劑NVP-BEZ235處理24h后,與對照組相比,3-MA組凋亡相關蛋白的表達無明顯變化;與單加NVP-BEZ235組比較,3-MA和NVPBEZ235聯合組Cleaved Caspase-3蛋白的表達水平明顯增加,且差異有統計學意義(圖6)。
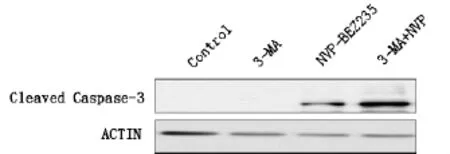
圖6 抑制自噬劑增加NVP-BEZ235引起的人結腸腺癌DLD1細胞Cleaved Caspase-3表達
3 討論
目前,結直腸癌的發病率和死亡率仍不斷升高,已成為了世界上最常見的惡性腫瘤之一,而隨著人們生活方式和飲食習慣的改變,其發病率居我國惡性腫瘤的第3位,并且每年仍有不斷增加的趨勢。PI3K/Akt是一種主要的存活通路,在許多癌癥中都發揮重要的作用,包括結直腸癌[9]。通過靶向PI3K/Akt/mTOR通路在結直腸癌中已被廣泛的研究。這條通路也是和化療藥物耐受相關[10]。NVP-BEZ235是一種新的并有前景的PI3K/mTOR抑制劑,它能有效的抑制PI3K和mTOR的活性。最近的研究展示,NVP-BEZ235能夠對PI3K3CA突變和未突變的結直腸癌都有效[11]。因此,NVPBEZ235很快成為了治療結直腸癌的很有前景的藥物。在我們的研究中,發現PI3K/mTOR抑制劑NVP-BEZ235以劑量依賴的方式有效的抑制人結腸腺癌DLD1細胞的增殖,并誘導細胞發生凋亡。
大量的研究展示,在癌癥細胞中,PI3K/Akt/mTOR通路的抑制能夠有效的誘導自噬的發生[12]。報道稱,mTOR通過它的下游基因ULK的磷酸化而成為自噬主要的調控[13]。所以mTOR的抑制能夠有效的誘導自噬的發生。通過PI3K/Akt/mTOR通路誘導的自噬的發生在一些研究中已經被發現與細胞死亡的機制有關,然而也有一些研究展示在藥物耐受中,自噬發揮了保護性的作用。在結直腸癌中,自噬發揮了保護性的作用[14]。因此在癌癥細胞中,抑制自噬能夠有效的增強PI3K/mTOR抑制劑的促凋亡效應。在我們的研究中展示,自噬抑制劑3-MA和PI3K/mTOR抑制劑NVP-BEZ235聯合應用時,能夠明顯的增強NVPBEZ235的細胞毒性,誘導人結腸腺癌DLD1細胞發生凋亡,并增加凋亡相關蛋白Cleaved Caspase-3的表達。
因此,PI3K/mTOR抑制劑NVP-BEZ235作為治療癌癥有前景的藥物,能夠有效地誘導人結腸腺癌DLD1細胞發生凋亡,但是目前其誘導的自噬對癌癥細胞起到了一定的保護作用。加入自噬抑制劑3-MA能夠有效的增強NVP-BEZ235對人結腸腺癌DLD1細胞的殺傷作用,進一步的提高了人結腸腺癌DLD1對NVP-BEZ235的敏感性。因此,自噬抑制劑3-MA和PI3K/mTOR抑制劑NVPBEZ235的聯合應用成為治療結直腸癌的潛在有效的治療方案,其臨床療效值得進一步研究。
[1]Xu AG,Yu ZJ,Jiang B,et al.Colorectal cancer in Guangdong Province of China:a demographic and anatomic survey[J].World J Gastroenterol,2010,16(8):960.
[2]Ades S.Adjuvant chemotherapy for colon cancer in the elderly:moving from evidence to practice[J].Oncology(Williston Park),2009,23(2):162.
[3]Li H,Jin X,Zhang Z,et al.Inhibition of autophagy enhances apoptosis induced by the PI3K/AKT/mTor inhibitor NVP-BEZ235 in renal cell carcinoma cells[J].Cell biochemistry and function,2013,31(5):427.
[4]Vivanco I,Sawyers CL.The phosphatidylinositol 3-Kinase AKT pathway in human cancer[J].Nat Rev Cancer,2002,2:489.
[5]Luo J,Manning BD,Cantley LC.Targeting the PI3K-Akt pathway in human cancer:rationale and promise[J].Cancer Cell,2003,4:257.
[6]Chang Z,Shi G,Jin J,et al.Dual PI3K/mTOR inhibitor NVPBEZ235-induced apoptosis of hepatocellular carcinoma cell lines is enhanced by inhibitors of autophagy[J].International journal of molecular medicine,2013,31(6):1449.
[7]Levine B,Kroemer G.Autophagy in the pathogenesis of disease[J].Cell,2008,132:27.
[8]Rubinsztein DC,Gestwicki JE,Murphy LO,et al.Potential therapeutic applications of autophagy[J].Nat Rev Drug Discov,2007,6:304.
[9]Chen J.Potential value and limitation of dual inhibitors of PI3K and mTOR in the treatment of cancer[J].Curr Cancer Drug Targets,2013,13(2):117.
[10]Brognard J,Clark AS,Ni Y,et al.Akt/protein kinase B is constitutively active in non-small cell lung cancer cells and promotes cellular survival and resistance to chemotherapy and radiation[J].Cancer Res,2001,61(10):3986.
[11]Roper J,Richardson MP,Wang WV,et al.The dual PI3K/mTOR inhibitor NVP-BEZ-235induces tumor regression in a genetically engineered mouse model of PIK3CA wild-type colorectal cancer[J].PLoS One,2011,6(9):e25132.
[12]Mirzoeva OK,Hann B,Hom YK,et al.Autophagy suppression promotes apoptotic cell death in response to inhibition of the PI3K-mTOR pathway in pancreatic adenocarcinoma[J].J Mol Med,2011,89:877.
[13]Jung CH,Jun CB,Ro SH,et al.ULK-Atg13-FIP200complexes mediate mTOR signaling to the autophagy machinery[J].Mol Biol Cell,2009,20:1992.
[14]Wu S,Wang X,Chen J,et al.Autophagy of cancer stem cells is involved with chemoresistance of colon cancer cells[J].Biochemical and biophysical research communications,2013,434(4):898.
Inhibition of autophagy enhances dual PI3K/mTOR inhibitor NVP-BEZ235induced apoptosis of human colon adenocarci-noma cell lines
SIQINGTUNALA
.(Erdos Central Hospital of Inner Mongolia,Erdos 017000,China)
ObjectiveTo investigate effects of inhibition of autophagy on NVP-BEZ235-induced apoptosis in human colon adenocarcinoma cell line DLD1.Methods After the DLD1cells were treated with NVP-BEZ235and/or 3-MA,cell viability was detected by an MTT assay.The rate of cell apoptosis was detected using flow cytometry.The expression of apoptosis-related protein were detected by Western blot.Results The cells were treated with varied concentration of NVP-BEZ235for 24h.According to the results of MTT and flow cytometry,the rate of cell proliferation decreased,and the rate of cell apoptosis increased in the dose of NVP-BEZ235.Meanwhile,the expression of apoptosis-related protein,cleaved caspase 3,was increased.However,after autophagy was inhibited by 3-MA,the rate of cell viability was obviously decreased.Meanwhlie,we detected that inhibition of autophagy enhanced the rate of NVP-BEZ235-induced apoptosis and the expression of apoptosis-related protein were obviously increased.Conclusion Autophagy protected human colon adenocarcinoma cell line DLD1from NVP-BEZ235-induced apoptosis.In addition,the blockage of autophagy could enhance NVP-BEZ235-induced apoptosis.The combined therapy of NVP-BEZ235and 3-MA may be a promising therapeutic strategy for human colon adenocarcinoma cell line DLD1.
autophagy;dual PI3K/mTOR inhibitor NVP-BEZ235;3-MA;Apoptosis;human colon adenocarcinoma cell
R735.3+5
A
斯慶圖娜拉(1979-),女,蒙古族,鄂爾多斯市中心醫院,博士,研究方向:消化內科學。
2015-03-03)
1007-4287(2015)10-1632-04

