電磁場不同處理時間對人臍帶間充質干細胞增殖與分化的影響
周 建,馬小妮,陳克明,閆娟麗,高玉海,石文貴,方清清,謝艷芳
?
·論著·
電磁場不同處理時間對人臍帶間充質干細胞增殖與分化的影響
周 建,馬小妮,陳克明,閆娟麗,高玉海,石文貴,方清清,謝艷芳
目的 研究頻率50 Hz強度1.8 mT下的不同處理時間正弦交變電磁場對體外培養人臍帶間充質干細胞增殖與分化的影響。方法 體外分離培養人臍帶間充質干細胞,傳代后隨機分為6組,每天于倒置相差顯微鏡下觀察細胞形態;MTT測定細胞增殖;10 d、12 d、14 d和16 d測定ALP活性;15 d行茜素紅鈣化結節染色以及17 d行vonkossa 染色;第13 d ALP組織化學染色;在磁場處理后的4 d 和 6 d行Real-time RT-PCR檢測Ⅰ型膠原(Collagen-Ⅰ)和 骨形態發生蛋白(BMP-2) mRNA表達量的變化。結果 0.5 h組可促進細胞增殖;磁場處理10 d~12 d后細胞出現鈣化趨勢;2.5 h組在SEMFs處理16 d和18 d后ALP活性均高于對照組(P<0.05);1.5 h組、2.0 h組和2.5 h組鈣化結節茜素紅染色面積均高于對照組(P<0.01,P<0.05);1.5 h組Collagen-Ⅰ mRNA表達水平高于對照組(P<0.05),2.0 h和2.5 h組ALP組織化學染色面積、Collagen-Ⅰ、BMP-2 mRNA表達水平均高于對照組(P<0.05,P<0.01)。結論 50 Hz 1.8 mT的正弦交變磁場能促進體外培養人臍帶間充質干細胞成骨性分化,尤以處理2.5 h促進人臍帶間充質干細胞成骨性分化最為明顯。
間質干細胞;臍帶;電磁場;細胞分化
隨著組織工程醫學和再生醫學工程發展,一些學者發現電磁場(electromagnetic field, EMFs)能促進大鼠骨髓間充質干細胞和成骨細胞成骨性成熟分化[1]。有研究報道50 Hz、1.8 mT的正弦交變電磁場(sinusoidal electromagnetic fields, SEMFs)為促進成骨細胞成熟分化的一個效應窗口[2-3]。人臍帶間充質干細胞是一種來源方便的潛在多能分化干細胞,但是電磁場能否促進人臍帶干細胞成骨性分化尚未可知,本實驗旨在研究人臍帶間充質干細胞在電磁場作用下是否具有成骨性分化的能力。實驗研究了50 Hz、1.8 mT不同處理時間的SEMFs對體外人臍帶間充質干細胞增殖與成骨性分化的影響,實驗發現SEMFs能促進人臍帶間充質干細胞成骨性分化以及成熟與礦化,因此實驗結果有望為人臍帶間充質干細胞在組織工程醫學和再生醫學研究及應用中提供一種新的定向分化手段和方向,同時也為骨髓間充質干細胞提供一種新的替代細胞。
1 材料和方法
1.1 實驗試劑 胎牛血清(FBS,蘭州民海生物工程公司),DMEM/F12培養基、胰蛋白酶(購于美國Gibco公司),地塞米松、磷酸化抗壞血酸、β-磷酸甘油鈉、青霉素、鏈霉素、胰蛋白酶(購于美國Sigma公司),茜素紅(購于上海生物工程有限公司),堿性磷酸酶試劑盒(購于南京建成生物工程有限公司)及酶標儀(Bio Rad,Model 550)。
1.2 磁場發生儀 實驗所用磁場發生儀由本實驗組與蘭州理工大學和中國科學院近代物理研究所共同設計和研制完成,此磁場發生裝置具有磁場參數精準大范圍可調,使得實驗結果具有可重復性[2]。
1.3 細胞分離和培養 取正常足月產健康嬰兒臍帶組織(依據醫院的相關規定并經過家屬知情同意后取材),浸泡于DMEM/F12培養基中迅速帶回實驗室。超凈臺內取出臍帶,無菌磷酸鹽緩沖液(PBS)或生理鹽水漂洗殘留血液,去除臍靜脈、臍動脈及臍帶外膜,剝離Wharton膠,并將其剪碎至1 mm3大小,移至0.1%的Ⅱ型膠原酶中,37℃水浴消化,直至Wharton膠全部消化。收集消化液加入培養液終止消化,收集細胞懸液過200目的細胞篩過濾,1000 r/min離心10 min,棄上清液,用含10% FBS的DMEM/F12培養基重懸浮細胞,在37℃、5%CO2培養箱內培養。細胞貼壁后,第3天首次半量換液,以后每3 d換液1次。每天倒置相差顯微鏡下觀察細胞形態。細胞達70%~80%融合后,用0.1%的胰酶消化傳代,繼續擴增培養。
1.4 細胞分組與磁場處理 將第一代傳代后的細胞(P1)調整濃度4200 cell/cm2[4]接種于60 mm的一次性培養皿中培養12 h后,隨機分為6組,置于頻率50 Hz,0 mT磁場強度下的為對照組,另外5組分別置于頻率50 Hz,1.8 mT磁場強度下,根據每天置于磁場下的時間不同分為0.5 h組、1.0 h組、1.5 h組、2.0 h組和2.5 h組。
1.5 增殖分析 P1細胞接種12 h后采用如上所述的磁場對人臍帶干細胞進行處理。磁場處理72 h(第一次磁場處理為0 h開始計算時間)[4]后用含0.5%甲基噻唑基四唑(MTT)的無血清培養基繼續培養4 h,棄培養液,加入2.0 ml的二甲基亞砜(DMSO)搖床震蕩10 min,待紫色結晶沉淀徹底溶解后于570 nm波長測定吸光度(OD)。
1.6 成骨性分析 將P1代細胞接種于60 mm培養皿,每3 d換液1次,每天使用倒置顯微鏡觀察細胞形態,待細胞70%~80%融合成片時加入成骨性誘導劑進行成骨誘導培養(50 mg/L磷酸化抗壞血酸、10 mmol/L β-甘油磷酸鈉和1×10-8mol/L的地塞米松),在加入成骨性誘導劑后立即按照上述描述的分組和方法對培養細胞進行磁場處理。
1.6.1 堿性磷酸酶(ALP)活性測定:在磁場處理后的12 、14 、16 和18 d分別測定各組細胞的ALP活性,ALP活性測定的方法按試劑盒說明書操作,每組分別按緩沖液∶基質液=1∶1加入充分搖勻;然后37℃水浴15 min,加入3倍于基質液顯色液,充分混勻顯色后,測定507 nm處OD值,換算成金氏單位。
1.6.2 鈣化結節染色:磁場處理至15 d,棄細胞培養液,無菌PBS漂洗2遍,加入10%福爾馬林固定10 min,棄固定液后流水沖洗,加入pH=8.9、0.1%的茜素紅染色緩沖液,37℃水浴1 h并輕輕搖動,紅色斑點出現后,流水沖洗去掉浮色,換固定液照相記錄染色結果。照相后采用Ipp (Image-Pro Plus 6.0)灰度分析軟件,掃描鈣化結節染色區域的面積應用公式:培養皿的面積×(鈣化結節染色區域掃描面積/照片中皿的掃描面積)[5]。磁場處理后17 d,棄培養液,無菌PBS漂洗2次,加入10%福爾馬林固定10 min,棄固定液,加入新配置5%的硝酸銀,紫外燈下照1 h,流水沖洗后,加入硫代硫酸鈉還原,棕色斑點出現后換固定液照相記錄結果。
1.6.3 ALP組織化學染色:磁場處理至13 d時進行偶氮偶合組織化學染色,取出培養細胞棄培養液,無菌PBS漂洗2次,加10%福爾馬林固定30 s,棄固定液,加α-萘基磷酸鈉和固藍的堿性緩沖液,室溫靜置待紫色斑點出現后停止染色[6],無菌PBS漂洗去掉浮色觀察并記錄結果,數據結果分析:照相后采用Ipp(Image-Pro Plus 6.0)灰度分析軟件,掃描ALP染色區域的面積應用公式:培養皿的面積×(堿性磷酸酶染色區域掃描面積/照片中皿的掃描面積),出現紫色斑點后停止染色,觀察記錄結果。
1.7 基因表達水平分析
1.7.1 Total RNA提取:P1代細胞在第一次磁場處理后第4天和第6天后棄培養液,加入無菌PBS漂洗2次,加入1 mL RNA提取細胞裂解液裂解細胞,向裂解液中加入200 μl三氯甲烷后4℃、12000 r/min離心15 min,小心吸取上清液后加入等體積的異丙醇前后顛倒混勻冰上靜置15 min,4℃、12000 r/min離心15 min棄上清液,75%乙醇重懸浮沉淀4℃、12000 r/min離心5 min,棄上清后風干加入無酶水溶解后-70℃保存,瓊脂糖凝膠電泳檢測RNA完整性,調整Total RNA的濃度。
1.7.2 反轉錄:使用TakaRa Prime ScriptTM reagent Kit(TakaRa Code:DRR037A)反轉錄試劑盒合成反轉錄出第一條cDNA鏈。反應體系:5×Prime ScriptTM Buffer 4 μl,Prime ScriptTM RT Enzyme MixⅠ1.0 μl,Oligo dT Primer (50μmo/L) 1.0 μl,Random 6 Primer(100 μmo/L)1.0 μl,Total RNA 10 μl(1000 ng)補RNase Free水至20 μl、37℃反應15 min,85℃、5 s、-20 ℃保存。
1.7.3 引物設計:根據實驗要求,在genbank查詢所需要基因目的序列的mRNA序列,后由寶生物(大連)公司根據實驗要求設計并合成。Collagen-I: NG_007405,Forward 5′-tgtgcaccaattga aggac-3′ Reverse 5′-cgcatttat tgagtacctg-3產物長度187 bp′; BMP-2:NM_001200.2 Forward 5′-agact gcgcggccggcac-3′,Reverse 5′-agccagccgagccaacactg-3′,產物長度178 bp;GAPDH:NG_007073.2 Forward 5′- ggttctgggctggctaagac -3′,Reverse5′- gcagaaagtacagggagttc -3′,產物長度143 bp。
1.7.4 聚合酶鏈式反應(PCR)檢測:按照Applied Biosystems公司7300儀器操作說明進行實驗。其中PCR反應體系20 μl,包括SYBR? Premix Ex TaqTMⅡ(2×)10 μL[2]。PCR反應條件:95℃預變性30 s;94℃變性5 s,退火31 s,40個循環; Real-time RT-PCR數據分析處理采用△△Ct處理數據,采用2-△△Ct表示數據的結果[7]。
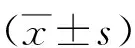
2 結果
2.1 人臍帶間充質干細胞形態及成骨性分化鑒定 原代人臍帶間充質干細胞培養7~9 h后,顯微鏡下細胞數量開始逐漸增多,細胞形態為長梭形。在原代細胞傳一代培養至10 d,細胞匯合達到90%左右,細胞呈極性排列,集落形成。細胞傳代后,貼壁速度增快,生長迅速;48 h后,貼壁的細胞間可見有細胞集落形成,細胞大多呈長梭形,細胞核較大,數量也逐漸增多;4 d后首次換液,7~10 d左右細胞便鋪滿皿底,融合成片,細胞排列較整齊,分布較均勻,生長較一致,雜細胞相對已較少。在成骨性誘導13 d后行ALP組織化學染色鑒定,15 d后行茜素紅染色進行成骨性分化鑒定,17 d后行Vonkossa 染色鑒定,見圖1。
2.2 細胞增殖分析 0.5 h組、1.0 h組、1.5 h組、2.0 h組、2.5 h組OD值分別為1.744±0.083、1.594±0.058、1.618±0.057、1.577±0.050、1.570±0.083,對照組為1.618±0.058。0.5 h組OD值大于對照組(P<0.05),其余4組OD值與對照組比較差異均無統計學意義(P>0.05)。
2.3 ALP活性測定 2.5 h組在SEMFs處理16 d和18 d后ALP活性均高于對照組(P<0.05),其余4組在SEMFs處理后不同時間段與對照組比較差異均無統計學意義(P>0.05),見表1。

表1 6組人臍帶間充質干細胞不同時間段ALP活性測定比較
注:對照組置于頻率50 Hz,0 mT磁場強度下;0.5 h組、1.0 h組、1.5 h組、2.0 h組和2.5 h組分別每天置于頻率50 Hz,1.8 mT磁場強度下0.5 h、1.0 h、1.5 h、2.0 h、2.5 h;與對照組比較,aP<0.05
2.4 茜素紅鈣化結節染色結果 0.5 h組、1.0 h組、1.5 h組、2.0 h組、2.5 h組和對照組茜素紅鈣化結節染色面積分別為(3.23±0.75)、(3.87±0.86)、(4.56±0.47)、(5.37±0.59)、(5.877±0.61)、(3.12±0.46)cm2。1.5 h組、2.0 h組和2.5 h組染色面積均高于對照組(P<0.01,P<0.05),其余兩組與對照組比較差異無統計學意義(P>0.05),見圖2。
2.5 ALP組織化學染色結果 0.5 h組、1.0 h組、1.5 h組、2.0 h組、2.5 h組和對照組ALP組織化學染色面積分別為(2.2±0.50)、(2.87±0.49)、(2.56±0.73)、(3.37±0.63)、(3.87±0.67)、(2.12±0.44)cm2。其中2.0 h組和2.5 h組ALP組織化學染色面積高于對照組(P<0.05),其余3組與對照組比較差異均無統計學意義(P>0.05)。

圖1 人臍帶間充質干細胞倒置相差顯微鏡下病理形態(×100)
A.13 d后堿性磷酸酶組織化學染色鑒定;B.成骨性誘導15 d后茜素紅染色行成骨性分化鑒定;C.17 d后Vonkossa染色鑒定;D.傳代細胞接種48 h后鏡下病理形態;E.傳代細胞接種4 d后鏡下病理形態;F.傳代細胞接種9 d后鏡下病理形態

圖2 正弦交變電磁場處理人臍帶間充質干細胞第15天6組茜素紅鈣化結節染色結果
對照組置于頻率50 Hz,0 mT磁場強度下;0.5 h組、1.0 h組、1.5 h組、2.0 h組和2.5 h組分別每天置于頻率50 Hz,1.8 mT磁場強度下0.5 h、1.0 h、1.5 h、2.0 h、2.5 h;A.對照組;B.0.5 h組;C.1.0 h組;D. 1.5 h組;E.2.0 h組;F.2.5 h組
2.6 Ⅰ型膠原(Collagen-Ⅰ)Real-time RT-PCR檢測結果 在SEMFs處理人臍帶間充質干細胞4 d后,0.5 h組、1.0 h組、1.5 h組、2.0 h組、2.5 h組和對照組人臍帶間充質干細胞Collagen-Ⅰ mRNA表達水平分別為1.01±0.23、1.09±0.56、1.10±0.35、0.93±0.17、1.09±0.18、1.02±0.24,與對照組比較,5組Collagen-Ⅰ mRNA表達水平差異無統計學意義(P>0.05);在處理人臍帶間充質干細胞6 d后,6組Collagen-Ⅰ mRNA表達水平分別為1.47±0.54、1.45±0.23、1.67±0.29、1.80±0.22、1.99±0.26、1.35±0.22,1.5 h、2.0 h和2.5 h組均高于對照組(P<0.01,P<0.05)。2.5 h組Collagen-Ⅰ mRNA 表達水平顯著高于2.0 h組(P<0.01)。
2.7 骨形態發生蛋白(BMP-2)Real-time RT-PCR檢測結果 在SEMFs處理人臍帶間充質干細胞4 d后,0.5 h組、1.0 h組、1.5 h組、2.0 h組、2.5 h組和對照組人臍帶間充質干細胞BMP-2 mRNA表達水平分別為1.11±0.32、0.99±0.16、1.00±0. 16、0.93±0.27、1.09±0.8、0.97±0.23,與對照組比較,5組BMP-2表達水平差異均無統計學意義(P>0.05);在SEMFs處理人臍帶間充質干細胞6 d后,0.5 h組、1 h組、1.5 h組、2 h組、2.5 h組和對照組人臍帶間充質干細胞BMP-2 mRNA表達水平分別為1.77±0.54、1.65±0.23、1.87±0.18、2.09±0.33、2.40±0.36、1.75±0.08,其中2.0 h組表達水平高于對照組(P<0.05),2.5 h組表達水平明顯高于對照組(P<0.01),其余3組與對照組比較差異均無統計學意義(P>0.05)。2.5 h組表達水平高于2.0 h組(P<0.05)。
3 討論
干細胞作為一種具有多能分化的細胞,成為再生醫學和組織工程醫學的種子細胞,人們試圖用不同的手段誘導干細胞定向分化,以期找到好的定向分化最佳手段。有文獻報道電磁場能促進骨髓間充質干細胞成骨性分化[8]。同時文獻報道,低強度、低頻電磁場對生物體的影響存在一個效應窗口[9],因此實驗研究了頻率50 Hz強度1.8 mT下SEMFs不同處理時間(0.5~2.5 h,間隔0.5 h)對臍帶干細胞的影響,研究其是否存在時間效應窗口。首先實驗用MTT法測定細胞增殖,然后行Vonkossa和ALP組織化學染色鑒定其成骨性分化,實驗研究發現0.5 h組促進人臍帶間充質干細胞增殖,而2.0 h和2.5 h組促進人臍帶間充質干細胞的成骨性分化。
ALP活性是衡量干細胞成骨性分化的標志性指標,電磁場干預可增強成骨細胞和骨髓間充質干細胞ALP活性已為大量研究所證實[10-11]。因此實驗以ALP作為一個衡量指標,檢測SEMFs對人臍帶間充質干細胞成骨性分化的影響,實驗發現每日SEMFs處理2.0 h和2.5 h能增加ALP活性和ALP組織化學染色面積。鈣鹽作為干細胞成骨性分化的一個重要的指標,實驗在成骨性誘導后的不同時間點對人臍帶間充質干細胞成骨性進行鑒定,結果發現SEMFs促進人臍帶間充質干細胞成骨細胞鈣鹽的沉積,茜素紅染色結果表明2.0 h和2.5 h組顯著增加人臍帶間充質干細胞鈣化結節的數量,實驗從細胞形態學水平證明了SEMFs促進人臍帶間充質干細胞成骨性分化,同時SEMFs促進人臍帶間充質干細胞成骨性分化存在一個時間效應窗口。
研究發現BMP-2具有較強的誘導干細胞成骨性分化能力[12-13], 以及collagen-Ⅰ是干細胞成骨性分化的基礎,因此實驗檢測SEMFs對人臍帶間充質干細胞BMP-2和Collagen-Ⅰ mRNA表達水平的影響,實驗結果表明SEMFs能促進BMP-2和Collagen-Ⅰ mRNA表達,存在一定的時間依賴性,尤以2.0 h和2.5 h組作用顯著。實驗研究發現磁場處理特定的時間點,SEMFs能顯著促進成骨性分化的相關基因的表達,這可能與當前有人提出的電磁場生物效應窗口理論相一致[14-15]。實驗從分子水平表明SEMFs能促進人臍帶間充質干細胞成骨性分化,同時存在時間效應窗口。
實驗以頻率50 Hz強度1.8 mT下不同處理時間(0.5~2.5 h間隔0.5 h)分析了SEMFs對ALP活性、鈣鹽以及基因表達的影響,證明了SEMFs對人臍帶間充質干細胞的成骨性分化,同時存在時間的依賴性。實驗的研究結果與已有報道電磁場促進干細胞成骨性分化窗口效應理論結果一致[16],我們將以本實驗結果為基礎,進一步從電磁誘導干細胞定向分化機理去研究SEMFs對干細胞分化的影響,為再生醫學和組織工程醫學應用干細胞定向分化提供一定的實驗依據。
[1] Tsai M T, Li W J, Tuan R S,etal. Modulation of osteogenesis in human mesenchymal stem cells by specific pulsed electromagnetic field stimulation[J].J Orthop Res, 2009,27(9):1169-1174.
[2] Zhou J, Ming L G, Ge B F,etal. Effects of 50 Hz sinusoidal electromagnetic fields of different intensities on proliferation, differentiation and mineralization potentials of rat osteoblasts[J].Bone, 2011,49(4):753-761.
[3] 程國政,陳克明,李志鋒,等.正弦交變電磁場促進大鼠骨髓間充質干細胞成骨性分化的研究[J].生物醫學工程學雜志,2011,(4): 683-688.
[4] 吳燕峰, 黎陽.實用醫學細胞培養技術[M].廣州:中山大學出版社, 2010: 465-468.
[5] Chang W H, Chen L T, Sun J S,etal. Effect of pulse burst electromagnetic field stimulation on osteoblast cell activities[J].Bioelectromagnetics, 2004,25(6):457-465.
[6] 陳克明, 葛寶豐, 劉興炎,等.大鼠骨髓基質細胞體外定向誘導成骨[J].蘭州大學學報:自然科學版,2003,39(1):69-73.
[7] Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T))[J].Methods, 2001,25(4):402-408.
[8] PeterSJ,LiangCR,KimDJ,etal.Osteoblasticphenotypeofratmarrowstromalcellsculturedinthepresenceofdexamethasone,beta-glycerolphosphate,andL-ascorbicacid[J].JCellBiochem,1998,71(1):55-62.
[9] 宋濤,霍小林,吳石增.生物電磁特性及其應用[M].北京:北京工業大學出版社,2008:355-362.
[10]Lohmann C H, Schwartz Z, Liu Y,etal. Pulsed electromagnetic field stimulation of MG63 osteoblast-like cells affects differentiation and local factor production[J].J Orthop Res, 2000,18(4):637-646.
[11]Lohmann C H, Schwartz Z, Liu Y,etal. Pulsed electromagnetic fields affect phenotype and connexin 43 protein expression in MLO-Y4 osteocyte-like cells and ROS 17/2.8 osteoblast-like cells[J].J Orthop Res, 2003,21(2):326-334.
[12]Cheng H, Jiang W, Phillips F M,etal. Osteogenic activity of the fourteen types of human bone morphogenetic proteins (BMPs)[J].J Bone Joint Surg Am, 2003,85-A(8):1544-1552.
[13]Kang Q, Sun M H, Cheng H,etal. Characterization of the distinct orthotopic bone-forming activity of 14 BMPs using recombinant adenovirus-mediated gene delivery[J].Gene Ther, 2004,11(17):1312-1320.
[14]Zhang J, Zhang X, Wen J,etal. The effects of extremely low-frequency electromagnetic fields on rat osteoblast[J].Sheng Wu Yi Xue Gong Cheng Xue Za Zhi, 2007,24(5):1058-1060.
[15]Sun L Y, Hsieh D K, Yu T C,etal. Effect of pulsed electromagnetic field on the proliferation and differentiation potential of human bone marrow mesenchymal stem cells[J].Bioelectromagnetics, 2009,30(4):251-260.
[16]Yang Y, Tao C, Zhao D,etal. EMF acts on rat bone marrow mesenchymal stem cells to promote differentiation to osteoblasts and to inhibit differentiation to adipocytes[J].Bioelectromagnetics, 2010,31(4):277-285.
Effect of Electromagnetic Field in Different Treatment Time on Proliferation and Differentiation of Human Umbilical Cord of Mesenchyme Stem Cells in Vitro
ZHOU Jian, MA Xiao-ni, CHEN Ke-ming, YAN Juan-li, GAO Yu-hai, SHI Wen-gui, FANG Qing-qing, XIE Yan-fang
(Osteology Institution, Lanzhou General Hospital of Lanzhou Military Area Command, Lanzhou 730050, China)
Objective To investigate effect of different treatment time of sinusoidal electromagnetic fields (SEMFs) under 50 Hz 1.8 mT on proliferation and differentiation of human umbilical cord of mesenchyme stem cells in vitro. Methods The human umbilical cord of mesenchyme stem cells were isolated in vitro, and randomly divided into 6 groups after one passage. The cell configurations were observed every day under inverted phase contrast microscope; MTT colorimetric assay was used to detect the cell proliferation; ALP activities were detected on 10thd, 12thd, 14thd and 16thd after SEMFs treatment; calcified nodules were stained with alizarin red on 15thd and with vonkossa staining on 17thd after SEMFs treatment; ALP histochemical staining was performed on 13thd after SEMFs treatment; the expression changes of Collagen-Ⅰ and BMP-2 mRNA were detected with real-time RT-PCR (reverse transcription polymerase chain reaction) on 4thd and 6thd after SEMFs treatment. Results The SEMFs promoted the cell proliferation in 0.5 h group; the calcified tendency was found on 10thd-12thd after SEMFs treatment; the ALP activities on 16thd and 18thd after SEMFs treatment in 2.5 h group were significantly higher than those in control group (P<0.05); the areas of alizarin red of calcified nodules in 1.5 h, 2.0 h and 2.5 h groups were significantly larger than that in control group (P<0.01,P<0.05); Collagen-Ⅰ mRNA expression level in 1.5 h group was higher than that in control group (P<0.05), and ALP histochemical staining areas, expression levels of Collagen-Ⅰ and BMP-2 mRNA in 2.0 h and 2.5 h groups were significantly larger and higher than those in control group (P<0.05,P<0.01). Conclusion Sinusoidal electromagnetic fields under 50 Hz 1.8 mT can promote osteoplastic differentiation of human umbilical cord of mesenchyme stem cells in vitro, and the differentiation is the most obvious in 2.5 h group.
Mesenchymal stem cells; Umbilical cord; Electromagnetic fields; Cell differentiation
國家自然科技基金(81270963,81471090);甘肅省科技重大專項資助項目(09ZNKDA025)
730050 蘭州,蘭州軍區蘭州總醫院骨科研究所
陳克明,E-mail:chkeming@yahoo.com.cn
R329.2
A
2095-140X(2015)03-0011-05
10.3969/j.issn.2095-140X.2015.03.003
2014-10-04 修回時間:2014-12-28)

