醫用膠制動對大鼠坐骨神經離斷吻合修復效果影響研究
鄒秀強,梁向黨,郭占芳,孫 賡,余寬寬,房卓群
?
·論著·
醫用膠制動對大鼠坐骨神經離斷吻合修復效果影響研究
鄒秀強,梁向黨*,郭占芳*,孫 賡,余寬寬,房卓群
目的 觀察醫用膠制動對大鼠坐骨神經離斷吻合修復效果的影響。方法 選用健康雄性SD大鼠30只,造模成功后隨機分為兩組,每組各15只。實驗組于坐骨神經中點處離斷后手術顯微鏡下行傳統針線縫合吻合,硅膠導管套在吻合口表面,導管中點與吻合口位置相同,導管兩端口各滴20 μl醫用粘合劑固定。對照組于坐骨神經中點處離斷后僅行手術顯微鏡下傳統針線縫合吻合,未使用醫用膠和導管固定。術后第8周對吻合口神經結締組織行大體觀察、神經功能指數、電生理檢查和組織病理學觀察,分別記錄神經外膜內、外結締組織增生情況,觀測吻合口神經纖維再生數量。結果 術后第8周,大體觀察:兩組大鼠神經與周圍組織粘連明顯,但實驗組坐骨神經分離容易;實驗組左側坐骨神經功能指數(6、8周)、神經潛伏期、神經外膜瘢痕結締組織最大厚度、4個視野神經內結締組織面積之和均小于對照組(P<0.05);神經振幅、神經纖維再生計數大于對照組(P<0.05)。結論 神經離斷后使用醫用膠對神經制動,可以抑制吻合口疤痕結締組織的增生,促進神經纖維的再生。
氰丙烯酸鹽類,制動,修復;坐骨神經;大鼠
周圍神經離斷性損傷是臨床工作中常見的疾病,也是神經損傷中嚴重的一種類型。神經顯微吻合是治療神經離斷損傷的金標準[1]。有提出張力對神經再生是有害的,神經離斷性損傷后,神經內外纖維結締組織增生,使吻合口生長牢固以消除張力的不良影響[2-3]。但是結締組織的過度增生干擾了軸突再生、軸漿運輸以及局部的血液循環,制約了神經再生和靶器官功能恢復,致使患者感覺和運動功能部分喪失[4-6]。為抑制神經內外結締組織的增生,許多學者提出對損傷肢體進行制動,以減少吻合口的力學刺激,促進神經再生。肢體的制動又帶來關節攣縮、肌肉萎縮,從而不利于患者的康復[7-10]。因此對肢體制動的方法、制動的時間、甚至是否需要制動,學術界仍然存在較大的爭議。本文通過使用醫用膠粘劑和硅膠導管,在大鼠坐骨神經離斷吻合口,對其采取內固定制動,消除神經再生過程中張力對吻合口的刺激,通過術后組織病理學觀察吻合口內外結締組織增生的情況,以及神經功能恢復的評價,了解神經內制動因素對吻合口結締組織增生和神經功能恢復的影響。
1 材料與方法
1.1 實驗動物和材料 健康雄性SD大鼠30只,體重300~350 g,由解放軍總醫院動物中心提供[(SCXK(京)2012-0001];α-氰基丙烯酸酯醫用粘合劑(廣州白云醫用膠有限公司);普通硅膠導管(長10 mm、內徑1.5 mm);丹麥產Medtronic Keypoint肌電圖儀。
1.2 模型制備與分組 1%戊巴比妥鈉腹腔注射麻醉后(40 mg/kg),大鼠右側臥位固定于手術臺上,通過左側股骨后外側肌間隙為入口暴露坐骨神經,運用手術顯微鏡仔細游離坐骨神經,近端位于梨狀肌出口,遠端達腓總神經分支上緣2 mm處(注意保護好腓總神經);使用顯微剪在坐骨神經中點處離斷。造模成功后,將30只SD大鼠隨機分為實驗組與對照組,每組各15只,實驗組用10-0顯微縫線借助手術顯微鏡外膜縫合6針,硅膠導管套接吻合口(導管中點與吻合口重合),導管邊緣各滴20 μl醫用粘合劑與神經固定,待膠水固化后,屈伸左下肢見吻合口在硅膠管內無位移現象,吻合口制動滿意;對照組用10-0顯微縫線外膜縫合6針,不做其他處理。待粘合劑固化后,創面均使用慶大霉素沖洗后逐層縫合,大鼠蘇醒后分籠常規飼養。
1.3 觀察方法
1.3.1 大體觀察:術后第8周大鼠再次麻醉,切開原切口顯露坐骨神經,觀察切口內有無感染,神經表面組織粘連情況及吻合口愈合情況,并詳細記錄。
1.3.2 神經功能指數(SFI):將大鼠后肢足底涂抹紅色染料,構建木制通道并在下方平面附宣紙。待大鼠通過后,測量大鼠在宣紙上留下的足印。主要包括足長、趾寬和中間趾寬。觀察時間點為術后第2、4、6、8周。再依據Bain公式[SFI=109.5(ETS-NTS)/NTS-38.3(EPL-NPL)/NPL+13.3(EIT-NIT)/NIT-8.8,其中E代表實驗側,N代表正常側,TS代表第1到第4腳趾距離,PL代表第3腳趾到足印底部距離,IT代表第2到第4腳趾距離]計算出大鼠坐骨神經SFI。數值為0代表功能正常,數值為-100代表功能完全喪失。
1.3.3 電生理檢查:標本觀察結束后,使用肌電圖儀進行神經電生理檢測,將刺激電極放置在吻合神經近側5 mm處,記錄電極放置在小腿脛后肌群上。分別記錄術后第8周實驗組與對照組坐骨神經動作電位的潛伏期和振幅數值。
1.3.4 組織病理學觀察:電生理檢查結束后,吻合口近端和遠端5 mm處離斷留取標本,神經近端做標記。常規固定脫水,石蠟包埋。標本縱切后分別行HE、Masson染色、吻合口遠端3 mm處做橫切標本鍍銀染色。光學顯微鏡下(40×),隨機選取90 μm×90 μm的4個視野并拍照,Image Pro PluS圖像分析系統測量4個視野神經內結締組織面積之和;選取神經吻合口外結締組織最厚的部分,并測量其長度。Image Pro PluS圖像分析系統計數通過吻合口的神經纖維總數,觀察吻合口神經再生情況。
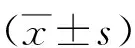
2 結果
2.1 大體觀察 兩組大鼠未出現死亡情況,切口無裂開及感染,術后第2天大鼠左下肢均出現被動運動,所有動物納入結果分析。術后第8周大鼠再次麻醉后沿原切口逐層切開,顯露坐骨神經,兩組神經吻合口外觀連續性完整,未見感染征象;兩組神經與周圍組織粘連明顯,實驗組坐骨神經分離容易,對照組吻合口與周圍粘連致密,需借助手術顯微鏡分離。
2.2 神經功能指數 術后對照組第2、4、6、8周SFI數值分別為:-92±2.4、-76±2.9、-65±3.7、-56±3.7;術后實驗組4個時間點SFI數值分別為:-91±2.6、-74±3.1、-61±4.2、-51±4.1。其中,術后第2、4周兩組SFI比較差異無統計學意義(P>0.05),但術后第6、8周實驗組SFI均高于對照組(P<0.01)。
2.3 電生理檢測 術后第8周實驗組與對照組左側坐骨神經潛伏期與振幅比較差異具有統計學意義(P<0.05),見表1。
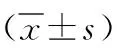
表1 術后第8周兩組電生理檢測結果比較
注:實驗組為針線縫合吻合后使用醫用粘合劑和導管固定,對照組為行針線縫合吻合;與對照組比較,aP<0.05
2.4 組織學觀察 術后第8周組織病理學觀察顯示,對照組吻合口神經外膜結締組織增生明顯,實驗組神經外膜結締組織最大厚度為(368.2±13.1)μm,對照組為(562.8±20.2)μm,兩組比較差異具有統計學意義(P<0.05),見圖1。實驗組4個視野神經內結締組織面積之和為(14158.8±442.5)μm2,對照組為(18856.8±654.6)μm2,兩組比較差異具有統計學意義(P<0.05),見圖2。實驗組吻合口遠端3 mm處神經纖維再生數量為(4867±262)個,對照組為(4595±304)個,兩組比較差異有統計學意義(P<0.05),見圖3。
3 討論
周圍神經損傷后,斷端縫合、神經移植依舊是神經修復的金標準。在神經修復早期,神經內外瘢痕結締組織增生明顯,其中含量最高的為Ⅰ、Ⅲ型膠原組織[11]。膠原組織具有很強的抗張力性,在神經修復早期對于消除張力具有重要的意義。但是瘢痕結締組織在神經內外過度增生,卻會嚴重干擾神經再生的過程[12]。神經外瘢痕結締組織的過度增生,可以對神經吻合口造成機械性的壓迫,使神經外膜微血管血流中斷和軸漿運輸障礙,破壞了血-神經屏障的功能;神經內瘢痕結締組織的過度增生,阻礙軸突穿越吻合口向遠端生長,嚴重阻礙了軸突再生和神經功能的恢復[13-14]。這也使得神經損傷后修復的結局難以預測。究其原因,吻合口生物力學刺激是再生過程中的一個重要不良因素。
因此,神經離斷性損傷后肢體制動,減少吻合口的力學刺激是很有必要的,待神經吻合口生長牢固后,開始行肢體功能鍛煉[15]。但是肢體的制動會帶來很多負面影響,如肌肉萎縮、關節攣縮甚至關節功能喪失。本實驗對神經吻合口進行內制動,在神經修復早期可以完全避免肢體被動活動所帶來的不良影響。一定程度上也可以避免肌肉萎縮、關節攣縮和功能喪失,促進關節、肌肉功能的恢復。術后第8周SFI及電生理檢測結果等數據表明,神經功能恢復優于對照組;神經內瘢痕結締組織面積實驗組明顯小于對照組。這一結果也與Schmidhammer等[16]的研究結果相一致。證明了該種方法的可行性,也為神經離斷損傷在臨床上治療拓展了新視野。

圖1 術后第8周兩組大鼠左側坐骨神經吻合口近端鏡下觀察神經外膜結締組織(HE×40)
A.實驗組:針線縫合吻合后使用醫用粘合劑和導管固定;B.對照組:行針線縫合吻合;紅色標記線為吻合口神經外膜結締組織最厚部分
圖2 術后第8周兩組左側坐骨神經吻合口近端鏡下觀察神經內結締組織面積(Masson×400)
A.實驗組:針線縫合吻合后使用醫用粘合劑和導管固定;B.對照組:行針線縫合吻合;結締組織顯示為淡藍色,髓鞘顯示為紅色

圖3 術后第8周兩組左側坐骨神經吻合口遠端鏡下觀察神經再生(鍍銀染色×400)
A.實驗組:針線縫合吻合后使用醫用粘合劑和導管固定;B.對照組:行針線縫合吻合
Robert Schmidhammer在實驗中使用縫線固定神經和硅膠導管,使得吻合口與導管形成一個整體,達到制動的效果。但是過多地使用縫合方法,一方面縫針對神經有二次損傷,另一方面縫線由外而內進入神經組織,也增加了局部炎癥反應的風險,導致局部瘢痕結締組織的增生[17]。粘合劑在神經修復中的使用受到很多學者的青睞[18-19]。α-氰基丙烯酸脂粘合劑已經成熟運用于臨床和動物實驗,梁向黨等[20]利用該粘合劑成功修復大鼠坐骨神經損傷。在本實驗中還觀察到,20 μl粘合劑固化后不但可以起到粘連作用,它具有很強的抗牽拉作用。神經吻合口套接硅膠導管,并使用α-氰基丙烯酸脂粘合劑封閉導管,可以對吻合口進行有效的內制動。醫用硅膠導管組織相容性好,無抗原性,在人體內異物反應較小。并且硅膠導管本身所具有的韌性,不僅為神經再生提供一個很好的三圍支撐空間,也為神經再生提供了一個良好的微環境。既能避免神經營養因子外逸,也能阻止外界結締組織的入侵。術后第8周神經吻合口外結締組織厚度的測量結果表明,硅膠導管可以顯著抑制吻合口外結締組織的增生。
綜上所述,利用粘合劑和硅膠導管所制備的內固定支架,可以對神經吻合口起到很好的制動效果。不僅可以抑制神經內外瘢痕結締組織的增生,而且還有利于神經再生,促進神經靶器官功能的恢復。
[1] Kechele P R, Bertelli J A, Dalmarco E M,etal. The mesh repair: tension free alternative on dealing with nerve gaps-experimental results[J].Microsurgery, 2011,31(7):551-558.
[2] Millesi H, Meissl G, Berger A. The interfascicular nerve-grafting of the median and ulnar nerves[J].J Bone Joint Surg Am, 1972,54(4):727-750.
[3] Berger A, Millesi H. Nerve grafting[J].Clin Orthop Relat Res, 1978(133):49-55.
[4] Ngeow W C. Scar less: a review of methods of scar reduction at sites of peripheral nerve repair[J].Oral Surg Oral Med Oral Pathol Oral Radiol Endod, 2010,109(3):357-366.
[5] 殷玉芹,劉正津,何光.張力對周圍神經損傷和修復的影響[J].解剖科學進展,1995,1(1):30-34.
[6] 閆家智,姜保國.周圍神經的生物力學研究進展[J].中華實驗外科雜志,2004,21(1):125-126.
[7] Currier D P, Ray J M, Nyland J,etal. Effects of electrical and electromagnetic stimulation after anterior cruciate ligament reconstruction[J].J Orthop Sports Phys Ther, 1993,17(4):177-184.
[8] Jozsa L, Kannus P, J?rvinen M,etal. Atrophy and regeneration of rat calf muscles cause reversible changes in the number of nucleolar organizer regions. Evidence that also in nonproliferating cells the number of NORs is a marker of protein synthesis activity[J].Lab Invest, 1993,69(2):231-237.
[9] Miles M P, Clarkson P M, Bean M,etal. Muscle function at the wrist following 9d of immobilization and suspension[J].Med Sci Sports Exerc, 1994,26(5):615-623.
[10]周俊明,徐曉君,張沈煜,等.臂叢神經損傷規范化康復治療的臨床研究[J].中國康復醫學雜志,2011,26(2):124-127.
[11]Tersis J K. Principles and techniques of peripheral nerve[J].Surg Clin Orthop Res, 2002,133:139.
[12]Bustamante J, Socolovsky M, Martins R S,etal. Effects of eliminating tension by means of epineural stitches: a comparative electrophysiological and histomorphometrical study using different suture techniques in an animal model[J].Arq Neuropsiquiatr, 2011,69(2B):365-370.
[13]Lane J M, Bora F J, Pleasure D. Neuroma scar formation in rats following peripheral nerve transection[J].J Bone Joint Surg Am, 1978,60(2):197-203.
[14]劉華蔚,胡敏.周圍神經瘢痕研究進展[J].中華老年口腔醫學雜志,2012,10(4):237-240,246.
[15]Henry F P, Farkhad R I, Butt F S,etal. A comparison between complete immobilisation and protected active mobilisation in sensory nerve recovery following isolated digital nerve injury[J].J Hand Surg Eur Vol, 2012,37(5):422-426.
[16]Schmidhammer R, Zandieh S, Hopf R,etal. Alleviated tension at the repair site enhances functional regeneration: the effect of full range of motion mobilization on the regeneration of peripheral nerves-histologic, electrophysiologic, and functional results in a rat model[J].J Trauma, 2004,56(3):571-584.
[17]Martins R S, Teodoro W R, Simplicio H,etal. Influence of suture on peripheral nerve regeneration and collagen production at the site of neurorrhaphy: an experimental study[J].Neurosurgery, 2011,68(3):765-772.
[18]Narakas A. The use of fibrin glue in repair of peripheral nerve[J].Orthop Clin North Am, 1988,19(1):187-199.
[19]Cruz N I, Debs N, Fiol R E. Evaluation of fibrin glue in rat sciatic nerve repairs[J].Plast Reconstr Surg, 1986,78(3):369-373.
[20]Liang X D, Cai H F, Hao Y Y,etal. Sciatic nerve repair using adhesive bonding and a modifid conduit[J].Neural Regeneration Research, 2014,9(6):594-601.
Effect of Medical Adhesive Braking on Severed Sciatic Nerves for Anastomosis in Rats
ZOU Xiu-qiang1, LIANG Xiang- dang1, GUO Zhan-fang1, SUN Geng2, YU Kuan-kuan1, FANG Zhuo-qun1
(1. The First Department of Osteology, General Hospital of the PLA, Beijing 100853, China; 2. Department of Osteology, 252 Hospital of the PLA, Baoding, Hebei 350025, China)
Objective To observe the effect of medical adhesive braking on severed sciatic nerves for anastomosis in rats. Methods A total of 30 male SD rats were selected and models were established, and then the rats were randomly divided into experiment group (n=15) and control group (n=15). In experiment group, the sciatic nerves were transected at the midpoint, and then were sutured for anastomosis with traditional method under operating microscope. The silica gel tubes were put over the surfaces of nerve suture sites, and the stomas sites were similar with the axial center of the tubes, and then 20 μl medical adhesive were respectively dripped on two sides of the tubes. In control group, the sciatic nerves were transected at the midpoint, and then were sutured for anastomosis with traditional method under operating microscope only. Nerval connective tissues were given general observation, indexes of nervous functions, electrophysiologic detection and histopathological observation were made in postoperative 8thweek, and the hyperplasia conditions of intraneural and extraneural connective tissues were recorded, and the number of regenerated nerve fibers in stomas were detected. Results In postoperative 8thweek, the obvious adhesions were found in nervous and surrounding tissues; the values of function indexes of left sciatic nerve (in the 6thand 8thweeks), neural latency, maximum thickness of scar connective tissue in epineurium and the total area of 4 intraneural connective tissues in experiment group were significantly lower than those in the control group (P<0.05), while the values of neural amplitude and regenerated number of nerve fibers were higher than those in the control group (P<0.05). Conclusion The medical adhesive braking on severed sciatic nerves for anastomosis in rats may inhibit the hyperplasia of scar connective tissues, and promote the regeneration of nerve fibers.
Cyanoacrylates; Braking, reconstructive; Sciatic nerve; Rats
科技部國際合作項目(2014DFA31230)
100853 北京,解放軍總醫院骨科一病區(鄒秀強、梁向黨、郭占芳、余寬寬、房卓群);071000 河北 保定,解放軍252醫院骨科(孫賡)
梁向黨,E-mail:lxd301@263.net
R-332
A
2095-140X(2015)03-0024-04
10.3969/j.issn.2095-140X.2015.03.006
2014-12-02 修回時間:2015-01-30)
*為共同第一作者

