巖藻多糖抑制小鼠心肌梗死后的心臟重構
王曉玲,陳曼華
(華中科技大學同濟醫學院附屬武漢中心醫院 心血管內科,湖北 武漢430014)
巖藻多糖是裙帶菜主要成分之一,具有抗凝血、抗病毒、抗血管生成、抗腫瘤、調節免疫活性[1-2]、抗凋亡[3]、抗氧化應激[4]及抑制炎性反應等多種生物學作用[5]。巖藻多糖抑制炎性反應及抗氧化應激的活性引起了廣泛關注[5]。有研究報道巖藻多糖還具有抗氧化應激及保護DNA 損傷的作用[6]。
心肌梗死后心臟重構是患者發展成為心力衰竭最主要的機制[7-8]。心肌梗死后存活心肌的炎性反應以及氧化應激在其發展成為心力衰竭的過程中發揮著重要作用[9]。巖藻多糖具有抑制炎性反應及抗氧化應激的作用,其在心肌梗死后心室的重構中的作用尚未闡明,本實驗探討巖藻多糖在心肌梗死后心室重構中的作用及其可能機制。
1 材料與方法
1.1 材料
1.1.1 實驗動物:SPF級雄性C57BL/6J 小鼠,6~8周齡,體質量20~25 g[南京醫科大學實驗動物中心;合格證號:SCXK(蘇)-2012-0002]。
1.1.2 試劑:巖藻多糖(北京雷力聯合海洋生物科技有限公司,純度99.7%),埃文斯藍(BioSharp 公司),三苯基氯化物(TTC,Amresco 公司),Trizol(Invitrogen 公司),反轉錄試劑盒(Roche 公司),SDSPAGE 凝膠配制試劑盒(谷歌公司),eNOS、NF-κB、GAPDH 一抗、熒光標記羊抗鼠二抗(Cell Signaling公司),PVDF膜(Millipore 公司)。
1.2 方法
1.2.1 動物處理:將小鼠隨機分為以下4 組:1)假手術組:行冠狀動脈左前降支結扎術,開胸后只掛線,不結扎冠狀動脈,術后給予0.9%氯化鈉溶液灌胃,同藥物處理(n =10);2)心肌梗死模型組:結扎冠狀動脈左前降支建立該模型(n =20);3)& 4)低和高濃度巖藻多糖處理組:心肌梗死術后每日灌胃分別給予200 和500 mg/kg 巖藻多糖處理,持續給藥3 周(均n =20)。所有小鼠3周后斷椎處死取心臟。
1.2.2 RT-qPCR檢測SOD、和iNOS 以及TNFα、IL-1β和TGFβ mRNA的表達:用Trizol 提取心肌的總RNA,用寡聚引物和反轉錄試劑盒將每組2 mg的總RNA 反轉錄為cDNA。把反轉錄產物稀釋3倍,利用LightCycler 480 SYBR Green 實時熒光定量PCR 儀進行PCR 反應。每個樣品設3個復管。將其結果與甘油醛-3-磷酸脫氫酶(GAPDH)基因的表達進行對比,以2-△△Ct計算mRNA的表達。
1.2.3 Western blot檢測eNOS 和NF-κB蛋白表達:心臟經研磨后離心,超聲裂解細胞,離心后取上清液,用BCA法定量各組蛋白濃度。每組取20 μg 蛋白質裂解液進行電泳,在6%~10% SDS-PAGE 凝膠上分離,轉移到PVDF膜上,將膜用含有5%脫脂牛奶在室溫下孵育1 h,用一抗孵育過夜,然后用二抗孵育1 h,用二色紅外成像系統掃描蛋白印跡,檢測每組上訴蛋白的表達水平。同樣每組蛋白表達水平用GAPDH 蛋白的表達校準,結果以目的蛋白/內參蛋白吸光度的均數±標準差(±s)表示(n=6)。
1.3 統計學分析
2 結果
2.1 巖藻多糖提高小鼠心肌梗死后的存活率,改善心功能,減少心肌梗死面積
巖藻多糖處理組術后存活率明顯高于模型組小鼠(病死率50%)(P<0.05),低濃度和高濃度巖藻多糖小鼠死亡率分別為20%和25%。與模型組相比巖藻多糖明顯減小左室收縮末內徑(LVESd)和左室舒張末內徑(LVEDd),增加左室射血分數(LVEF)和左室短軸縮短率(LVFS),高濃度巖藻多糖的效果優于低濃度組。MI 術后3 周巖藻多糖處理的小鼠心重/體質量(HW/BW)和肺重/體重(LW/BW)明顯低于模型組,高濃度巖藻多糖作用更加明。巖藻多糖處理后的小鼠心臟心肌梗死面積明顯小于模型組,高濃度巖藻多糖處理組心肌梗死面積最小(表1)。
2.2 RT-qPCR檢測心臟炎性因子及SOD 和iNOS mRNA的表達
與假手術組相比,模型組術后心肌TNFα、IL-1β、TGFβ 及iNOS mRNA表達明顯增加,而SOD的mRNA表達降低。巖藻多糖能降低模型組心臟炎性因子TNFα、IL-1β、TGFβ 及iNOS mRNA表達,高濃度巖藻多糖明顯增加SOD的mRNA表達,低濃度巖藻多糖無明顯影響(表2)。
表1 各組小鼠心功能、心重及心肌梗死面積的比較Table1 The cardiac function,heart weight and myocardial infarct size in each group (±s)

表1 各組小鼠心功能、心重及心肌梗死面積的比較Table1 The cardiac function,heart weight and myocardial infarct size in each group (±s)
*P<0.05 compared with sham group;#P<0.05 compared with model group.
group LVESd/mm LVEDd/mm LVEF/%LVFS/%HW/BW(mg/g)LW/BW(mg/g)infraction size/%sham(n=10) 2.35±0.18 3.33±0.06 79.00±1.83 42.30±2.15 4.18±0.25 4.57±0.18 -model(n=20) 4.96±0.76* 5.86±0.49* 48.80±6.83* 23.00±2.41* 8.54±1.51* 8.60±0.71* 52.32±7.15*fucoidan(200 mg/kg)(n=20) 3.67±0.80* # 4.35±0.18* # 64.30±5.54* # 31.50±3.30* # 6.77±0.75* # 6.32±0.49* # 40.14±7.82* #fucoidan(500 mg/kg)(n=20) 3.15±0.27* # 3.95±0.09* # 68.60±2.54* # 35.90±0.58* # 5.76±0.13* # 5.96±0.27* # 38.66±6.88*#
表2 小鼠心臟炎性因子TNFα、IL-1β、和TGFβ 及iNOS 和SOD mRNA表達Table2 The mRNA expression levels of inflammation factors (±s,n=3)

表2 小鼠心臟炎性因子TNFα、IL-1β、和TGFβ 及iNOS 和SOD mRNA表達Table2 The mRNA expression levels of inflammation factors (±s,n=3)
*P<0.05 compared with sham group;#P<0.05 compared with model group.
group TNFα(×10 -4) IL-1β(×10 -3) TGFβ(×10 -2)iNOS SOD sham 8.39±1.97 2.30±1.16 1.78±1.25 25.12±1.32 1 199±3 model 37.31±3.34* 4.24±0.90* 4.97±0.25* 59.03±0.37* 575±3*fucoidan(200 mg/kg) 18.35±1.69* # 2.75±0.83* # 3.25±0.16* # 37.50±0.66* # 716±2* #fucoidan(500 mg/kg) 12.43±1.71* # 2.62±1.54* # 2.11±0.44* # 33.52±0.62* # 1 007±2*#
2.3 Western blot檢測
模型組NF-κB的表達增高(P<0.05),而磷酸化eNOS表達下降;高濃度巖藻多糖處理組NF-κB的表達顯著下降(P<0.05),而磷酸化eNOS的表達趨于正常(圖1,表3)。
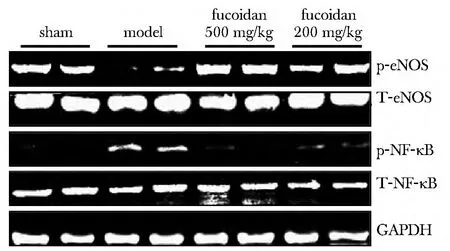
圖1 小鼠心臟eNOS 及NF-κB的蛋白表達Fig1 The expression levels of eNOS and NF-κB
表3 小鼠心臟eNOS 及NF-κB的蛋白表達Table3 The expression levels of eNOS and NF-κB(±s,n=6)
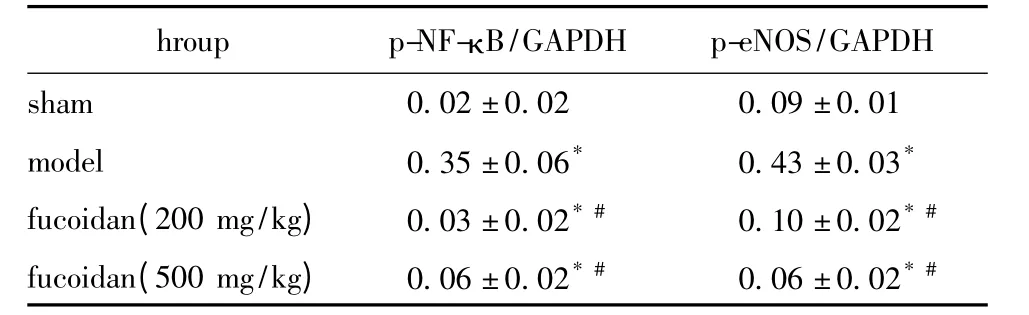
表3 小鼠心臟eNOS 及NF-κB的蛋白表達Table3 The expression levels of eNOS and NF-κB(±s,n=6)
*P<0.05 compared with sham group;#P<0.05 compared with model group.
hroup p-NF-κ B/GAPDH p-eNOS/GAPDH sham 0.02±0.02 0.09±0.01 model 0.35±0.06* 0.43±0.03*fucoidan(200 mg/kg) 0.03±0.02* # 0.10±0.02* #fucoidan(500 mg/kg) 0.06±0.02* # 0.06±0.02*#
3 討論
缺血引起的心肌纖維化、炎性反應和細胞凋亡是心肌梗死后左心室心肌重構的必要因素。而一些促炎因子在心肌重構的發病過程中發揮著關鍵作用,例如轉化生長因子β(TGF-β)、腫瘤壞死因子α(TNF-α)和IL-1β,抑制這些細胞因子的表達可以減緩心肌重構的進程。NF-κB是轉錄調節因子,在心血管疾病中發揮著多種作用,包括調節炎性反應、細胞存活、分化和增殖[10]。本研究表明巖藻多糖可以抑制上述炎性因子的mRNA表達,減少NF-κB的活化,從而抑制心肌梗死后的心臟重構。
氧化應激在心肌梗死后心臟重構中也發揮重要作用[11]。SOD是生物體內重要的抗氧化酶,是生物體內清除自由基的首要物質,在心肌梗死后心臟重構的過程中伴隨著SOD的表達下降,體內氧自由基清除減少,從而加重了心肌重構的病理過程。在心肌梗死后的心臟重構過程中iNOS的表達增加,刺激機體產生更多的活性氮,增加心臟的氧化應激損傷。eNOS 為內源性NOS,活化的eNOS 途徑可誘導eNOS的磷酸化,增加NO 合成。這種eNOS 和NO可通過調節血管保護心臟重構以及血管生成[12]。本結果表明巖藻多糖能增加心肌梗死后小鼠心臟SOD的表達,減少iNOS mRNA的表達,增加活化的的eNOS的蛋白表達,證明巖藻多糖可以通過增強體內抗氧化應激的作用有效減緩心肌重構。
本實驗證實了巖藻多糖可以減緩心肌梗死后的心臟重構,其機制主要是通過其抗炎及抗氧化應激作用。而巖藻多糖是否能減緩心肌梗死后的心肌纖維化尚需要進一步證實。
[1]Kim SK,Pangestuti R.Biological activities and potential health benefits of fucoxanthin derived from marine brown algae[J].Adv Food Nutr Res,2011,64:111-128.
[2]Liu F,Wang J,Chang AK,et al.Fucoidan extract derived from Undaria pinnatifida inhibits angiogenesis by human umbilical vein endothelial cells[J].Phytomedicine,2012,19:797-803.
[3]Yang L,Wang P,Wang H,et al.Fucoidan derived from Undaria pinnatifida induces apoptosis in human hepatocellular carcinoma SMMC-7721 cells via the ROS-mediated mitochondrial pathway [J].Mar Drugs,2013,11:1961-1976.
[4]Mak W,Hamid N,Liu T,et al.Fucoidan from New Zealand Undaria pinnatifida:monthly variations and determination of antioxidant activities[J].Carbohydr Polym,2013,95:606-614.
[5]Kim KJ,Lee BY.Fucoidan from the sporophyll of Undaria pinnatifida suppresses adipocyte differentiation by inhibition of inflammation related cytokines in 3T3-L1 cells[J].Nutr Res,2012,32:439-447.
[6]Rafiquzzaman SM,Kim EY,Kim YR,et al.Antioxidant activity of glycoprotein purified from Undaria pinnatifida measured by an in vitro digestion model.[J]Int J Biol Macromol,2013,62:265-272.
[7]王超,苗齊.miRNAs 在心肌梗死和心力衰竭中的作用[J].基礎醫學與臨床,2013,33:508-511.
[8]周煒,陳玲,周逸,等.阿托伐他汀下調大鼠心肌梗死后線粒體融合素2表達和細胞凋亡[J].基礎醫學與臨床,2014,34:168-172.
[9]Al-Rasheed NM,Attia HA,Mohamed RA,et al.Preventive effects of selenium yeast,chromium picolinate,zinc sulfate and their combination on oxidative stress,inflammation,impaired angiogenesis and atherogenesis in myocardial infarction in rats[J].J Pharm Pharm Sci,2013,16:848-867.
[10]Martin K,Huang CL,Caplice NM.Regenerative approaches to post-myocardial infarction heart failure[J].Curr Pharm Des,2014,20:1930-1940.
[11]Zhao W,Zhao T,Chen Y,et al.Modification of oxidative stress on gene expression profiling in the rat infarcted heart[J].Mol Cell Biochem,2013,379:243-253.
[12]Fan Q,Chen M,Fang X,et al.Aging might augment reactive oxygen species (ROS)formation and affect reactive nitrogen species (RNS)level after myocardial ischemia/reperfusion in both humans and rats[J].Age (Dordr),2013,35:1017-1026.

