銀杏提取物對血管緊張素II誘導的新生大鼠心肌細胞凋亡的影響*
李 偉, 羅振華, 付凌云, 沈祥春, 吳立榮, 劉興德**
(1.貴州醫科大學附院 心血管科, 貴州 貴陽 550004; 2.貴州省人民醫院 中心實驗室, 貴州 貴陽 550002; 3.貴州醫科大學 藥學院, 貴州 貴陽 550025)
·基礎研究·
銀杏提取物對血管緊張素II誘導的新生大鼠心肌細胞凋亡的影響*
李 偉1, 羅振華2, 付凌云3, 沈祥春3, 吳立榮1, 劉興德1**
(1.貴州醫科大學附院 心血管科, 貴州 貴陽 550004; 2.貴州省人民醫院 中心實驗室, 貴州 貴陽 550002; 3.貴州醫科大學 藥學院, 貴州 貴陽 550025)
目的: 探討銀杏葉提取物(GBE)對血管緊張素II(AngII)誘導的新生大鼠心肌細胞凋亡的影響。方法: 分離與培養新生SD大鼠原代心肌細胞,采用AngII誘導乳鼠心肌細胞凋亡后將細胞分陰性對照組(A組,細胞培養液)、AngII組(B組, AngII 10-5mol/L干預)、ALK5抑制劑組(C組,SB431542 6 mg/L及 AngII 10-5mol/L)、GBE低劑量組(D組,GBE 2 mg/L及AngII 10-5mol/L)及GBE 高劑量組(E組,GBE 20 mg/L及AngII 10-5mol/L),采用流式細胞儀和原位末端標記技術(TUNEL法)檢測各組大鼠心肌細胞凋亡情況。結果: B組心肌凋亡率明顯高于其他各組,差異有統計學意義(P<0.05);與B組比較,C、D及E組的心肌細胞凋亡率均降低,其中C組和E組細胞凋亡率與B組比較,差異有統計學意義(P<0.01)。結論: GBE能夠抑制AngII誘導的心肌細胞凋亡,具有保護心肌細胞的作用。
銀杏葉提取物; 血管緊張素II; 細胞凋亡; 心室重塑
細胞凋亡(apoptosis)亦稱程序性細胞死亡(programmed cell death,PCD),是細胞在自身基因調控下的一種主動死亡,是組織細胞必要的代謝過程。但是,過度的細胞凋亡會導致嚴重后果,如心肌梗死后缺血缺氧導致的心肌細胞凋亡是心室重塑的重要病理原因之一[1]。心肌細胞凋亡發生后,該區域會出現壞死、液化及吸收過程,心室壁會逐漸變薄,心室進行性擴張,導致到心室重塑,最后發生心力衰竭,甚至誘發患者猝死[2-3]。研究發現,心肌細胞凋亡亦可發生在急性心肌梗死(acute myocardial infarction,AMI)后非梗死區[4]。因此,尋找合理有效的防治與逆轉心肌重塑的藥物,對降低AMI病死率有著重要意義。銀杏葉提取物(ginkgo biloba extract,GBE)是從銀杏葉中提取的一種混合物,具有獨特藥理活性,其中黃酮類和萜類內酯化合物是銀杏葉提取物的主要有效成分[5]。GBE對心肌缺血的損傷具有保護作用,其機制可能與清除自由基和抗脂質過氧化、擴張冠脈血管、改善微循環、抗自由基誘導的細胞凋亡等作用有關[6-7],但目前關于GBE對AMI后心肌重塑的抑制或逆轉作用國內外少見報道,本研究旨在觀察GBE對血管緊張素II(angiotensin II,AngII)誘導的新生大鼠心肌細胞凋亡的影響,為探討GBE對心肌重塑防治作用提供理論依據。
1 材料與方法
1.1 材料
1.1.1 實驗動物及飼養環境 清潔級SD雌性大鼠24只,雄性大鼠8只,體重200~250 g,由中國人民解放軍第三軍醫大學附屬大坪醫院實驗動物中心提供。貴州醫科大學動物倫理委員會(IAEC)審查允許,許可證號SCXK2013-0001。實驗動物由貴州醫科大學動物實驗中心清潔級實驗室飼養,實驗室恒溫、恒濕。雌、雄大鼠按照3∶1的比例共圈飼養,出生1~3 d的乳鼠作為實驗用鼠。
1.1.2 實驗藥材 銀杏葉提取物,批號WGBEXP130918,由貴州省工程中心研究員提供,呈黃色粉末,成分包括總黃酮26.16%(槲皮素醇苷11.06%、山奈素醇苷11.93%、異鼠李素醇苷3.17%)及銀杏總內酯6.28%(銀杏內酯C1.23%、白果內酯1.81%、銀杏內酯A2.48%、銀杏內酯B0.76%)。
1.1.3 主要試劑與儀器 AngII試劑盒(美國Sigma公司),Donkey Anti-Rabbit IgG (H+L) Antibody(美國life technologies公司),Anti-cardiac troponin antibody、α-Actin antibody試劑盒(美國Santa公司),Annexin V/PI apoptosis kit凋亡檢測試劑盒(杭州聯科生物技術股份有限公司),TUNEL細胞凋亡原位檢測試劑盒(瑞士ROCHE公司),H1650R臺式高速冷凍離心機(上海盧湘儀),Accuri C6流式細胞儀(美國BD公司)。
1.2 方法
1.2.1 新生SD大鼠原代心肌細胞的分離與培養 取出生1~3 d SD大鼠乳鼠,雌雄皆可,超凈臺內無菌操作取乳鼠心臟,仔細剝離心房及大血管組織,留心室組織。將心室組織置于冰浴的PBS中,浸泡洗滌3次,吸凈PBS液后用虹膜剪將心室組織剪成大小約0.5~1 mm3碎塊。加入0.1%胰蛋白酶消化組織碎塊,反復吹打置37 ℃恒溫水浴搖床消化,5 min/次,消化5~7次,收集每次消化液于10% FBS-DMEM中(第一次消化液棄)。100-200目篩網過濾,混勻細胞,1 000 r/min,10 min,用DMEM洗滌,再次混勻細胞,1 000 r/min,10 min,棄上清將細胞重懸于含10%胎牛血清的DMEM培養液中,將細胞培養瓶置于37 ℃,5% CO2恒溫培養箱中差速貼壁2 h。2 h后收集未貼壁細胞接種于培養板中繼續生長,培養24 h后細胞首次換液,48 h更換無血清DMEM繼續培養12 h,細胞生長同步后做后續實驗。
1.2.2 新生大鼠心肌細胞鑒定 將新生大鼠心肌細胞接種于放置有載玻片的12孔板中,1×105個/孔,加入含10%胎牛血清的DMEM培養液培養48 h后,換無血清DMEM培養基同步化后,采用免疫細胞化學SP染色法鑒定分離培養的心肌細胞,采用培養4 d的原代心肌細胞,觀察細胞內是否表達大鼠心肌肌動蛋白(α-Actin)和肌鈣蛋白(cardiac troponin),細胞胞質內出現棕黃色顆粒為陽性反應。
1.2.3 流式細胞儀( FCM)檢測AngII誘導新生大鼠心肌細胞凋亡的濃度效應關系 取1~3 d乳鼠按照1.2.1步驟制備原代心肌細胞,在含10%胎牛血清的 DMEM培養液培養48 h,換無血清DMEM培養基培養12 h同步化后,分別加入最終濃度為10-8mol/L,10-7mol/L,10-6mol/L,10-5mol/L的AngII,給藥后培養48 h。1 000 r/min離心10 min收集細胞,加入10 mol/L PBS (pH=7.2)緩沖液500 μL洗滌3次,棄上清,設置陰性對照組(不加染料)。加入1×Binding Buffer 100 μL重懸細胞,在反應體積加入5 Μl FITC探針和10 μL PI探針混勻,4 ℃避光孵育10 min,用BD AccuriTMC6流式細胞儀檢測各組心肌細胞凋亡率。FITC激發波長488 nm,發射波長525 nm,綠色熒光FL1通道檢測;PI-DNA復合物激發波長535 nm,發射波長615 nm,紅色熒光FL2通道檢測。用BD AccuriTMC6軟件繪制雙色散點圖,FITC為橫坐標,PI為縱坐標。每個樣采集10 000 events。每組實驗重復3次。根據實驗結果,AngII誘導心肌細胞凋亡的最佳濃度為10-5mol/L以該濃度做后續實驗。
1.2.4 實驗分組 根據1.2.3中選出的AngII誘導心肌細胞凋亡的最佳濃度,共分為5組。(1)A組,陰性對照組,加入藥物同容積的細胞培養液;(2)B組,AngII組, AngII(10-5mol/L)干預;(3)C組,SB431542抑制劑作用組,加入SB431542(6 mg/L)及 AngII(10-5mol/L);(4)D組,GBE低劑量組,加入GBE(2 mg/L)及 AngII(10-5mol/L);(5)E組,GBE 高劑量組, 加入GBE(20 mg/L)及AngII(10-5mol/L)。
1.2.5 FCM檢測各組心肌細胞凋亡 按照1.2.3步驟,收集各組心肌細胞,上機檢測細胞凋亡率。
1.2.6 原位末端標記技術(TUNEL法)檢測心肌細胞凋亡 按照TUNEL細胞凋亡原位檢測試劑盒(ROCHE)操作說明,采用4%多聚甲醛室溫固定細胞爬片20 min,PBS漂洗2遍;加TUNEL反應混合液50 μL于標本上,用封口膜密封于暗濕盒中37 ℃反應60 min,PBS漂洗3次,每次5 min;加DAB底物50~100 μL,顯微鏡下控制顯色,PBS終止顯色;蘇木精液染色5~10 min后,PBS漂洗2次后中性樹膠封片,拍照觀察。根據陽性細胞分布情況,每張切片200倍鏡下選擇10個陽性視野,計數200個細胞中的陽性細胞數(細胞核棕黃色)作為凋亡指數,計算細胞凋亡率(%)。
1.3 統計學方法
2 結果
2.1 原代心肌細胞的培養及鑒定
倒置顯微鏡下剛分離的心肌細胞呈圓球形、棒狀,漂浮在培養液中;24 h后細胞逐漸開始向外突起伸展,貼壁后部分心肌細胞出現自發性搏動;48 h后細胞逐漸展開,心肌細胞呈梭形或多角形,含有1~2個核;72 h后細胞逐漸形成細胞簇并出現同步搏動,心肌細胞純度達90%以上。免疫細胞化學SP法染色顯示,陰性對照可見心肌細胞呈梭形或多角形,胞漿無色,胞核橢圓藍色(圖1A);加抗體組可見心肌細胞染成棕黃色,肌動蛋白和肌鈣蛋白在胞內表達。免疫染色結果顯示分離培養的心肌細胞純度達95%以上,符合心肌細胞的特征(圖1B、C)。
2.2 AngII誘導新生大鼠心肌細胞凋亡的濃度效應關系
在心肌細胞培養液中加入10-8mol/L,10-7mol/L,10-6mol/L和10-5mol/L AngII,48 h后流式細胞儀觀察結果顯示,隨著AngII濃度的增加,心肌細胞凋亡率逐漸上升, 10-5mol/L AngII心肌凋亡率最高,為(8.5±0.8)%(圖2),與對照比較差異具有統計學意義(P<0.05),根據實驗結果和參考文獻,選取10-5mol/L為AngII誘導凋亡的最佳濃度進行后續試驗。
2.3 FCM檢測各組心肌細胞凋亡
FCM檢測結果顯示,B組心肌凋亡率明顯高于其他各組,差異具有統計學意義(P<0.05),說明AngII刺激心肌細胞發生凋亡造模成功。用藥物干預后與B組比較,C、D及E組細胞凋亡率均降低,C組和E組細胞凋亡率與B組比較,差異有統計學意義(P<0.01),見圖3。
2.4 TUNEL法檢測心肌細胞凋亡
通過TUNEL染色心肌細胞后鏡下可見,對照組心肌細胞保持正常形態,呈梭形或多角形,胞質呈伸展突起,胞核橢圓形,1~2個,胞核染色藍色,胞漿均一染成淺藍色(見圖4A);B組貼壁細胞出現皺縮、變圓和脫落,出現凋亡細胞,細胞變小、變圓,細胞胞漿和胞核染色呈棕黃色,染色體固縮,呈深棕色(見圖4B);細胞內染色質成塊狀,在細胞胞漿內形成圓形、深棕色的凋亡小體(見圖4C),這些為TUNEL陽性凋亡細胞。C、D及E組鏡下可見正常心肌細胞和少量的凋亡細胞(圖4D、4E、4F)。與對照組比較,B、C、D及E組心肌細胞凋亡率均有所增加,差異具有統計學意義(P<0.05);與B組比較,C、D及E組細胞凋亡率均有所下降,其中C組和E組細胞凋亡率與B組比較,差異有統計學意義(P<0.05)。見圖5。
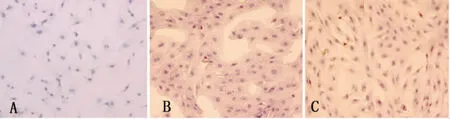
注:A.陰性對照組;B.抗肌動蛋白染色;C.抗肌鈣蛋白染色
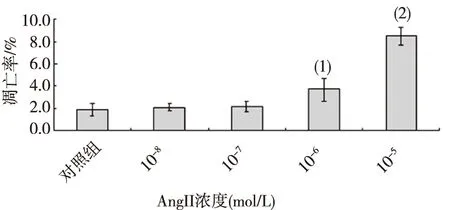
注:與對照組比較,(1)P<0.05,(2) P<0.01。
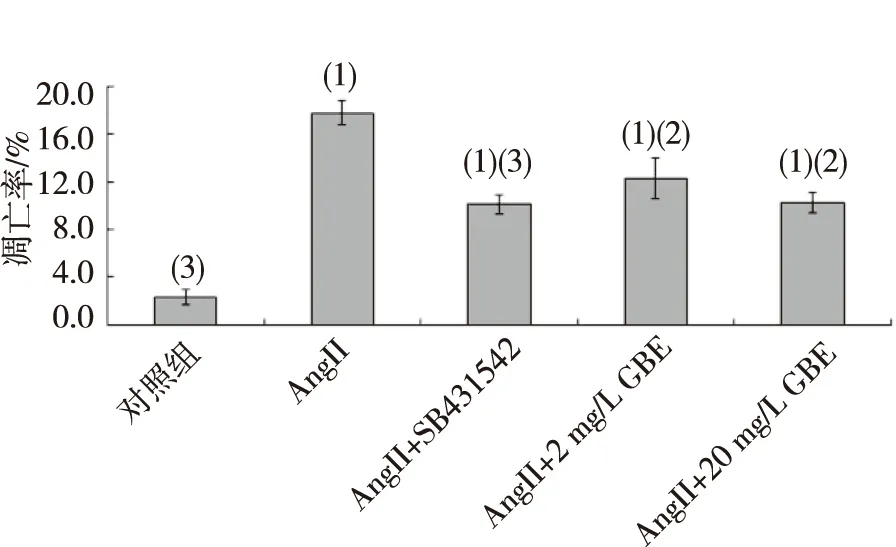
注:與對照組比較,(1)P<0.01;與AngII造模組比較,(2)P<0.05,(3)P<0.01
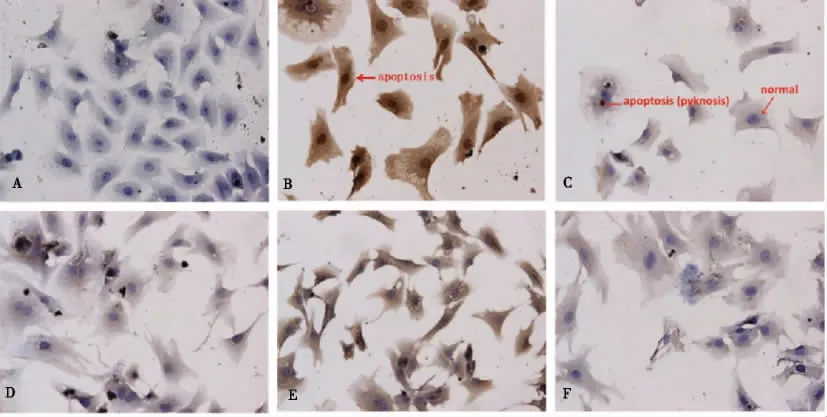
注:A為A組, B、C為B組,D為C組, E為D組, F為E組
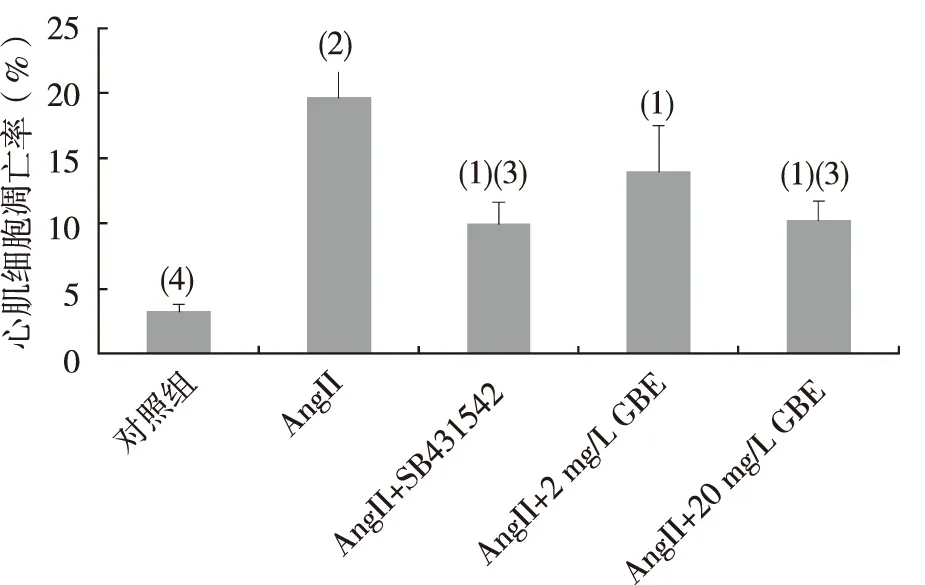
與對照組比較,(1)P<0.05,(2)P<0.01;與AngII造模組比較,(3)P<0.05,(4)P<0.01
3 討論
腎素-血管緊張素系統(renin-angiotensinsystem, RAS)或腎素-血管緊張素-醛固酮系統是人體內重要的體液調節系統,血管緊張素轉換酶(angiotensin converting enzyme, ACE)和血管緊張素Ⅱ受體作為重要效應因子參與了腎素-血管緊張素系統的生理調節作用,尤其是AngII通過作用于相應組織器官上的受體,起到收縮血管平滑肌等重要作用。研究證實AngII能誘導心肌細胞凋亡,Kajstura J等[8]描述了在試驗大鼠的心肌細胞中AngII誘導的凋亡反應。
GBE具有多種藥理學活性,包括抗氧化及抗炎等,有研究表明銀杏內酯B能促進視網膜神經節細胞軸突生長[9]。銀杏葉提取物作用于阿霉素所致大鼠心肌損傷模型,能起到抗氧化和抗凋亡作用[10-11]。還有研究者發現銀杏葉提取物作用于缺血/再灌注大鼠模型能顯著抑制心肌Bax、Caspase-3及Cyt-c蛋白的表達[7]。黃迪南等[12]發現GBE化學活性成分EGb761能有效抑制TNF-α誘導的HeLa 細胞凋亡;劉彥等[13]發現GBE能夠對大鼠在體缺血再灌注的心肌起到保護作用, 并促使心肌細胞凋亡的減少。本研究將GBE作用于AngII誘導的乳鼠心肌細胞凋亡模型,觀察GBE的抗心肌凋亡作用。在心肌細胞培養液中加入10-8mol/L,10-7mol/L,10-6mol/L和10-5mol/LAngII,選擇合適濃度制作AngII誘導的心肌細胞凋亡實驗模型,48 h后用流式細胞儀觀察每個濃度心肌細胞凋亡情況,發現隨著AngII濃度的增加,心肌細胞凋亡率逐漸上升,當AngII濃度為10-5mol/L時心肌凋亡率最高,比對照組明顯增加,表明AngII可促使心肌細胞調亡,選取10-5mol/L AngII為誘導凋亡的最佳濃度。培養48 h后,在倒置相差顯微鏡下觀察心肌細胞,部分細胞體積變小,細胞變圓,部分胞體增大,形態不規則呈異型,喪失梭形形態,自發搏動明顯減弱。TUNEL法觀察造模組貼壁細胞出現皺縮、變圓和脫落,出現凋亡細胞,細胞變小、變圓,細胞胞漿和胞核染色呈棕黃色,染色體固縮,可見深棕色凋亡小體。加入藥物干預后發現,ALK5抑制劑SB431542能夠有效的抑制AngII誘導心肌細胞發生凋亡;在加入高濃度GBE后,流式細胞儀以及TUNEL法檢測結果均顯示,與AngII造模組比較高濃度GBE藥物作用組的凋亡細胞數量明顯減少,與AngII抑制劑使凋亡細胞數量減少的效果相類似。表明GBE能夠顯著的抑制由AngII引起的心肌細胞凋亡反應, GBE通過何種途徑抑制AngII誘導的心肌細胞的凋亡,將做進一步的研究。
[1] Hojo Y, Saito T, Kondo H. Role of apoptosis in left ventricular remodeling after acute myocardial infarction[J]. Journal of Cardiology, 2012(2):91-92.
[2] Ren R, Oakley RH, Cruz-Topete D, et al. Dual role for glucocorticoids in cardiomyocyte hypertrophy and apoptosis[J]. Endocrinology, 2012(11): 5346-5360.
[3] Joseph B. Muhlestein. Adverse left ventricular remodeling after acute myocardial infarction: is there a simple treatment that really works[J].European Heart Journal, 2014(3):144-146.
[4] Pu J, Yuan A, Shan PR, et al. Cardiomyocyte-expressed farnesoid-X-receptor is a novel apoptosis mediator and contributes to myocardial ischaemia/reperfusion injury[J]. Eur Heart J, 2013(24):1834-1845.
[5] Liu XP, Luan JJ, Christopher EG. Comparison of the antioxidant activity amongst gigkobiloba extract and its main components[J].Chinese Medicinal Materials, 2009(5):736-740.
[6] Ranl K, Yangl DL, Chang YT, et al.Ginkgo biloba extract postconditioning reduces myocardial ischemia reperfusion injury[J].Genetics and Molecular Research, 2014(2):2703-2708.
[7] Qiao ZY, Huang JH, Ma JW et al. Ginkgo biloba extract reducing myocardium cells apoptosis by regulating apoptotic related proteins expression in myocardium tissues[J].Mol Biol Rep , 2014(41):347-353.
[8] Kajstura J, Cigola E, Malhotra A, et al. Angiotensin II induces apoptosis of adult ventricular myocytes in vitro[J]. J Mol Cell Cardiol, 1997(29):859-870.
[9]Wang ZYl, Mo XF, Jiang XH. Ginkgolide B promotes axonal growth of retina ganglion cells by anti-apoptosis in vitro[J]. Sheng Li Xue Bao, 2012(4):417-424.
[10]Boghdady NA. Antioxidant and antiapoptotic effects of proanthocyanidin and ginkgo biloba extract against doxorubicin-induced cardiac injury in rats[J].Cell Biochem Funct, 2013(4):344-351.
[11]Tsun JL, Yueh CY ,Chih TT , et al .Ginkgo biloba extract 761 reduces doxorubicin -induced apoptotic damage in rat heart s and neonatal cardiomyocytes[J].Cardiovascular Research, 2008(80):227-235 .
[12]黃迪南,侯敢.銀杏葉提取物EGb761對TNF-a誘導HeLa 細胞凋亡的影響[J].實用癌癥雜志, 2005 (1):31-33.
[13]劉彥, 楊玉雙, 張澤冰.銀杏提取物對缺血再灌注的心肌保護作用及作用機制[J]. 南京醫科大學學報:自然科學版, 2008 (2):226-228.
(2015-05-18收稿,2015-06-30修回)
中文編輯: 周 凌; 英文編輯: 劉 華
The Effect ofGinkgobilobeExtract on Apoptosis of Neonate Rat Cardiac Myocytes Induced by AngII
LI Wei1, LUO Zhenhua2, FU Lingyun3, SHEN Xiangchun3, WU Lirong1, LIU Xingde1
(1.DepartmentofCardiovascularMedicine,AffiliatedHospitalofGuizhouMedicalUniversity,Guiyang550004,Guizhou,China; 2.CentralLaboratory,GuizhouProvincialPeople'sHospital,Guiyang550002,Guizhou,China; 3.Collegeofpharmacy,GuizhouMedicalUniversity,Guiyang550025,Guizhou,China)
Objective: To investigate the protective effect ofGinkgobilobaextract (GBE) on apoptosis of neonate rat cardiac myocytes induced by AngII. Methods: The neonate SD rat primary culture cardiac myocytes were separated and cultured. The injury of rat primary culture cardiac myocytes (RPCCM) was induced by AngII, and then incubated with GBE and ALK5 inhibitor. The experimental groups were randomly divided into 5 groups as following: group A: negative control group, the RPCCM+equality volume culture medium, group B: AngII group, RPCCM+AngII (10-5mol/L), group C: SB431542 inhibitor action group, RPCCM+SB431542 (ALK5 inhibitor, 6 g/mL) + AngII (10-5mol/L), group D: GBE low dose group, RPCCM+GBE (2 mg/L) + AngII (10-5mol/L), group E: GBE high dose group, RPCCM+GBE (20 mg/L) + AngII (10-5mol/L). The apoptotic morphology was detected by HE staining in the cardiac myocytes induced by AngII, and the cardiac myocytes apoptosis were detected by flow cytometry and TUNEL staining. Results: The myocardial apoptosis rate in group B (AngII group) was significantly higher than that in other groups(P<0.05). Compared with group B, the myocardial apoptosis rate in group C, group D and group E were decreased, and there was statistical significance between group C, group E and group B(P<0.01). Conclusion: GBE can significantly inhibit apoptosis induced by AngII and protect myocardial cells.
Ginkgobilobaextract; angiotensin II; apoptosis; ventricular remodeling
國家自然科學基金項目(No.81173586); 貴州省社會發展攻關項目[No.黔科合SY 字(2011)3011號]
時間:2015-08-07
http://www.cnki.net/kcms/detail/52.5012.R.20150807.2242.016.html
R541
A
1000-2707(2015)09-0910-05
**通信作者 E-mail:lxd@gmc.edu.cn

