心肌無針注射的可行性及規律
吳 奇 李文章 黃 晶
(重慶醫科大學附屬第二醫院心血管內科,重慶 400331)
目前心血管疾病已經成為危害人類健康最主要的原因之一,其中心肌梗死患者的死亡率為正常人群的4~6倍〔1〕。研究表明通過心肌內注射干細胞或基因能促進心肌血管再生并改善心臟功能〔2~5〕。然而采用傳統的有針注射方式進行心肌藥物投送時較難實現對進針深度的準確控制,因此存在心包填塞,血栓形成,誘發心律失常等風險〔6〕,因此有必要摸索一種更為安全有效的心肌注射途徑。無針噴射技術是采用機械或高壓氣體為動力源,經能量轉換,將液態藥物經噴射孔噴出并滲透到皮下或肌肉發揮藥效。早在20世紀40年代無針注射就開始被用于大范圍的免疫接種和胰島素注射〔7,8〕,至21世紀初已被用于基因注射〔9〕。但由于不完全噴射及噴射過程中存在液體回濺等情況〔10〕,無針噴射技術在臨床應用中受到了一定的限制。同時由于心臟不同于皮膚組織,采用無針注射進行藥物投送仍然存在心肌穿孔的可能。因此本實驗將探討心肌無針注射的可行性及其規律,為實現安全、有效的心肌無針注射提供實驗依據,同時也為無針噴射技術進一步應用于各種內臟器官的藥物投送提供實驗基礎。
1 材料與方法
1.1 設備 無針注射器(美國Injex公司Injex30無針注射系統)由固定機身、一次性無菌安瓿等組成。安瓿噴口直徑為0.172 mm,內徑為3.3 mm,最大容量為300μl。當觸發扳機釋放彈簧壓力(相當于205個大氣壓推動安瓿里的藥流),以推動安瓿瓶內液體通過其前端的微噴口進行注射。本實驗對注射器進行改裝,通過對原安瓿進行加工,制作了噴口直徑分別0.30 mm,0.40 mm的安瓿。
1.2 實驗材料 新鮮離體豬心,以9%生理鹽水灌洗后并用濾紙吸凈心外膜水分備用。
1.3 測量噴射最大壓強 利用Injex無針注射系統對小型壓力傳感器進行無針噴射,通過多通道生理信號采集儀(成都儀器廠,RM-6240B/C型多道生物信號采集與處理系統)記錄噴射過程中得到的波形圖,并測量最大噴射壓強。在噴射過程中利用自制的支架使安瓿瓶微噴口與傳感器表面始終保持1 mm的距離〔11〕。根據液體產生的能量不變的原理,將記錄得到的結果代入公式(1),可以得出液體噴射產生的壓力大小,再根據公式(2)可以得出液體噴射過程中產生的最大壓強。其中傳感器所承受的壓強(P傳)可通過測量結果讀出,傳感器表面直徑(d傳)為 1.28 cm,噴口直徑(d噴口)分別為0.172 mm,0.30 mm,0.40 mm。

1.4 噴射效率的評價 選擇不同噴射容量及噴射口徑對離體心肌組織進行注射,通過計算噴射進入離體豬心肌組織的液體質量占總的噴射液體質量的百分比來評價噴射效率〔12〕。噴射前利用微量天平分別測量一只未使用過的安瓿質量(M0),裝有液體的安瓿質量(M1)以及一張干凈濾紙的質量(m1)。對離體心肌組織噴射后,用干凈濾紙吸取噴射過程中回濺在心外膜的液體,再分別測量噴射后余有液體的安瓿質量(M2)及吸收液體后的濾紙質量(m2),將測量結果代入到公式(3),即可得到噴射效率F。

1.5 噴射深度的測量 選擇不同噴射容量及噴射口徑對離體心肌組織進行無射注射,利用手術刀沿噴射孔道垂直切開組織,以游標卡尺測量噴射深度〔13〕并記錄相應的實驗數據。為便于觀測,噴射液體均選用藍色墨水。
1.6 統計學方法 采用SPSS13.0軟件進行方差分析。
2 結果
以噴射容量及噴口直徑為影響因素,噴射壓強、噴射效率及噴射深度為觀察指標的正交實驗結果。當選擇噴口直徑為0.4 mm,分別采用容量為0.15 ml及0.2 ml進行注射時,噴射墨水可以穿透心肌全層,故未錄入該參數下測得結果。
除噴射容量對噴射深度的影響差異具有顯著性外(P<0.05),噴口直徑對噴射深度的影響差異具有極顯著性(P<0.01),各因素影響大小為B>A。隨著噴射容量的增加,噴口直徑的增大,噴射深度會相應的增加。因此,在進行心肌無針注射時,需要選擇合適的噴射容量與噴口直徑,從而避免發生心肌穿孔的可能。見表1。
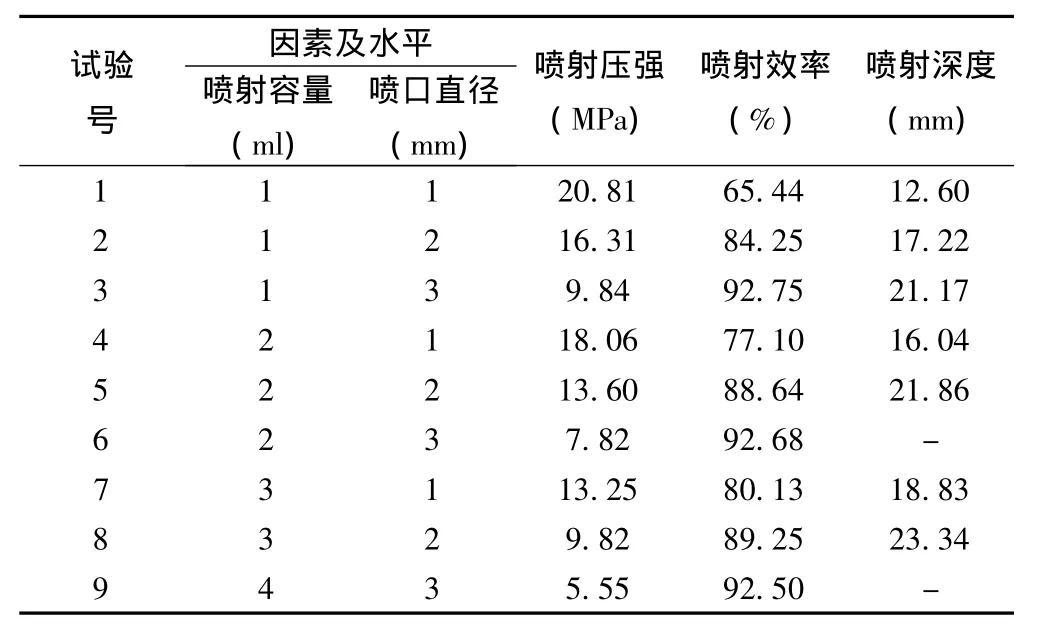
表1 不同參數無針注射的噴射壓強、噴射深度、噴射效率
3 討論
盡管臨床上可采用藥物、介入及外科手術等方法對心肌梗死患者進行治療〔14〕,但壞死的心肌組織不能從根本上得到修復,進而導致患者的心功惡化〔15〕。多項動物實驗和初步的臨床研究表明,通過促進血管生長及干細胞移植等方法可以改善心臟功能及預后〔16~18〕。然而通過何種途徑進行藥物投送從而實現安全有效的心臟血管及心肌細胞再生成為一個重要難點。與經外周靜脈注射,經導管冠脈注射等方法相比,采用心肌內注射藥物投送效率最高且在促進血管再生,改善心功能方面更為有效〔19,20〕。本實驗結果表明通過選擇合適參數,利用無針噴射技術可以實現有效的、深度可探的心肌藥物投送,為改善心臟功能,促進心臟血管及心肌再生提供了一種新的安全,有效的途徑。
心臟彈性模量小于皮膚組織的彈性模量,而本實驗中所使用的INJEX無針注射系統是由美國INJEX公司開發的用于皮下注射胰島素的設備,因此在實驗之初我們對該系統進行了改裝,制作了勢能相當于原廠彈簧50%的彈簧作為推動液體噴射的動力。心肌在舒張期其彈性模量為10~20 kPa,而在收縮期心肌彈性模量可達到200~500 kPa〔21〕,因此進行無針注射時,噴出的液體需要首先克服心肌的彈性模量才能進入心肌組織。由實驗結果可知,本實驗研究中在任意一種參數組合下,噴射產生的最大壓強都要高于心肌的彈性模量,因此利用無針噴射技術對心肌組織進行注射在理論上是可行的。此外有報道表明心肌藥物注射單次注射劑量超過0.2 ml,可對心肌組織造成一定的損傷〔22〕,因此實驗設定單次注射劑量不超過0.2 ml以盡量減小噴射對心肌組織可能造成的損傷。
心臟是一個主動收縮的器官,采用傳統的針頭注射方式注射后,藥物會在心肌收縮力的作用下沿針頭留下的孔道溢出,這也是引起傳統有針注射投送效率較低的原因〔23〕。而采用無針噴射的方式注射后,液體滲透至肌肉層并呈現出莖葉狀的分布〔24〕,這樣就有利于藥物停留在靶區發揮治療作用。本結果表明,隨著噴口直徑的增加噴射的效率呈逐漸升高的趨勢,選擇合適的噴口直徑進行噴射,其液體投送效率可達90%。Schramm-Baxter等〔24〕的研究顯示無針噴射所產生的穿透組織的能量主要受噴射速度的影響,然而隨著噴口直徑增大,噴射的速度會相應的減小,因此理論上噴射直徑越大,液體越難注射入心肌組織。本實驗結果與之相反,其原因在于隨著噴口直徑增大,液體噴射進入組織所需的能量也會減小〔25〕,因此投送的效率也隨之提高。
由于心臟是一個搏動器官,采用有針注射方式進行藥物投送,難以對注射深度進行有效的控制,并可導致心臟穿孔,心包填塞等風險〔6〕。因此根據治療需要,進行深度可控的心肌注射是實現安全的藥物投送的基礎。有研究表明,無針噴射的深度僅與組織的彈性模量及噴射的速度有關〔24〕,而本實驗的結果顯示噴射容量可作為獨立的因素影響噴射深度,同時隨著噴射容量的增加噴射深度也會相應增加,對于這一特性目前尚無明確的理論對其進行解釋。此外由前述內容可知,隨著噴口直徑增大,液體噴射進入組織所需的能量會減小〔25〕,從而使液體噴射的深度增加。因此在利用無針噴射技術對心肌組織進行藥物注射時,需要根據治療的需要選擇合適的噴射容量及噴口直徑以實現對心肌安全地進行藥物投送。
綜上所述,本實驗表明噴射容量與噴口直徑可作為兩個獨立的參數影響噴射的效果,并為無針噴射活體心肌組織選擇參數提供了實驗基礎。此外,由于本實驗一直采用離體心肌組織作為研究對象,在探索心肌無針噴射規律時會存在一定局限性。在今后的實驗研究中,本課題組會進一步探討無針噴射技術應用于活體心肌注射的可行性及其規律。
1 Roger VL,Go AS,Lloyd-Jones DM.Heart disease and stroke statistics-2011 update:a report from the American Heart Association〔J〕.Circulation,2011;123(4):e18-e209.
2 Li SC,Wang L,Jiang H,et al.Stem cell engineering for treatment of heart diseases:potentials and challenges〔J〕.Cell Biol Int,2009;33(3):255-67.
3 盛娓娓,黃 晶,周大燕,等.堿性成纖維細胞生長因子在鼠缺血心肌中表達及其促血管新生作用〔J〕.中國老年學雜志,2009;29(17):2180-3.
4 周大燕,黃 晶,盛娓娓,等.成纖維細胞生長因子對大鼠急性心肌梗死后心室重構的影響〔J〕.解放軍醫學雜志,2009;34(6):691-4.
5 Boodhwani M,Voisine P,Ruel M,et al.Comparison of vascular endothelial growth factor and fibroblast growth factor-2 in a swine model of endothelial dysfunction〔J〕.Eur J Cardiothorac Surg,2008;33(4):645-50;discussion:251-642.
6 Gyongyosi M,Dib N.Diagnostic and prognostic value of 3D NOGA mapping in ischemic heart disease〔J〕.Nat Rev Cardiol,2011;8(7):393-404.
7 Hingson RA,Davis HS,Rosen M.Historical The development of hypospray for parenteral therapy by jet injection〔J〕.Anesthesiology,1949;10(1):66-75.
8 Kendall MA.Needle-free vaccine injection〔J〕.Handb Exp Pharmacol,2010;(197):193-219.
9 Walther W,Stein U,Fichtner I,et al.Low-volume jet injection for efficient nonviral in vivo gene transfer〔J〕.Mol Biotechnol,2004;28(2):121-8.
10 Hoffman PN,Abuknesha RA,Andrews NJ,et al.A model to assess the infection potential of jet injectors used in mass immunisation〔J〕.Vaccine,2001;19(28-29):4020-7.
11 Stachowiak JC,von Muhlen MG,Li TH,et al.Piezoelectric control of needle-free transdermal drugdelivery〔J〕.JControl Release,2007;124:88-97.
12 Linn L,Boyd B,Iontchev H.The effects of system parameters on in vivo injection performance of a needle-free injector in human volunteers〔J〕.Pharmaceut Res,2007;24(8):1501-7.
13 Wangner S,Dues G,Sawitzky D.Assessment of the biological performance of the needle-free injector INJEX using the isolated porcine forelimb〔J〕.Br J Dermatol,2004;150:455-61.
14 Smith SC Jr,Allen J,Blair SN.AHA/ACCguidelines for secondary prevention for patients with coronary and other atherosclerotic vascular disease:2006 update:endorsed by the National Heart,Lung,and Blood Institute〔J〕.Cir Culation,2006;113(19):2363-72.
15 Mingliang R,Bo Z,Zhengguo W.Stem cells for cardiac repair:status,mechanisms,and new strategies〔J〕.Stem Cells Int,2011;2011:310928.
16 Strauer BE,Schannwell CM,Brehm M.Therapeutic potentials of stem cells in cardiac diseases〔J〕.Minerva Cardioangiol,2009;57(2):249-67.
17 Fishbein I,Chorny M,Levy RJ.Site-specific gene therapy for cardiovascular disease〔J〕.Curr Opin Drug Discov Dev,2010;13(2):203-13.
18 Telemaque S,Marsh JD.Modification of cardiovasculation channels by gene therapy〔J〕.Expert Rev Cardiovasc Ther,2009;7(8):939-53.
19 Perin EC,Silva GV,Assad JA,et al.Comparison of intracoronary and transendocardial delivery of allogeneic mesenchymal cells in a canine model of acute myocardial infarction〔J〕.J Mol Cell Cardiol,2008;44(3):486-95.
20 周大燕,黃 晶.不同途徑心臟再生治療的療效比較〔J〕.心血管病學進展,2008;29(6):913-6.
21 Omens JH.Stress and strain as regulators of myocardial growth〔J〕.Prog Biophys Mol Biol,1998;69(2-3):559-72.
22 Baldazzi F,Jorgensen E,Ripa RS,et al.Release of biomarkers of myocardial damage after direct intramyocardial injection of genes and stem cells via the percutaneous transluminal route〔J〕.Eur Heart J,2008;29(15):1819-26.
23 Laham RJ,Post M,Rezaee M,et al.Transendocardial and transepicardial intramyocardial fibroblast growth factor-2 administration:myocardial and tissue distribution〔J〕.Drug Metab Dispos,2005;33(8):1101-7.
24 Schramm-Baxter J,Mitragotri S.Needle-free jet injections:dependence of jet penetration and dispersion in the skin on jet power〔J〕.J Control Release,2004;97(3):527-35.
25 Schramm J,Mitragotri S.Transdermal drug delivery by jet injectors:energetics of jet formation and penetration〔J〕.Pharmaceut Re,2002;19(11):1673-9.

