臍血間充質干細胞移植對腦梗死大鼠的影響及作用機制
單泓等
[摘要] 目的 探討臍血間充質干細胞(mesnchymal stem cells,MSCs)移植對腦梗死大鼠的影響及作用機制。 方法 體外培養臍血間充質干細胞并采用流式細胞儀檢測細胞免疫表型,利用線栓法制作大鼠腦梗死模型;將120只大鼠隨機分成MSCs移植組、對照組;對大鼠進行神經功能評價;Western-blot檢測GFAP蛋白的表達。熒光顯微鏡觀察大鼠海馬結構變化及MSCs在大鼠腦內的分布。 結果 神經功能檢測MSCs移植組神經功能評分降低,對照組神經功能評分升高,差異有統計學意義(P<0.05)。MSCs移植組GFAP的表達量升高,7 d達高峰,對照組無明顯變化(P<0.05)。MSCs移植組MSCs在大鼠腦內分布良好,海馬結構層次清晰,對照組海馬神經組織結構紊亂,神經突觸及細胞器溶解破壞。 結論 MSCs可促進大鼠腦梗死后神經功能恢復及海馬結構的修復,增強神經可塑性。
[關鍵詞] 臍血間充質干細胞;腦梗死;神經可塑性
[中圖分類號] R743.33 [文獻標識碼] A [文章編號] 1673-9701(2015)14-0021-03
[Abstract] Objective To explore the effects and mechanism of implantation of umbilical blood mesenchymal stem cells (MSCs) on rats with cerebral infarction. Methods Umbilical blood MSCs were cultured in vivo, flow cytometry was applied to test cytometric immunophenotype, and model of rat cerebral infarction was made by suture method; 120 rats were randomly assigned to MSCs implantation group and control group; rats' neurological function was evaluated; western-blot was applied to test the expression of GFAP protein. Fluorescence microscope was applied to observe changes of hippocampal formation in rats as well as the distribution of MSCs in rats' brain. Results According to the test of neurological function, the score of neurological function in the experiment group was reduced, and the score in the control group was improved. The difference was statistically significant (P<0.05). Expression of GFAP in MSCs implantation group was increased with a peak in the 7th day, while no significant changes in the control group (P<0.05). According to the observation of immunofluorescence microscopy, the distribution of MSCs in rats' brain was good in MSCs implantation group, and the hippocampal formation showed clear layers in the experiment group. Hippocampal structures in the control group were chaotic, and synapses and organelles were dissolved and compromised. Conclusion MSCs are able to promote the repair of hippocampal structures after cerebral infarction in rats, strengthen neuroplasticity and promote the recovery of neurological functions.
[Key words] Umbilical blood mesenchymal stem cells (MSCs); Cerebral infarction; Neuroplasticity
臍血間充質干細胞(MSCs)有跨胚層分化潛能,可分化為神經細胞[1,2]。研究發現激活神經干細胞不是腦梗死的直接結果,而是引起了腦內某些因子的變化,進而作用于神經干細胞使其增殖、分化和遷移[3]。本實驗采用線栓法制備大鼠腦梗死模型,通過觀察臍血干細胞移植對大鼠腦損傷后神經膠質酸性蛋白(glial fibrillary acidic protein,GFAP)蛋白表達的影響及移植前后神經功能缺損評分、海馬結構的變化,旨在探討MSCs移植治療腦梗死的可能機制,為臨床治療腦梗死提供理論依據。
1材料與方法
1.1模型制備
將河南省實驗動物中心提供的120只雄性SD大鼠[動物合格證號SCXX(豫)2010-0002]于2013年3月~2014年3月進行實驗,將大鼠隨機分成MSCs移植組和對照組,每組60只,制備腦梗死模型。采用線栓法將大鼠制成大腦中動脈栓塞(middle cerebral artery occlusion,MCAO)模型。激光多普勒血流儀監測大鼠大腦中動脈血流速度,如血流速度較栓塞前降低70%以上及Zealonga評分>1分,提示制模成功。
1.2主要儀器與試劑
免疫熒光顯微鏡,腦立體定位儀(NARISHIGE SN-3 型,日本)。
1.3 MSCs培養
取新鮮的臍血,淋巴細胞分離液提取單個核細胞,分裝到2個50 mL培養瓶中,每瓶中加5 mL培養基,放于培養箱中培養,2~3 d后洗去沒有貼壁的細胞并更換新鮮的培養液,以倒置顯微鏡觀察細胞的生長狀況。貼壁細胞完全融合以后,以2.5 g/L的胰酶消化并傳代,把傳至第2代的細胞接種在第2個6孔板內,每孔細胞濃度為1×105/mL,達到80%共融時再加入誘導劑。
1.4神經功能評分
Berderson評分標準:無神經損傷,0分;大鼠癱瘓側前肢屈曲腹下,1分;除了1分體征外,癱瘓側推大鼠阻力下降,2分;有追尾現象,3分。除上述體征外,大鼠活動量減少,4分。大鼠得分為0~4分。分別于術后6 h、24 h、3 d、7 d、14 d不同時間點對大鼠神經功能評分。2~4分者說明模型復制成功。選取2分以上的模型大鼠用于后續實驗。
1.5免疫組化及免疫熒光
取大鼠腦組織,40 g/L多聚甲醛固定,行常規冰凍切片,對切片進行HE染色及免疫熒光顯微鏡觀察。每張切片隨機選取6個200倍視野,Simple-PCI圖像分析系統,測定陽性細胞數,計算均值。
1.6統計學分析
采用SPSS16.0軟件進行統計學分析,計量資料以(x±s)表示,采用t檢驗或方差分析,P<0.05為差異有統計學意義。
2 結果
MSCs移植組與對照組均于術后2~3 d內活動減少,體重減輕,3 d后體重開始增加,皮毛光澤及亮度均好轉,精神狀態亦明顯改善,自主活動增加。MSCs移植組恢復較對照組快。
術后6 hMSCs移植組和對照組均出現神經功能障礙,到第14天時,對照組大鼠神經評分仍然在2分以上。MSCs移植組在6 h、24 h、3 d、7 d、14 d不同時間點進行比較,差異有統計學意義(P=0.0027<0.01),對照組在6 h、24 h、3 d、7 d、14 d比較差異無統計學意義(P=0.0630>0.05)。由此可見,隨著MSCs的持續治療,MSCs移植組腦出血大鼠神經功能逐步恢復,對照組則無明顯變化。見表1。
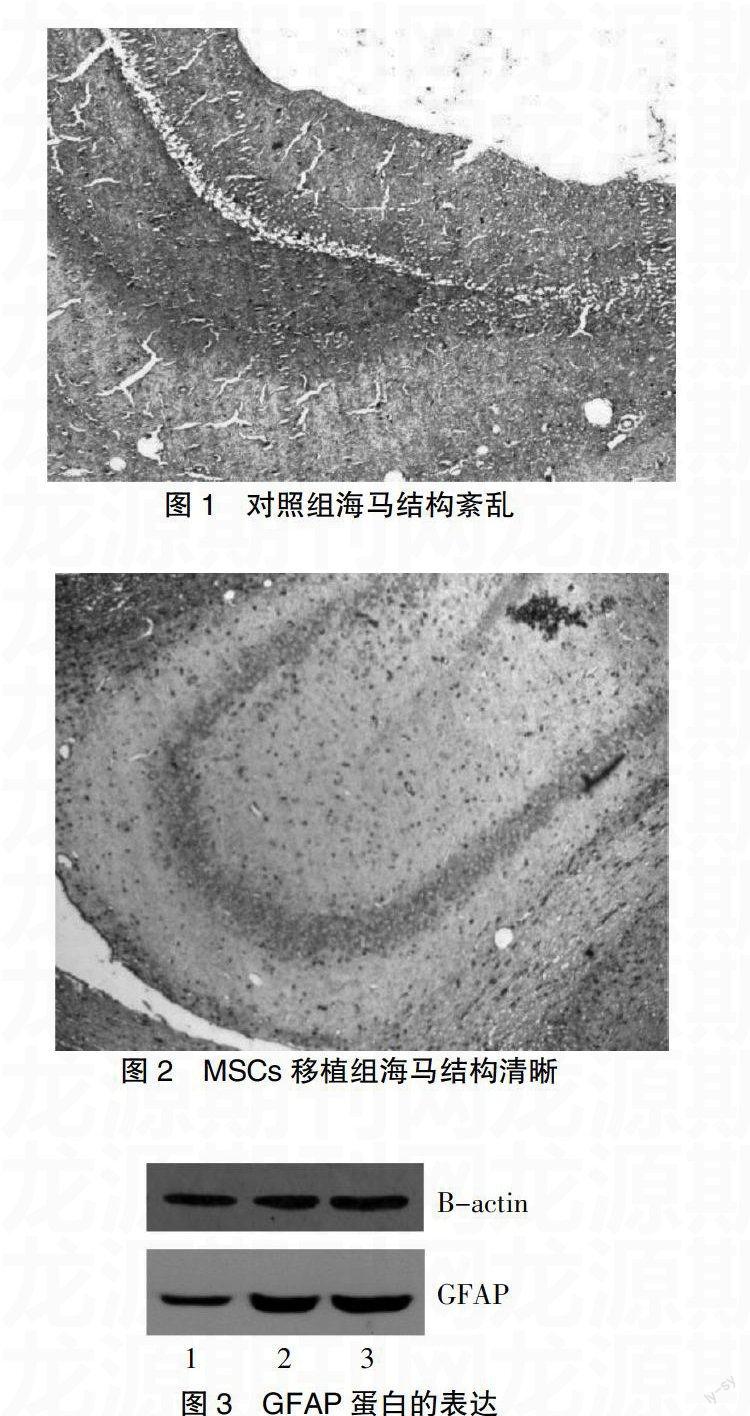
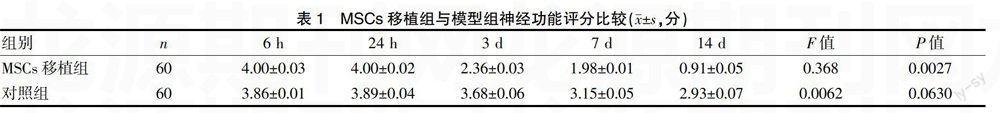
大鼠腦組織病理觀察及免疫組化觀察海馬區域神經生成見圖1、2。Western blot 觀察GFAP蛋白的表達見圖3。
3 討論
腦梗死引起的神經元不可逆死亡,梗死區周邊的成熟神經元不能再生,因此腦梗死預后不佳。MSCs在某些微環境作用下具有類似胚胎干細胞的高度分化潛能,研究發現,MSCs移植于受損動物的腦組織中,可促進動物神經功能的恢復[4]。因而采用MSCs移植治療腦梗死成為研究熱點。
本實驗表明,造模后MSCs移植組和對照組大鼠出現功能及行為異常,病變對側肢體出現不同程度的癱瘓,表現為追尾現象、不能站立等,功能異常程度與病變嚴重程度一致。對照組與MSCs移植組比較,3 d、7 d、14 d后神經功能評分對照組高于MSCs移植組(P<0.05)。說明MSCs可明顯改善腦梗死大鼠的神經功能障礙,其具體機制尚不明確,可能與腦水腫減輕、顱內壓的降低和腦出血灶吸收有關。移植2周后,大鼠腦梗死灶周邊可見綠色熒光細胞,說明MSCs可在大鼠腦組織中存活。研究表明,MSCs移植到大腦不同部位后,能根據大鼠腦內的微環境變化來分化不同腦區的神經細胞[5]。海馬主要與記憶功能相關,是學習的重要結構,尤其是近期的記憶功能,其損傷范圍與障礙程度成正比[6],所以,本實驗選取海馬作為研究部位。免疫組化顯示MSCs移植組大鼠海馬結構層次清晰,而對照組則紊亂,無規則。GFAP是近來廣泛受到重視的腦損傷應檢測的神經特異性標志物,也是神經干細胞(neural stem cell,NSC)分化的標記物[7],檢測GFAP可以早期反映大腦損傷,也可以直接反映移植效果。Western blot顯示,在同一時間點,與對照組比較,MSCs移植組GFAP蛋白表達升高,7 d達到高峰期,隨后開始下降。這說明移植MSCs可能抑制了星形膠質細胞的過度增生,減輕腦梗死后膠質瘢痕的形成,使星形膠質細胞適度活化以發揮其損傷修復作用,因此我們認為MSCs移植后抑制膠質瘢痕的形成是腦梗死大鼠神經功能恢復的機制之一,究其機制可能是MSCs通過釋放細胞因子而調節GFAP的表達,進而影響神經功能的恢復。
MSCs促使腦組織功能恢復的機制尚不清楚,Chen等[8]研究發現MSCs移植治療腦梗死后,腦內僅有1%~2%的MSCs表達神經元標志物,5%表達星形膠質細胞標志物。神經系統功能恢復很難簡單地用這些細胞分化為有功能的神經細胞來解釋,目前認為,MSCs移植修復受損腦組織的機制極其復雜,即有MSCs分泌細胞因子及神經因子的調節作用,又有分化為神經樣細胞產生的替代作用,同時還有因新生血管改善供氧條件等影響[9]。本研究根據MSCs移植后海馬結構的變化及GFAP表達量,初步探討了MSCs向神經樣細胞分化、代替壞死神經細胞、進而促進神經功能恢復的作用,而這些神經樣細胞能否真正代替壞死神經細胞,機體又如何發揮調控作用,什么時間移植效果最好,尚需進一步探討。
[參考文獻]
[1] Heo JS,Choi SM,Kim HO,et al. Neural transdifferentiation of human bone marrow mesenchymal stem cells on hydrophobic polymer-modified surface and therapeutic effects in an animal model of ischemic stroke[J]. Neuro-science,2013,238(6):305-318.
[2] Manley NC,Steinberg GK.Tracking stem cells for cellular therapy in stoke[J]. Curre Pharm Des,2012,18(25):3685-3693.
[3] Zhu W,Zhou LF,Wang Y,et al. Transplantation of gene-transfected neural stem cells for transient cerebral ischemia in rats[J]. Natl Med J China,2004,84(12):12-17.
[4] Pereanu W,Younossi Hartenstein A,Lovick J,et al. Lineage-based analysis of the development of the central complex of the Drosophila brain[J]. The Journal of Comparative Neurology,2011,519(4):661-689.
[5] 董富興,胡瑩瑩,劉亞萍,等. 新生大鼠海馬神經干細胞的離體培養及細胞連接的超微結構觀察[J]. 重慶醫學,2013,42(11):1201-1203.
[6] 胡晶瓊,歐陽為相,李慧玉,等. 間充質干細胞治療脊髓小腦性共濟失調[J]. 中國組織工程研究,2013,27(5):5019-5025.
[7] Zechariah A,Elali A,Doeppner TR,et al. Vascular endothelial growth factor promotes pericyte coverage of brain capillaries,improves cerebral blood flow during subsequent focal cerebral ischemia and preserves the metabolic penumbra[J]. Stroke,2013,30(4):224-229.
[8] Chen J,LI Y,Wang L,et al. Therapeutic benefit of intracerebral transplantation of bone marrow stromal cells after cerebral ischemia in rats[J]. Neurol Sci,2001,189(7):49-57.
[9] Bae KS,Park JB,Kim HS,et al. Neuron-like differentiation of bone marrow-derived mesenchymal stem cells[J]. Yonsei Med J,2011,52(3):401-412.
(收稿日期:2014-11-28)

