百可利對6-羥多巴胺不同注射位點(diǎn)帕金森病模型大鼠的治療作用
何國榮,穆 鑫,李曉秀,王月華,方蓮花,孫 嵐,呂 揚(yáng),杜冠華,3
(中國醫(yī)學(xué)科學(xué)院北京協(xié)和醫(yī)學(xué)院藥物研究所1.“藥物靶點(diǎn)研究與新藥篩選”北京市重點(diǎn)實(shí)驗(yàn)室、2.“晶型藥物研究”北京市重點(diǎn)實(shí)驗(yàn)室、3.“天然藥物活性物質(zhì)與功能”國家重點(diǎn)實(shí)驗(yàn)室,北京 100050)
◇論 著◇
百可利對6-羥多巴胺不同注射位點(diǎn)帕金森病模型大鼠的治療作用
何國榮1,穆 鑫1,李曉秀1,王月華1,方蓮花1,孫 嵐1,呂 揚(yáng)2,3,杜冠華1,3
(中國醫(yī)學(xué)科學(xué)院北京協(xié)和醫(yī)學(xué)院藥物研究所1.“藥物靶點(diǎn)研究與新藥篩選”北京市重點(diǎn)實(shí)驗(yàn)室、2.“晶型藥物研究”北京市重點(diǎn)實(shí)驗(yàn)室、3.“天然藥物活性物質(zhì)與功能”國家重點(diǎn)實(shí)驗(yàn)室,北京 100050)
目的 觀察百可利對6-羥多巴胺(6-OHDA)內(nèi)側(cè)前腦束(MFB)和紋狀體尾殼核(CPu)兩個不同注射位點(diǎn)帕金森病(PD)模型大鼠的治療作用,兩個注射位點(diǎn)模型分別記為:MFB-M,CPu-M。方法 運(yùn)用6-OHDA兩點(diǎn)注射法,損毀大鼠左側(cè)中腦多巴胺能神經(jīng)元,制備PD模型。記錄大鼠后肢肌電(EMG)信號頻率觀察肌肉震顫;測定大鼠自主活動;電化學(xué)法檢測紋狀體內(nèi)多巴胺(DA)及其代謝產(chǎn)物含量;免疫組化法檢測大鼠腦內(nèi)酪氨酸羥化酶(TH)、OX-42表達(dá);觀察神經(jīng)元超微結(jié)構(gòu)變化。結(jié)果 給藥3周后,兩個注射位點(diǎn)的模型組行為改變趨勢一致,百可利在兩個注射位點(diǎn)的模型動物上藥效表現(xiàn)不同,在CPu-M組可明顯提高PD大鼠自主活動數(shù)(P<0.05)。EMG信號分析顯示,在MFB-M組,給予百可利,肌電頻率降低55%;在CPu-M組,給予百可利,肌電頻率降低60%。EMG時(shí)效研究表明,在CPu-M組,百可利藥效持續(xù)420 min以上。紋狀體遞質(zhì)水平顯示,兩個注射位點(diǎn)的模型組DA遞質(zhì)水平差異很大,在CPu-M組,百可利能夠明顯升高DA水平(P<0.05)。兩個注射位點(diǎn)的模型組免疫組織化學(xué)結(jié)果趨勢一致,在CPu-M組,百可利有更明顯神經(jīng)元保護(hù)作用(P<0.05),在MFB-M組,百可利抑制小膠質(zhì)細(xì)胞過度激活作用更強(qiáng)(P<0.01)。結(jié)論 不同注射位點(diǎn)制備的PD模型能夠反映不同時(shí)期PD的病理變化,百可利可通過抑制炎性介質(zhì)生成和釋放、保護(hù)殘存神經(jīng)元、恢復(fù)神經(jīng)元功能等機(jī)制改善PD不同發(fā)病時(shí)期模型動物的行為學(xué)癥狀。
百可利;帕金森病;6-羥多巴胺;黑質(zhì)紋狀體通路;內(nèi)側(cè)前腦束;紋狀體尾殼核;神經(jīng)保護(hù)
帕金森病(Parkinson’s disease, PD)是嚴(yán)重危害中老年人健康的神經(jīng)退行性疾病,目前現(xiàn)有的治療藥物有很大的局限性和副作用,因此建立能夠反映PD臨床病因、病理過程的動物模型,尋找新的有效防治PD的藥物具有重要意義。6-羥基多巴胺(6-hydroxydopamine, 6-OHDA)是制備PD 大鼠模型的常用神經(jīng)毒性化合物,動物腦內(nèi)注射該化合物后可以誘導(dǎo)PD動物模型,具有明顯的PD 臨床特征。實(shí)驗(yàn)證明,制備PD 模型的注射位點(diǎn)為黑質(zhì)紋狀體通路,但不同注射位點(diǎn)對動物模型的病理特征影響很大。
黑質(zhì)紋狀體通路的多巴胺(dopamine, DA)能神經(jīng)元位于黑質(zhì)致密部(pars compacta of substantia nigra, SNc),其軸突通過內(nèi)側(cè)前腦束(medial forebrain bundle, MFB),終止于紋狀體尾殼核(caudate putamen, CPu),由于這些部位的DA 能神經(jīng)元丟失,導(dǎo)致紋狀體DA 含量下降,最終導(dǎo)致運(yùn)動功能受損,出現(xiàn)PD 的典型癥狀[1-2]。在黑質(zhì)紋狀體通路的3個位點(diǎn)中,SNc 結(jié)構(gòu)微小,精確注射6-OHDA 到這個位點(diǎn)非常困難,而且該部位主要是神經(jīng)元胞體,對6-OHDA 毒性作用不敏感,以SNc 作為注射位點(diǎn)制備PD 模型成功率較低。通常制備PD 模型選用的注射位點(diǎn)為MFB 與CPu。單側(cè)損毀MFB 與單側(cè)損毀CPu 的病理表現(xiàn)有所不同,前者會造成大多數(shù)神經(jīng)元壞死,研究重癥PD 具有較高價(jià)值,而后者神經(jīng)元退化速率緩慢,與自發(fā)性PD 較為相似,在研究輕癥PD 時(shí)價(jià)值較高。本研究分別采用在黑質(zhì)紋狀體通路MFB 和CPu 兩個位點(diǎn)注射6-OHDA 誘發(fā)PD 大鼠模型的方法,觀察了百可利在這兩種損傷模型中的作用特點(diǎn)。
百可利(baicalein)是從唇形科植物黃芩(ScutellariabaicalensisGeorgi)干燥根中分離得到的黃酮類化合物,化學(xué)名稱為5,6,7-三羥基黃酮,別名:黃芩素、黃芩苷元,國家藥典委員會將其正式命名為百可利。文獻(xiàn)報(bào)道,百可利具有抗炎、抗菌、抗過敏、抗氧化等廣泛的藥理活性[3]。本實(shí)驗(yàn)室前期圍繞PD的發(fā)病機(jī)制和治療靶點(diǎn),建立了6-OHDA 損傷SH-SY5Y細(xì)胞模型和PC12細(xì)胞模型,采用高通量藥物篩選技術(shù),發(fā)現(xiàn)百可利有效地減輕6-OHDA致SH-SY5Y細(xì)胞和PC12細(xì)胞活力的下降、減輕6-OHDA致SH-SY5Y細(xì)胞凋亡、促進(jìn)正常和6-OHDA損傷情況下的PC12細(xì)胞分化和軸突生長。進(jìn)一步實(shí)驗(yàn)表明,百可利在不同的PD動物模型均具有抗PD 相關(guān)的藥理作用[4-7]。本文采用大腦不同部位注射 6-OHDA 誘導(dǎo)大鼠PD 模型,觀察了百可利的治療作用及作用機(jī)制。
1 材料與方法
1.1 材料
1.1.1 動物 Sprague Dawley (SD)大鼠,♂,2~3月齡,體質(zhì)量180~200 g,購自北京維通利華實(shí)驗(yàn)動物技術(shù)有限公司,合格證號:SCXK(京)2007-0001。動物飼養(yǎng)在溫度(22±1)℃,相對濕度55%~65%,12 h光照周期的環(huán)境中。
1.1.2 儀器 腦立體定位儀(MP8001, 深圳瑞沃德生命科技有限公司),大鼠自主活動程序自動控制儀(DZIL-2, 中國醫(yī)學(xué)科學(xué)院藥物研究所),生物機(jī)能實(shí)驗(yàn)系統(tǒng)(BL-420E+, 成都泰盟科技有限公司),STRONG牙鉆(型號: 202N-110LN), 高速低溫離心機(jī)(5810R, 美國Eppendorf公司),高效液相色譜庫侖電化學(xué)分析系統(tǒng)(HPLC-ECD Coulchem Ⅲ, ESA, 美國),冰凍切片機(jī)(SM900, 美國Leica公司),透射電子顯微鏡(H-7650, Hitachi 公司, 日本)。
1.1.3 試劑與藥品 百可利由中國醫(yī)學(xué)科學(xué)院藥物研究所“晶型藥物研究”北京市重點(diǎn)實(shí)驗(yàn)室提供。美多芭片(上海羅氏制藥有限公司生產(chǎn), 批號: SH 0502)。6-OHDA、DA、二羥基苯乙酸(dihydroxyphenylacetic acid, DOPAC)、高香草酸(homovanilic acid, HVA)、阿樸嗎啡(apomorphine, APO)購自Sigma-Aldrich公司;酪氨酸羥化酶(trysine hydroxylase, TH)抗體購自Chemicon公司;OX-42抗體購自Santa Cruz公司;卵白素-生物素過氧化物酶復(fù)合物(avidin biotin-peroxidase complex, ABC)試劑盒、3,3′-二氨基聯(lián)苯胺(3,3′-diaminobenzidine, DAB)顯色劑,購自北京中杉金橋生物技術(shù)有限公司。
1.2 方法
1.2.1 模型建立 大鼠以3% 戊巴比妥鈉(50 mg·kg-1, ip)麻醉,常規(guī)皮膚消毒后,將大鼠頭部固定在立體定位儀上,沿正中線切開大鼠顱頂皮膚,剝離骨膜,暴露前囟,以前囟為準(zhǔn),分別確定左側(cè)MFB和CPu位點(diǎn)。MFB損傷位點(diǎn)坐標(biāo)為:(1)TB:-2.3 mm, AP:-4.4 mm, ML:1.2 mm, V:-7.8 mm;(2)TB:+3.4 mm, AP:-4.0 mm, ML:0.8 mm, V:-8.0 mm。該組標(biāo)記為MFB-M。CPu損傷位點(diǎn)坐標(biāo)為:(1)TB:-3.3 mm, AP:-0.7 mm, ML:2.5 mm, V:-5.5 mm;(2)TB:-3.3 mm, AP:-0.3 mm, ML:3.5 mm, V:-5.5 mm。該組標(biāo)記為CPu-M。用牙科鉆在上述手術(shù)位點(diǎn)鉆直徑約2.5 mm的孔,用微量進(jìn)樣器將6-OHDA(2 g·L-1)溶液5 μL緩慢注入(1 μL·min-1),注射后留針10 min緩慢出針。假手術(shù)組大鼠注射等量的生理鹽水。
1.2.2 模型評價(jià) 于術(shù)后d 14、d 21分別注射APO(0.5 mg·kg-1, sc)誘導(dǎo)大鼠旋轉(zhuǎn)。取30 min內(nèi)轉(zhuǎn)速≥210 r的大鼠作為成功PD模型大鼠。
1.2.3 分組與給藥 將造模成功的大鼠,隨機(jī)分為模型組、美多芭組(madopar, 50 mg·kg-1, ig)、百可利(200 mg·kg-1, ig)組,每組12只;另取相應(yīng)注射生理鹽水經(jīng)檢測無旋轉(zhuǎn)運(yùn)動的大鼠各12只為假手術(shù)組。分組后灌胃給予美多芭和百可利,假手術(shù)組與模型組大鼠灌胃給予蒸餾水2 mL,每日1次,連續(xù)3周。
1.2.4 旋轉(zhuǎn)行為學(xué)檢測 模型動物分組后每隔7天于給藥后30 min進(jìn)行旋轉(zhuǎn)行為檢測。(方法同“1.2.2”)
1.2.5 自主活動檢測 給藥后30 min 將大鼠放入自主活動箱中,自動記錄儀記錄10 min 內(nèi)大鼠自主活動次數(shù)。
1.2.6 大鼠肌電測定 將電極固定于大鼠后肢肌肉,使用 BL-420E+ 生物信號采集器對清醒大鼠后肢進(jìn)行肌電(electromyography, EMG)測定,評價(jià)其震顫頻率。檢測條件為:0.015 毫秒(ms),掃描速度為0.01 秒(s),10 kHz 濾波。分別測定各組大鼠在給藥后0、10、30、60、90、120、180、240、300、420 min 時(shí)的震顫頻率。每個時(shí)間點(diǎn)記錄1 min,統(tǒng)計(jì)每時(shí)間點(diǎn)5 s 的震顫頻率。
1.2.7 神經(jīng)遞質(zhì)檢測 末次行為學(xué)實(shí)驗(yàn)結(jié)束后,每組取6 只大鼠斷頭取腦,冰上迅速分離出損傷側(cè)紋狀體,放入液氮中。紋狀體稱重后加入200 μL勻漿液,經(jīng)超聲破碎(200 W,50 s),離心(12 000 r·min-1,4 ℃,30 min),上清液用0.22 μm 濾膜過濾,取50 μL 用于測定。
色譜條件為:色譜柱:CAPCELL PAK C18 MG (3 μm,3 mm I.D.×75 mm),檢測柱溫35 ℃,流速1.0 mL·min-1;流動相:0.1 mol·L-1磷酸二氫鈉(NaH2PO4) 水溶液含0.85 mmol·L-1辛基硫酸鈉(octyl sulfate sodium salt,OSA)、0.5 mmol·L-1乙二胺四乙酸二鈉(EDTA·Na2)和11%甲醇,用濃磷酸調(diào)pH 至3.25。
1.2.8 免疫組織化學(xué)檢測 每組取4 只大鼠,麻醉、灌流固定后,斷頭取腦,置固定液中固定4 h,以含30% 蔗糖的多聚甲醛固定液內(nèi)脫水。作連續(xù)冰凍冠狀切片,片厚為20 μm。切片與一抗稀釋液(TH 1 ∶500; OX-42 1 ∶100)4 ℃ 孵育過夜;然后分別與生物素標(biāo)記的二抗(1 ∶300)反應(yīng)1 h以及卵白素-生物素復(fù)合物反應(yīng)2 h,最后用含有DAB 的緩沖液呈色。計(jì)數(shù)方法:隨機(jī)選取每只大鼠腦切片5張,分別在黑質(zhì)和紋狀體陽性細(xì)胞密集區(qū)中央部分取4個互不重疊的高倍視野,計(jì)數(shù)視野內(nèi)TH、OX-42免疫反應(yīng)陽性細(xì)胞數(shù)目。
1.2.9 電鏡樣品制備及觀察 假手術(shù)組、模型組和百可利組各取2只大鼠(腦組織前固定方法同“1.2.8”)。分離黑質(zhì)與紋狀體,用鋒利刀片將組織修成約1 mm3的小塊,并置于4℃ 預(yù)冷的5% 戊二醛中固定2 h。4℃ 的PBS緩沖液沖洗,4℃ 1% 鋨酸后固定約1 h,4℃ 條件下乙醇梯度常規(guī)脫水,Epon812包埋,切片染色后,H-7650型透射電鏡觀察并拍片。
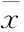
2 結(jié)果
2.1 百可利對大鼠旋轉(zhuǎn)行為學(xué)的影響動物注射APO 后,假手術(shù)組大鼠均無異常表現(xiàn)。MFB-M與CPu-M模型組大鼠給予APO 后,大鼠旋轉(zhuǎn)圈數(shù)均在270 r·(30 min)-1左右,給予百可利治療后大鼠旋轉(zhuǎn)次數(shù)無明顯差異(Fig 1)。
2.2 百可利對大鼠自主活動的影響兩個注射位點(diǎn)模型組大鼠均出現(xiàn)活動明顯減少、反應(yīng)遲鈍、肢體震顫、嗅探、偏斜、弓背、尾僵直、豎毛、后肢搔撓、撕咬尾部、躁動不安及激惹等異常行為。與假手術(shù)組相比,MFB-M與CPu-M模型組的自主活動次數(shù)明顯下降(P<0.05);給予百可利治療后,MFB-M組大鼠自主活動無明顯變化,CPu-M組大鼠自主活動數(shù)明顯增加(P<0.05)(Fig 2)。
2.3 大鼠震顫頻率的表現(xiàn)假手術(shù)組大鼠靜息狀態(tài)EMG 無明顯可檢測信號,模型組大鼠后肢肌電可見連續(xù)的陣發(fā)性簇狀電信號出現(xiàn)(P<0.01),表現(xiàn)出模型大鼠的特殊癥狀特征。MFB-M 組動物在給予美多芭和百可利后,肌電頻率分別比模型組降低37% 和55%,CPu-M 組動物給予美多芭和百可利后肌電頻率分別比模型組降低31% 和60%(Fig 3)。

Fig 1 Effect of baicalein on rotational behavior in 6-OHDA unilaterally lesioned rats ±s, n=12)
A: 6-OHDA-MFB lesioned rats; B: 6-OHDA-CPu lesioned rats.**P<0.01vssham group

Fig 2 Effect of baicalein on spontaneous activity in 6-OHDA unilaterally lesioned rats ±s, n=12)
#P<0.05vs6-OHDA group;*P<0.05vssham group
MFB-M組與CPu-M組大鼠給予百可利治療后,藥物降低大鼠震顫頻率的最大作用出現(xiàn)在約90 min,隨后藥物作用逐漸減弱。MFB-M 組,大鼠在給藥后300 min 基本恢復(fù)給藥前水平,而CPu-M組,大鼠給藥后約在420 min 作用消失(Fig 4)。

Fig 3 Effect of baicalein on tremor in 6-OHDA unilaterally lesioned rats ±s, n=12)
A: Segments of tremor monitor activity profiles; B: Tremor frequency.#P<0.05vs6-OHDA group
2.4 百可利對大鼠紋狀體神經(jīng)遞質(zhì)水平的影響MFB-M組,模型組紋狀體中的DA、DOPAC和HVA的含量明顯降低,分別為假手術(shù)組2%、4% 和48% (P<0.01),各給藥組對這種損傷的改善不明顯;CPu-M組,模型組紋狀體中的DA、DOPAC和HVA的含量降低程度略輕,分別為假手術(shù)組33%、47%、53%(P<0.05),各給藥組對DA含量有明顯的升高作用(P<0.05),但對其代謝產(chǎn)物無明顯作用。美多芭組僅對DA代謝產(chǎn)物HVA有升高作用(Fig 5)。

Fig 4 Time-response of baicalein on tremor in 6-OHDA unilaterally lesioned rats ±s, n=8)
A: MFB model; B: MFB madopar (50 mg·kg-1); C: MFB baicalein (200 mg·kg-1); D: CPu model; E: CPu madopar (50 mg·kg-1); F: CPu baicalein (200 mg·kg-1)
2.5 免疫組織化學(xué)分析
2.5.1 大鼠損毀側(cè)黑質(zhì)TH 表達(dá) 假手術(shù)組大鼠黑質(zhì)TH 免疫陽性神經(jīng)元形態(tài)清晰,細(xì)胞胞體和纖維染色較深,有明顯可見的免疫陽性突起。模型大鼠毀損側(cè)黑質(zhì)TH 免疫陽性神經(jīng)元變性、壞死,胞質(zhì)著色淡,細(xì)胞輪廓顯示不清晰。
MFB-M組,模型組神經(jīng)元數(shù)量為假手術(shù)組8%(P<0.01),給予美多芭和百可利治療后,對TH 神經(jīng)元數(shù)目的嚴(yán)重下降均有一定的改善趨勢,分別為假手術(shù)組的16%和18%,但差異均無顯著性。CPu-M組,模型組神經(jīng)元數(shù)量為假手術(shù)組26%(P<0.05),給予美多芭和百可利治療后,可明顯提高TH 神經(jīng)元數(shù)目,分別為假手術(shù)組的50%和57%(P<0.05)(Fig 6A、6B)。
2.5.2 大鼠損毀側(cè)紋狀體OX-42 表達(dá) 在假手術(shù)組大鼠紋狀體中,OX-42 免疫陽性小膠質(zhì)細(xì)胞少見。MFB-M組,損毀側(cè)紋狀體OX-42 免疫陽性小膠質(zhì)細(xì)


#P<0.05vs6-OHDA group;*P<0.05,**P<0.01vssham group

Fig 6 Effect of baicalein on TH and OX-42 immunostaining in substantia nigra and striatum of rat brain

胞數(shù)量明顯增加,為假手術(shù)組的3.84倍(P<0.01),用美多芭和百可利治療均可明顯降低OX-42 免疫陽性小膠質(zhì)細(xì)胞數(shù)量,分別下降到模型組49%、38% (P<0.01)。CPu-M組,損毀側(cè)紋狀體OX-42 免疫陽性小膠質(zhì)細(xì)胞數(shù)量明顯增加,為假手術(shù)組的3.69倍 (P<0.05),用美多芭和百可利治療均可明顯降低OX-42 免疫陽性小膠質(zhì)細(xì)胞的數(shù)量,分別下降到模型組41%、56%(P<0.05)(Fig 6A、6C)。
2.6 神經(jīng)元超微結(jié)構(gòu)分析未注射6-OHDA 的大鼠神經(jīng)元結(jié)構(gòu)正常,核染色質(zhì)均勻,無固縮,胞膜完整;細(xì)胞器,如:粗面內(nèi)質(zhì)網(wǎng)、核糖體、線粒體的超微結(jié)構(gòu)均正常(Fig 7A、D)。MFB-M組中,可見明顯固縮的神經(jīng)元,核染色質(zhì)成簇,細(xì)胞胞質(zhì)電子密度增高,粗面內(nèi)質(zhì)網(wǎng)擴(kuò)張呈空泡狀,核糖體解聚,線粒體腫脹,嵴斷裂,CPu-M 組黑質(zhì)紋狀體通路的損傷程度較MFB-M組略輕(Fig 7B、E)。給予百可利進(jìn)行治療后,神經(jīng)元超微結(jié)構(gòu)損傷情況均有不同程度的改善,表現(xiàn)為固縮神經(jīng)元的數(shù)目減少,核與胞質(zhì)電子密度降低,細(xì)胞器情況明顯改善,空泡減少(Fig 7C、F)。

Fig 7 Effect of baicalein on changes of neurons
A~C: 6-OHDA-MFB lesioned rats. D~F: 6-OHDA-CPu lesioned rats. A, D: Sham. B, E: 6-OHDA. C, F: 6-OHDA + baicalein (200 mg·kg-1). Scale bars: 0.5μm
3 討論
黑質(zhì)紋狀體通路注射6-OHDA 制備的PD 大鼠模型,均可出現(xiàn)肌電的震顫性信號,是PD的特異性行為學(xué)表現(xiàn)。本研究發(fā)現(xiàn),黑質(zhì)紋狀體通路不同位點(diǎn)注射6-OHDA 后,其行為學(xué)表現(xiàn)和病理檢查結(jié)果有一定的差異,動物自主活性狀態(tài)、腦內(nèi)DA 遞質(zhì)水平、殘存神經(jīng)元數(shù)量和神經(jīng)元超微結(jié)構(gòu)損傷程度均不同,說明不同注射位點(diǎn)制備的PD 模型能夠反映PD 不同時(shí)期的病理變化,對于觀察藥物作用具有重要意義。皮下注射APO 誘導(dǎo)大鼠旋轉(zhuǎn)是評價(jià)6-OHDA 損傷程度和模型是否成功的標(biāo)準(zhǔn),但在考察藥物的作用時(shí)不能僅僅參考這一個標(biāo)準(zhǔn),還應(yīng)結(jié)合更多與臨床癥狀接近的指標(biāo)進(jìn)行全面評價(jià)。
百可利是本實(shí)驗(yàn)室采用高通量藥物篩選技術(shù),圍繞PD 的發(fā)病機(jī)制和治療藥物靶點(diǎn),經(jīng)過系統(tǒng)篩選發(fā)現(xiàn)的對PD 具有治療作用的化合物,經(jīng)動物模型研究和綜合評價(jià),證明了百可利對PD 癥狀,尤其是對PD 引起的震顫有明顯的改善[8-9]。本研究結(jié)果表明,百可利對單側(cè) MFB 位點(diǎn)與CPu 位點(diǎn)注射6-OHDA 后致PD 大鼠模型的震顫活動有明顯抑制作用,但是在CPu-M組,百可利抑制震顫頻率的效果更好,藥效持續(xù)時(shí)間更長。
自主活動反映了動物的運(yùn)動能力和中樞神經(jīng)系統(tǒng)的興奮程度,本實(shí)驗(yàn)結(jié)果顯示,百可利對CPu位點(diǎn)注射6-OHDA 所致自主活動次數(shù)下降具有明顯提高作用,這可能與百可利增加腦內(nèi)DA水平有關(guān)。另外,給予百可利治療后,在DA水平明顯提高的情況下,其代謝產(chǎn)物DOPAC 和HVA 水平?jīng)]有明顯變化,說明百可利可能通過抑制單胺氧化酶B活性,影響DA 降解代謝過程,從而改善DA 失衡造成的PD 模型動物運(yùn)動障礙和靜止性震顫。而百可利對MFB 位點(diǎn)注射6-OHDA 所致自主活動降低僅有升高的趨勢,與此相對應(yīng)的是百可利對腦內(nèi)DA水平表現(xiàn)出一定的升高作用,但差異無統(tǒng)計(jì)學(xué)意義。
McGeer等[10]于1988年在PD 患者的中腦黑質(zhì)中發(fā)現(xiàn)了激活的小膠質(zhì)細(xì)胞,激活的小膠質(zhì)細(xì)胞產(chǎn)生超氧化物和免疫炎性因子損傷DA 能神經(jīng)元,抑制小膠質(zhì)細(xì)胞過度激活成為治療PD 的手段之一[11-13]。本研究的結(jié)果顯示,百可利在MFB-M組 和CPu-M 組中均顯示出較強(qiáng)的抑制小膠質(zhì)細(xì)胞過度激活的作用,這與早期文獻(xiàn)報(bào)道的研究結(jié)果一致[14-15],提示百可利可通過抑制炎性介質(zhì)的生成和釋放,發(fā)揮其對DA 能神經(jīng)元的保護(hù)作用。另外,由于MFB-M 組對DA能神經(jīng)元損傷更嚴(yán)重,因此百可利在此模型中并未顯示出明顯增加DA能陽性神經(jīng)元的作用。而在損傷較輕的CPu-M組,百可利則表現(xiàn)出明顯的保護(hù)神經(jīng)元的作用,并與遞質(zhì)檢測和超微結(jié)構(gòu)分析結(jié)果一致。
綜上所述,黑質(zhì)紋狀體通路是PD 患者重要的生化和病理改變部位,不同位點(diǎn)的損傷可模擬PD發(fā)展的不同階段,并在病理程度方面存在一定差異,表現(xiàn)為神經(jīng)元丟失和殘存神經(jīng)元功能減退程度不同。本研究表明,連續(xù)給藥3 周,百可利能夠改善PD 不同發(fā)病時(shí)期模型動物的行為學(xué)癥狀,并通過抑制炎性介質(zhì)生成和釋放、保護(hù)殘存神經(jīng)元、恢復(fù)神經(jīng)元功能而發(fā)揮對PD 的治療作用。此外,由于百可利在模擬PD 早期損傷的模型中的療效更突出,提示臨床上對PD 的治療應(yīng)盡早用藥,延緩疾病的進(jìn)展。
[1] Deumens R, Blokland A, Prickaerts J. Modeling Parkinson′s disease in rats: an evaluation of 6-OHDA lesions of the nigrostriatal pathway[J].ExpNeurol, 2002, 175 (2): 303-17.
[2] Gaillard A, Decressac M, Frappé I, et al. Anatomical and functional reconstruction of the nigrostriatal pathway by intranigral transplants[J].NeurobiolDis, 2009, 35 (3): 477-88.
[3] 辛文妤, 宋俊科, 何國榮, 杜冠華. 黃芩素和黃芩苷的藥理作用及機(jī)制研究進(jìn)展[J]. 中國新藥雜志, 2013, 22 (6): 647-53, 59.
[3] Xin W Y,Song J K,He G R,Du G H. Progress in pharmacological study and the underlying mechanism of baicalein and baicalin[J].ChinNewDrugJ, 2013, 22 (6): 647-53, 59.
[4] Gao L, Fang J S, Bai X Y, et al. In silico target fishing for the potential targets and molecular mechanisms of baicalein as an antiparkinsonian agent discovery of the protective effects on NMDA receptor-mediated neurotoxicity[J].ChemBiolDrugDes, 2013, 81 (6): 675-87.
[5] Li X X, He G R, Mu X, et al. Protective effects of baicalein against rotenone-induced neurotoxicity in PC12 cells and isolated rat brain mitochondria[J].EurJPharmacol, 2012, 674 (2-3): 227-33.
[6] Wang Y H, Yu H T, Pu X P, Du G H. Baicalein prevents 6-hydroxydopamine-induced mitochondrial dysfunction in SH-SY5Y cells via inhibition of mitochondrial oxidation and up-regulation of DJ-1 protein expression[J].Molecules, 2013, 18 (12): 14726-38.
[7] Mu X, He G R, Yuan X, et al. Baicalein protects the brain against neuron impairments induced by MPTP in C57BL/6 mice[J].PharmacolBiochemBehav, 2011, 98 (2): 486-91.
[8] Mu X, He G R, Cheng Y X, et al. Baicalein exerts neuroprotective effects in 6-hydroxydopamine-induced experimental parkinsonisminvivoandinvitro[J].PharmacolBiochemBehav, 2009, 92(4): 642-8.
[9] Yu X, He G R, Sun L, et al. Assessment of the treatment effects of baicalein on the parkinsonian tremor in rats[J].LifeSci, 2012, 91 (1-2): 5-13.
[10] McGeer P L, Itagaki S, Boyes B E, et al. Reactive microglia are positive for HLA-DR in the substantia nigra of Parkinson′s and Alzheimer′s disease brains[J].SeecommentinPubMedCommonsbelowNeurol, 1988, 38 (8):1285-91.
[11] 孫 斌, 羅 毅. 帕金森病的現(xiàn)代藥物治療[J]. 醫(yī)藥導(dǎo)報(bào), 2005, 24 (2): 85-90.
[11] Sun B, Luo Y.Advance in medicine treatment for Parkinson′s disease[J].HerMed, 2005, 24 (2): 85-90.
[12] Luo X G, Chen S D. The changing phenotype of microglia from homeostasis to disease[J].TranslNeurodegener, 2012, 1 (1): 9.
[13] Vivekanantham S, Shah S, Dewji R, et al. Neuroinflammation in Parkinson′s disease: role in neurodegeneration and tissue repair[J].IntJNeurosci, 2014, 124 (11): 1-17
[14] 沈 琮, 張 蘭, 李 林. 以α-synuclein為靶點(diǎn)的抗帕金森病藥物研究進(jìn)展[J]. 中國藥理學(xué)通報(bào), 2014, 30 (2): 149-53.
[14] Shen C, Zhang L, Li L. Advance in research on anti-Parkinson′s disease drugs targeting α-synuclein[J].ChinPharmacolBull, 2014, 30 (2): 149-53.
[15] Li F Q, Wang T, Pei Z, et al. Inhibition of microglial activation by the herbal flavonoid baicalein attenuates inflammation-mediated degeneration of dopam inergic neurons[J].JNeuralTransm, 2005, 112 (3): 331-47.
Effect of baicalein on brain injury induced by 6-hydroxydopamine at different sites in rats
HE Guo-rong1, MU Xin1, LI Xiao-xiu1, WANG Yue-hua1, FANG Lian-hua1,SUN Lan1, LYU Yang2,3, DU Guan-hua1,3
(1.BeijingKeyLaboratoryofDrugTargetsIdentificationandDrugScreening, 2.BeijingKeyLaboratoryofPolymorphicDrug,3.StateKeyLaboratoryofBioactiveSubstanceandFunctionofNaturalMedicines,InstituteofMateriaMedica,ChineseAcademyofMedicalSciences&PekingUnionMedicalCollege,Beijing100050,China)
Aim To explore the therapeutical effect and mechanism of baicalein on two 6-hydroxydopamine (6-OHDA) induced Parkinson′s disease (PD) rat models, which
unilateral lesions of the left medial forebrain bundle (MFB) or caudate putamen (CPu) made by stereotaxic injection of 6-OHDA (MFB-M, CPu-M). Methods PD rat models were established by microinjection of 6-OHDA into MFB or CPu. The anti-tremor effect of baicalein on PD rat models was examined. Spontaneous activity was recorded. Dopamine (DA), dihydroxyphenylacetic acid (DOPAC) and homovanilic acid (HVA) in striatum were quantified by HPLC-ECD. The tyrosine hydroxy-lase (TH) and OX-42 positive cells were detected by immunohistochemical method. The morphological variation of the neurons was confirmed by analysis at an ultrastructural level. Results Baicalein significantly increased the spontaneous activity in CPu-M. The electromyography (EMG) recordings revealed that compared with 6-OHDA group, the tremor frequency in baicalein group was decreased by 55% in MFB-M, and by 60% in CPu-M. 6-OHDA treatment decreased DA levels in the striatum, while treatment with baicalein attenuated the DA decreases in CPu-M. Moreover, baicalein treatment could increase TH-positive neurons and decrease OX-42-postive microglia compared with 6-OHDA group in both MFB-M and CPu-M. Conclusions In the present study, it is illustrated that ① microinjection of 6-OHDA into the MFB and the CPu could cause different pathological changes of PD, which is important for efficacy evaluation; ② baicalein showed the ability to alleviate the behavior symptoms in PD-rats at different stages by improving motor function and attenuating muscle tremor; ③ therapeutic effect of baicalein was produced by inhibiting the inflammatory medium production and release, anti-apoptosis, changing dopamine catabolism, and inhibiting dopamine turnover.
baicalein; Parkinson′s disease; 6-hydroxydopamine; nigrostriatal pathway; medial forebrain bundle; caudate putamen; neuroprotective
時(shí)間:2015-4-15 15:44 網(wǎng)絡(luò)出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20150415.1545.009.html
2015-02-07,
2015-03-02
國家科技部“重大新藥創(chuàng)制”科技重大專項(xiàng)“(No 2013ZX09102106,2013ZX09508104,2012ZX09301002001 001,2013ZX09103001-008,2012ZX09103101-078);國家自然科學(xué)基金資助項(xiàng)目(No 81473383)
何國榮(1974-),女,博士,助理研究員,研究方向:新藥發(fā)現(xiàn)與神經(jīng)藥理學(xué),Tel/Fax:010-63165184,E-mail: hegr@imm.ac.cn; 杜冠華(1956-),男,博士,研究員,博士生導(dǎo)師,研究方向:新藥發(fā)現(xiàn)與神經(jīng)藥理學(xué),通訊作者,Tel/Fax:010-63165184,E-mail: dugh@imm.ac.cn
10.3969/j.issn.1001-1978.2015.05.008
A
1001-1978(2015)05-0623-08
R-332;R322.81;R282.71;R745.705.31