免疫親和柱凈化-液相色譜-串聯(lián)質(zhì)譜法測定海洋生物中河豚毒素
嚴忠雍 張小軍 李奇富 王瑩 柳家鵬龍舉 祝銀 楊會成
1(浙江省海洋水產(chǎn)研究所,舟山316021)
2(江蘇美正生物科技有限公司,無錫214135)
3(浙江省海洋漁業(yè)資源可持續(xù)利用技術(shù)研究重點實驗室,舟山316021)
4(浙江省海洋開發(fā)研究院,舟山316021)
1 引言
河豚毒素(Tetrodotoxin,TTX)是一種天然海洋生物神經(jīng)毒素,分布廣泛,主要存在于河豚魚中,圓尾鱟、藍環(huán)章魚、螺類等其它海洋生物中也有存在。河豚毒素毒性極強,食用0.5 mg 就可致人死亡,其帶正電荷的胍基能伸入鈉通道的離子選擇過濾器,和通道內(nèi)壁上的游離羧基結(jié)合,阻礙Na+進入,從而抑制神經(jīng)沖動的傳導(dǎo),使人感覺神經(jīng)麻痹,四肢癱瘓,呼吸困難,最后因呼吸抑制而死亡[1~4]。我國每年都有因食帶有TTX 的海洋生物而導(dǎo)致中毒的事件發(fā)生。鑒于河豚毒素的嚴重危害,有必要建立一種簡便、快速有效檢測河豚毒素的方法。目前,河豚毒素的檢測方法有生物測定法[5]、高效液相色譜法(HPLC)[6,7]、液相色譜串聯(lián)質(zhì)譜法(LC-MS)[8~11]及酶聯(lián)免疫法(ELISA)[12]等。其中,生物測定法一般需要專門動物,適用性差,且操作繁瑣,費時費力重復(fù)性差;酶聯(lián)免疫法雖特異性強,但酶聯(lián)免疫反應(yīng)耗時長,操作難度較大;液相色譜串聯(lián)質(zhì)譜法靈敏度高,但現(xiàn)有的文獻方法檢出限偏高,前處理復(fù)雜,且采用的固相萃取技術(shù)凈化樣品不理想、易受基質(zhì)干擾,回收率低。免疫親和柱(IAC)是一種基于抗原抗體反應(yīng)的新型層析柱,利用生物大分子具有對一類生物大分子特異識別和可逆結(jié)合的特性制作而成,具有獨特的選擇專一性和良好的吸附凈化性能。目前,尚未見以免疫親和柱作為前處理凈化手段檢測河豚毒素的相關(guān)報道,本實驗基于液相色譜串聯(lián)質(zhì)譜的高靈敏性和精確性,利用免疫親和柱的獨特選擇識別性,建立一種快速、簡便、高效測定海洋生物中河豚毒素的分析方法。
2 實驗部分
2.1 儀器與試劑
ACQUITY 超高效液相色譜-質(zhì)譜儀Quattro Premier XE(美國Waters 公司);MS2 漩渦混合器(德國IKA 公司);N-EVAP-112 氮吹儀(美國Organomation 公司);Centrifuge5810 高速離心機(德國Eppendorf公司);12 通道固相萃取裝置(美國Supelco 公司)。
TTX 標準品(純度≥98.0%,德國Dr.Ehrenstorfer 公司);TTX 免疫親和柱(柱容量3 mL,北京華安麥科生物技術(shù)有限公司);乙腈、甲醇(色譜純,德國Merck 公司);乙酸銨、甲酸(美國Sigma 公司);乙酸、Na2HPO4·12H2O、NaH2PO4·2H2O、NaCl、NaOH(上海國藥集團);實驗用水均為超純水。
2.2 溶液的配制
TTX 標準溶液:準確稱取5.00 mg TTX 標準品,用0.1%甲酸-乙腈(1∶1,V/V)溶液溶解并定容至50 mL,4 ℃避光保存,保存期限為6 個月;使用時逐級用0.1%甲酸-乙腈溶液(1∶ 1,V/V)稀釋至100 μg/L。磷酸鹽緩沖液(PBS):分別稱取Na2HPO4·12H2O 6.45 g,NaH2PO2·2H2O 1.09 g,NaCl 4.25 g,用水溶解并定容至500 mL。
2.3 色譜及質(zhì)譜條件
色譜柱:ACQUITY UPLC BEH Amide 柱(50 mm×2.1 mm,1.7 μm);樣品室溫度10 ℃;柱溫40 ℃;進樣體積10 μL;流速0.3 mL/min;流動相A 為含0.1%甲酸的5 mmol/L 乙酸銨溶液,B 為乙腈,梯度洗脫:0 ~1.5 min,5% ~80% A;1.5 ~3.0 min,80% A;3.0 ~3.5 min,80% ~5% A;3.5 ~5 min,5% A。
質(zhì)譜條件:電噴霧離子源,正離子掃描(ESI +);檢測方式:多反應(yīng)監(jiān)測(MRM);毛細管電壓:3.0 kV;離子源溫度:110 ℃;脫溶劑氣溫度:350 ℃;錐孔氣流量:50 L/h;脫溶劑氣流量:600 L/h;錐孔電壓、碰撞能量、分析物母離子及子離子等質(zhì)譜多反應(yīng)監(jiān)測實驗條件如表1 所示。

表1 河豚毒素的質(zhì)譜多反應(yīng)監(jiān)測實驗條件Table 1 Conditions of multiple reaction monitoring for tetrodotoxin (TTX)
2.4 樣品處理
2.4.1 樣品提取 稱取已充分均質(zhì)樣品2.00 g 于50 mL 具塞離心管中,加入10 mL 含有1%乙酸的甲醇溶液,渦旋振蕩2 min,60 ℃水浴超聲提取15 min,冷卻至室溫后,6000 r/min 離心5 min。移取5 mL 上清液至另一個50 mL 離心管中,加入20 mL PBS 溶液稀釋,用1 mol/L NaOH 調(diào)至pH 7 ~8,待凈化。
2.4.2 免疫親和柱凈化 取出免疫親和柱,待回至室溫,去掉親和柱堵頭,放出柱內(nèi)保存液后,上樣品液。上樣結(jié)束后,用8 mL 水淋洗親和柱,擠干柱內(nèi)殘留液,并棄去以上全部流出液,最后用4 mL 含有1%乙酸的甲醇溶液洗脫,收集的洗脫液于60℃氮氣吹干,用1 mL 流動相溶解并定容,經(jīng)0.22 μm 濾膜后供液相色譜-質(zhì)譜分析。
3 結(jié)果與討論
3.1 色譜與質(zhì)譜條件選擇
TTX 由于親水性和極性較強,在一般的反向色譜柱上不易保留,而ACQUITY UPLC BEH Amide 色譜柱作為專用于強極性化合物分析的親水色譜柱,對TTX 保留性強,且具有較好的色譜峰形,滿足TTX液相色譜分析的需要。乙酸銨溶液能促進TTX 胍電離,并為陽離子的形成提供了質(zhì)子來源,提高TTX離子化效率;甲酸能通過調(diào)節(jié)流動相pH 達到合適的分離效果,改善色譜峰形。本實驗研究比較了多組不同體積分數(shù)甲酸及不同濃度乙酸銨溶液對色譜分析的影響。結(jié)果表明,以0.1%甲酸的5 mmol/L 乙酸銨溶液與乙腈為流動相具有良好的色譜分離效果,且峰形尖銳對稱。
TTX 分子結(jié)構(gòu)中具有帶正電荷的胍基,本實驗選擇在正離子掃描模式下用蠕動泵以3.0 mg/L 的TTX 標準溶液進行流動注射分析,對質(zhì)譜參數(shù)進行優(yōu)化。通過一級質(zhì)譜掃描分析,得到TTX 的分子離子,調(diào)試選擇最佳錐孔電壓和毛細管電壓,其中[M+H]+(m/z 320)豐度最高,從而可選擇離子m/z 320作為母離子進行檢測,如圖1 所示。對分析物離子進行二級質(zhì)譜分析,獲取碎片離子信息,并對碰撞能量等質(zhì)譜參數(shù)進行優(yōu)化,見表1。
3.2 提取試劑的選擇
TTX 是一種氨基全氫喹唑啉型化合物,只溶于酸性水或有機溶液。本實驗比較了乙腈和甲醇對TTX 的提取效率。乙腈作為常用的提取試劑,提取效率較好,但毒性較大;考慮到甲醇能迅速穿透組織,沉淀蛋白質(zhì),并具有脫水性,是提取TTX 的良好試劑。為考察TTX 提取所需的合適酸度,通過添加不同體積分數(shù)的乙酸獲取不同酸度的甲醇,比較不同酸度甲醇下提取得到的5 μg/L TTX 峰面積,結(jié)果如圖2 所示。當(dāng)提取試劑中乙酸體積分數(shù)小于1%時,提取得到的TTX 峰面積隨乙酸的體積分數(shù)增加而增大;當(dāng)體積分數(shù)大于1%后,峰面積基本保持不變,而過量的乙酸不利于調(diào)節(jié)樣品液pH 值,因此選擇含1%乙酸甲醇作為TTX 提取試劑。

圖1 TTX 一級質(zhì)譜全掃描圖Fig.1 MS scan spectra of TTX
3.3 免疫親和柱條件優(yōu)化
免疫親和柱的親和結(jié)合作用與樣品液的pH 值直接相關(guān),不適宜的pH 值會使親和作用減弱或破壞。本實驗采用HCl 和NaOH 調(diào)節(jié)樣品液pH 值,通過比較不同pH 值下TTX 的回收率,考察不同pH值下免疫親和柱的親和作用能力,結(jié)果如圖3 所示。當(dāng)pH =7 ~8 時,親和作用能力最佳,TTX 回收率最高;當(dāng)pH <6.5 或pH >9 時,親和能力明顯減弱,由此確定pH=7 ~8 時為TTX 免疫親和柱的最適宜pH 值。當(dāng)使用8 mL 水淋洗親和柱時,雜質(zhì)可基本除去,而TTX 未被洗脫下來;當(dāng)4 mL 含有1%乙酸甲醇洗脫親和柱時,TTX 幾乎已完全洗脫,回收率也趨于穩(wěn)定。因此本實驗采用8 mL 水作為淋洗液,4 mL 含有1%乙酸甲醇作為洗脫液。

圖2 提取試劑酸度對TTX 提取效果的影響Fig.2 Effect of extraction reagent acidity on TTX extraction
本實驗還比較了MCX 柱、C18柱、SCX 柱與免疫親和柱對海洋生物的凈化效果,并考察4 種層析柱對TTX 回收率的影響。實驗結(jié)果表明,免疫親和柱對海洋生物樣品的凈化效果最好,目標峰能與雜峰有效分離,且響應(yīng)強度高,回收率好,如圖4 所示。

圖3 樣品液pH 值對樣品中TTX 的回收率的影響Fig.3 Influence of pH on the recoveries of TTx in sample solution
3.4 線性范圍和定量限
用TTX 標準使用液配制濃度為0.3,1.0,2.0,5.0,10.0 和20.0 μg/L 標準工作溶液,峰面積-TTX 濃度標準曲線的線性回歸方程為y =72.2835x +13.5344(R2=0.9972),TTX 在0.3 ~20.0 μg/L 范圍內(nèi)線性良好。以3 倍信噪比確定本方法的檢出限(LOD)為0.1 μg/kg,以10 倍信噪比確定本方法的定量限(LOQ)為0.3 μg/kg,如圖5 所示。本方法較文獻[10,11]檢出限更低,靈敏度提高了3 ~4 倍,適用于海洋生物中TTX 的檢測。

圖4 10 μg/kg 加標陰性樣品經(jīng)免疫親和柱凈化后的MRM 圖譜(a.定量離子對;b.定性離子對)Fig.4 MRM chromatograms of 10 μg/kg spiked sample cleaned up by IAC column(a.quantitative ion pair;b.qualitative ion pair)

圖5 TTX 定量限的MRM 圖(a.定量離子對;b.定性離子對)Fig.5 MRM chromatograms of quantification limit (a.quantitative ion pair;b.qualitative ion pair)
3.5 回收率和精密度
準確稱取2.00 g 陰性對蝦樣品,添加水平為0.30,1.50 和5.00 μg/kg 的TTX 標準溶液,每個添加水平平行測定6 次,計算回收率和精密度,結(jié)果見表2。TTX 在0.30 ~5.00 μg/kg添加水平的平均回收率88.7% ~102.3%,相對標準偏差為2.0% ~6.4%。
3.6 實際樣品分析
采用本方法對鷹爪蝦、對蝦、海鰻、荔枝螺、單齒螺、織紋螺、槍烏賊、曼氏無針烏賊、貽貝、花蛤、三疣梭子蟹、細點圓趾蟹、圓尾鱟等共計13 種樣品進行檢測,其中織紋螺、花蛤、圓尾鱟樣品中檢出TTX,濃度依次為56.4,2.43 和174 μg/kg。分析結(jié)果表明,本方法采用免疫親和柱凈化、液相色譜-串聯(lián)質(zhì)譜法檢測海洋生物中河豚毒素,靈敏度高,精密度和回收率均能滿足檢測分析的要求。
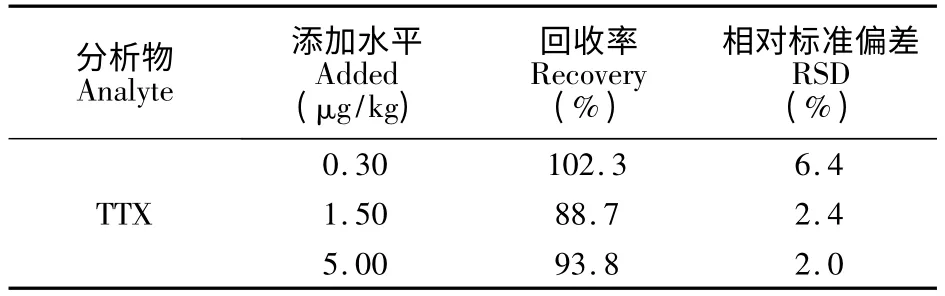
表2 TTX 的標準加入回收率和相對標準偏差(n=6)Table 2 Recoveries of standard addition and relative standard deviation for TTX (n=6)
1 WANG Jian-Wei,WANG De-Bin,LUO Xue-Yun,JI Rong,ZHANG Jing,CAO Ming-Hua.Journal of Hygiene Research.,1996,25(5):308 -311
王健偉,王德斌,羅雪云,計融,張靖,曹明華.衛(wèi)生研究,1996,25(5):308 -311
2 LIN Zhong,F(xiàn)ANG Guang-Wei,LU Wei,HUANG Ping,TONG Yu-Gui,CHENG Qun,LIN Bi-Fen.Chin.J.Food Hyg.,2012,24(2):145 -148
林中,方光偉,呂偉,黃萍,童玉貴,程群,林碧芬.中國食品衛(wèi)生雜志,2012,24(2):145 -148
3 ZHANG Yong-Yi,WANG Yan,ZHANG Ji,WANG Ren-Feng,YAN Chao.Chinese J.Anal.Chem.,2008,36(5):588 -592
鄭雍怡,王彥,張計,王刃鋒,閻超.分析化學(xué),2008,36(5):588 -592
4 Takuya M,Yuji N,Hiroyuki K,Shoichiro I,Kuniyoshi S,Kazuo S.Toxicon.,2008,51(6):1051 -1059
5 JI Yuan,LIU Yan,GONG Qing-Li.Journal of Fisherles of China.,2010,34(4):589 -597
紀元,劉巖,宮慶禮.水產(chǎn)學(xué)報,2010,34(4):589 -597
6 Tsai Y H,Hwang D F,Cheng C A,Hwang C C,Deng J F.J.Chromatogr.B,2006,832(1):75 -80
7 Allen D T,Jon L,Stacey E,Jonathan D,Sherwood H,Jiang S Y.Sens.Actuators B.,2008,130(1):120 -128
8 ZHANG Xiu-Yao,CAI Xin-Xin.Chinese J.Anal.Chem.,2009,37(12):1829 -1833
張秀堯,蔡欣欣.分析化學(xué),2009,37(12):1829 -1833
9 Xiao W C,Hong X L,Yi B J,Shang F L,Xin B,Stephen C,Shu S Z,Yu Y J.Toxicon,2011,57(6):938 -943
10 Hsiao C,Thi A N,Ya J,Tung H,Osamu A,Wen F,Deng F.J.Food Drug Anal.,2014,22(2):178-188
11 Hsiao C,Shin J,Yung H,Chun H,Zu C,Deng F.J.Chromatogr.B,2008,871(2):95 -100
12 Determination of tetrodotoxin in fresh pufferfish.GB/T 5009.206-2007
鮮河豚魚中河豚毒素的測定.中華人民共和國國家標準.GB/T 5009.206-2007

