基于介電電泳的微流控細胞分離芯片的研究進展
陳 禮 鄭小林 胡 寧 楊 軍 羅洪艷 姜 帆 廖彥劍
(重慶大學生物工程學院,生物流變科學與技術教育部重點實驗室,視覺損傷與再生修復重慶市重點實驗室,重慶400030)
1 引言
細胞分離作為一個重要的純化過程[1],在生物研究和分析診斷中有著極其重要的應用。許多基于細胞的研究領域,如臨床診斷、環境監測、食品加工以及制藥工業等都需要進行目標細胞的高靈敏度檢測和高純度加工,上述基礎及應用研究工作的開展都依賴于細胞分離技術[2~5]。針對懸浮液中生物微粒的電磁操作是目前生物分析領域的一個研究熱點,細胞分離也是其中一個重要內容。
傳統的細胞分離方法主要分為兩類[6]:第一類是依靠細胞本身的尺寸、重力特性進行分離,如離心法、重力沉積法等,這類方法分離精度較低,分離時間較長且操作復雜,對細胞活性有較大影響;第二類則需要細胞間接帶電或者外加磁性物質,最后在電場或者磁場作用下進行細胞分離,如電泳法、磁性分離法等,這類方法通常需要對細胞進行預處理,在細胞表面附著其它物質,且在分離之后難以去除附著物,對于細胞存活率影響較大,操作流程繁瑣,價格不菲。同時,上述細胞分離方法通常需要旋流器、流式細胞儀等專業設備,存在體積大、操作人員需進行專業培訓、成本昂貴等缺點,限制了其廣泛應用。
由電泳技術發展而來的介電電泳(Dielectrophoresis,DEP)[7]打破了前者要求微粒帶電的限制,能讓電中性微粒在空間非均勻直流或者交流電場的作用下,發生極化而沿場強變化方向受到介電電泳力(凈力),并在介電電泳力作用下發生移動。自1978年Pohl[8]將介電電泳引入生物和化學領域,特別是將該技術應用于傳統電泳無法高效解決的細胞分離和操縱難題以來,該技術就一直受到各國研究者的重視并不斷發展完善[9]。較傳統電泳方法而言,該技術具有許多優點[10~12],如不需要標記抗體,從而可避免細胞在分離過程中因抗體反應而發生生物性質改變;所用低強度的交變電場對細胞的作用是“非破壞性”的,大量研究結果已經證明其不會改變細胞的生長及分裂性質;使用靈活,電場強度、頻率、相位都容易調控,便于自動化操作;同時,介電電泳分離方法還可與其它方法結合使用,以達到最佳的細胞分離檢測效果。
近年來,隨著介電電泳技術的理論成熟和微流控芯片加工技術的飛速發展,利用微流控芯片體積小、造價低廉、液體流動可控、消耗試樣和試劑極少、通量高、檢測分析精度好等優點,在芯片上開展基于介電電泳的細胞分離成為國內外研究熱點[13~16]。基于介電電泳的微流控細胞分離芯片結合了介電電泳和微流控芯片技術的優點,同時,分離目標不僅局限于細胞,也可以進行微米尺度的礦物顆粒[17]、聚苯乙烯微球[18]、液滴[19]、細菌[20~21]和酵母菌[22]等目標物的分離純化,甚至還可以分離納米尺度的病毒[23]、納米粒子、DNA[24]、碳納米管[25~26]等。
本文介紹基于介電電泳的微流控細胞分離芯片的研究現狀,總結了影響介電電泳分離的關鍵因素,對不同類型的微流控細胞分離芯片進行了介紹,并對該技術的未來發展趨勢進行了展望。
2 介電電泳細胞分離的基本理論
帶電粒子在直流電場作用下于一定介質中所發生的定向運動,稱為電泳;非帶電顆粒(電介質)在電場作用下的定向運動叫電介質電泳(Dielectrophoresis,DEP),簡稱“介電電泳”[27]。電泳和介電電泳有著本質的區別。電泳的粒子帶電,而介電電泳的顆粒為電中性。懸浮于鹽溶液中的細胞可以在電場中運動,這是因為細胞表面具有一定的電荷(通常為負電荷),可以吸附被極化的水分子層,它與介質之間存在著電位差,此電位差產生了細胞電泳運動的驅動力。電中性顆粒(例如細胞)處于非均勻電場時,電介質顆粒中的電荷在電場極化作用下發生移動從而構成一個電偶極子,該細胞電偶極子在電場中受到電場力的作用。該電場力即為介電電泳力,簡稱DEP力[28,29]。
當微粒和溶液處于交流電場中時,微粒和溶液都會受到極化作用,當微粒比溶液受到的極化作用強時,微粒受到的沿場強增大方向的力大于溶液,從而使中性微粒聚集在電場的極大值處,這一現象稱為正介電電泳,所受的力為正介電電泳力,簡稱pDEP力;反之則為負介電電泳,所受的力為負介電電泳力,簡稱 nDEP 力[30]。
對球形顆粒或者球形細胞(半徑為r,相對介電常數為εP,電導率為σp)懸浮于流體介質(相對介電常數為εf,電導率為σf)的情形,處于外加非均勻交變電場中且電場的相位不發生變化時,根據偶極子模型可以得到作用在其上的DEP力(FDEP),其簡化計算公式[31,32]為:
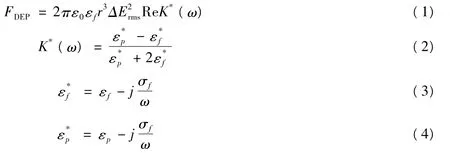
式中:ε0為真空介電常數;ω為外加電場信號的角頻率;Erms為外加電場的均方根。DEP力的方向取決于K*(ω)實部部分(Clausius-Mossotti因子,簡稱CM因子,用fCM(ω)表示)的符號。當Re[K*(ω)]>0時,顆粒在非均勻外加電場的作用下從低電場區域被吸引至高電場區域,為正介電電泳(pDEP);反之,當Re[K*(ω)]<0時,將從高電場區域被排斥至低電場區域,則為負介電電泳(nDEP)。式(1)所示DEP力(FDEP)的計算有一個前提,那就是施加的非均勻交變電場的相位不發生變化。當相位發生變化的時候,式(1)就不再適用了,此時的介電電泳力與K*(ω)的虛部部分有關,計算較為復雜,稱為行波DEP[33,34]。
細胞在介電電泳力作用下可改變其運動狀態或趨勢,進而可以實現細胞操作。根據細胞在緩沖液中所受介電電泳力的差異,可以進行細胞的分離。通常情況下,在分離樣本和緩沖液環境固定后,CM因子只與電場信號頻率有關,因此在實驗中CM因子-頻率圖譜是選定合適的介電電泳分離頻段的重要依據[35]。要分離兩種不同細胞的混合樣品,可以借助介電電泳力的差異設計相應的實驗方案。目前經典的方案有兩種:(1)使一種細胞的CM因子為正值,受到正介電電泳作用,運動方向為靠近電極方向(高電場區域),另一種細胞的CM因子為負值,受到負介電電泳作用,運動方向為遠離電極方向(低電場區域);(2)兩種細胞受到同一類型介電電泳力時(pDEP或nDEP),借助介電電泳力大小的差異實現樣本在芯片內部運動軌跡差異達到分離的目的。
3 不同類型的微流控細胞/微粒分離芯片
由公式(1)可知,影響細胞DEP作用的因素有細胞尺寸、細胞和懸浮液的相對介電常數和電導率、電場梯度的大小、電信號頻率等。其中,電場梯度的產生主要取決于電極形狀,因而電極形狀的選擇對介電電泳細胞分離芯片的設計非常重要[36,37];而外加信號的類型將直接影響分離操作,因此激勵信號的優化配置顯得尤為關鍵。此外,選擇合適的懸浮液也是必須考慮的因素。
3.1 基于細胞尺度效應的介電電泳分離芯片
細胞的尺寸從幾微米到幾十乃至上百微米,對于不同尺寸的細胞,在非均勻電場中,所受到的介電電泳力FDEP與細胞半徑r的三次方成正比,因此可以利用此原理進行細胞分離。下面介紹幾種利用此類方法進行分離的微流控芯片。
3.1.1 DEP與Field-Flow-Fractionation(FFF)聯用法分離芯片 根據層流理論,在微管道中流動的液體流層與管壁、流層與流層之間的粘性力導致管壁處流層流速最低,管軸處速度最大,且越靠近管軸處速度越大,速度與管軸處的距離成拋物線分布。Wang等[38,39]發展了基于DEP力場的流動分離方法(圖1),當流場以圖示方向流動時,電極陣列置于流道的底部,形成非均勻電場,通過選擇合適的頻率使細胞受nDEP力作用,而nDEP力將把顆粒推離流道底部;顆粒最終的位置取決于DEP力在垂直方向上的分量FDEPz與顆粒重力及浮力合力Fsed的平衡關系。由于DEP力與顆粒半徑成正比,不同尺度的顆粒將承受不同的DEP力,它們在垂直方向的平衡位置(h1和h2)也會同。不同的顆粒將分別處于拋物線速度剖面的不同層,由此具有不同的移動速度(v1與v2)。當在管內流動一段時間和距離之后,各尺寸不同的粒子就會在距離上產生差異,此時在管口分時收集就可達到分離不同種細胞或者微粒的目的。
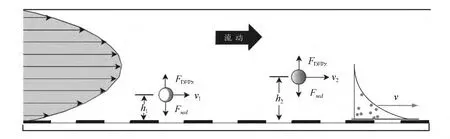
圖 1 DEP-FFF 細胞分離微流控芯片[38,39]Fig.1 Dielectrophoresis-field-flow-fractionation(DEP-FFF)cell separation microfluidic chip
3.1.2 DEP與曲率誘導聯用法分離芯片 Zhu等[40]在2011年提出了一種介電電泳細胞分離芯片。該芯片在蛇形通道內使用曲率誘導介電電泳,成功地用于分離酵母菌和3 μm尺寸的聚苯乙烯顆粒(圖2),分離效率高達95%。該芯片由4個流通池和連接流通池的蛇形分離通道構成(圖2a)。其工作原理如圖2b所示:混合樣品(顆粒)從A口流入,B口流入緩沖液。當混合微粒運動到轉彎位置的時候,選擇合適的頻率使白色顆粒CM因子為負,藍色顆粒CM因子為正,這樣在轉彎時藍色顆粒由pDEP產生的向心力繼續留在內側流層中,而白色顆粒受到nDEP作用向外側流層偏移,這樣經過數十個蛇形轉彎通道的曲率誘導介電電泳作用積累,使白色顆粒在外側流層中,藍色顆粒留在內側流層。在出口處,在外側流層中的白色顆粒從C口流出,在內側流層中的藍色顆粒從D口流出,達到分離的目的。研究人員借助Comsol模擬(圖2c和2d)其分離過程,結果顯示,借助曲率誘導介電電泳效應,能夠對細胞尺寸不一和CM因子不同的兩種細胞進行分離。
該類分離芯片可用于對介電電泳極性相反(一種為pDEP,另一種為nDEP)的細胞進行分離,分離精度較高,操作簡便,但缺點是只能分離兩種細胞或者微粒,且需實驗前需測得兩種細胞或者微粒的正-負介電電泳臨界頻率。
細胞半徑是標志細胞大小的參數,常用作細胞分選的特征參數。介電電泳力FDEP與細胞半徑r的三次方成正比,使得基于介電電泳和細胞尺寸差異的分離方法更容易得以實現。與尺寸相關的DEP分離方法也常與其它方法聯合使用,如DEP與超聲聯用、DEP與磁場聯用、DEP與光鑷技術聯用等[31,32],在此就不一闡述。此外,基于細胞尺度效應的介電電泳分離芯片在某些方面亟需改進:(1)在理論和仿真研究中,細胞模型的建立還有待進一步完善。由于大多數細胞是球型,因此在進行理論仿真時候常把細胞看作是雙層球殼,但事實上很多細胞是長條狀、棒狀或者其它不規則形狀。(2)在實際樣本中,細胞(粒子)間的區別低于實驗中選取的特定樣本,也就是說,當兩種細胞在尺寸、形狀上具有一定的相似性時,對于這類性質差別不大的分離對象,還需進一步提高介電電泳的分辨率。而且,對于植物細胞而言,細胞壁的存在也會使細胞理論模型和實際情況有所區別。
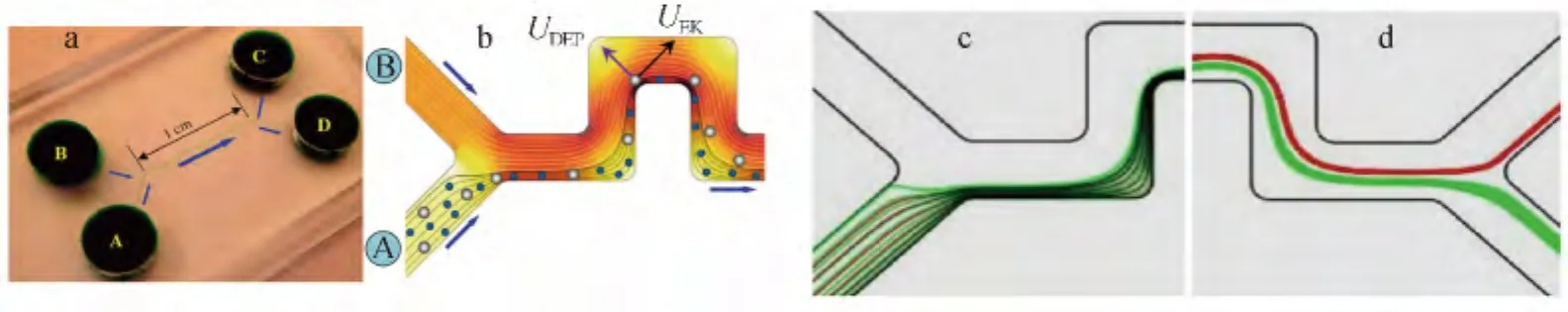
圖2 曲率誘導介電電泳細胞分離芯片[40](a)芯片實物圖;(b)原理圖;(c)芯片入口流路分布圖;(d)芯片出口流路分布圖。Fig.2 Cell separation microfluidic chip via curvature-induced dielectrophoresis:(a)Picture of microfluidic chip;(b)Illustration of sheath-flow focusing and dielectrophoretic separation of particles;(c)and(d)Numerical prediction of the flow of inlet and outlet[40]
3.2 基于電極優化的介電電泳分離芯片
在基于介電電泳的細胞分離研究中,電場梯度同樣是影響細胞DEP作用的重要因素。微流控芯片上的非均勻電場主要是由電極產生的,所以電極的形狀和分布對FDEP的分布具有決定意義[41]。芯片電極的分類方法比較多,沒有統一標準。如按照電極形狀可分為叉指電極、城墻狀電極、螺旋電極、對電極等;按照電極的分布可分為底部電極、側壁電極、和空間電極等,其中側壁電極還可分為單側電極、雙側電極等;按照電極的材質和制作工藝可分為金屬電極、碳電極、復合電極等;按照電極的配置方式可分為二維平面電極、三維立體電極等。本文將按照電極的結構將電極分為陣列式電極、環狀電極、柱狀電極和不規則電極等類型。
3.2.1 陣列式電極 陣列電極分離芯片的設計思路是通過在微流控芯片上集成陣列化微電極(不同或同種結構),實現大量生化樣品的在線分離和富集。電極的形狀、大小和位置直接影響非均勻電場的分布,而電極的厚度則影響芯片的鍵合和系統的集成化。Yang等[42]對平面交錯式陣列電極設計的DEP芯片(圖3a)采用多物理量耦合分析軟件(FEMLAB)進行仿真,計算了圖3b中右上角所示電極結構的電場分布。電極陣列中高電場區域始終位于電極邊緣處,該處適合做正介電電泳運動的細胞實現富集。在電極的寬度和間距相等時,低電場區域出現在電極的中心位置和相鄰電極的中心線位置,且場強相等;如果電極的寬度大于電極的間距,則低電場區域集中于電極平面的中心線位置;如果電極的寬度小于電極的間距,則低電場區域集中于相鄰電極間距的中心線位置,在該處適合作負向介電電泳的細胞實現富集。Yang等[42]設計的芯片管道高度不到100 m,在2 V和2 MHz的電信號條件下,能夠保證99%的捕獲效率,從而實現心肌細胞的正介電電泳分離和富集。
陣列式電極以其獨特的結構,具有很多優點:可在有限的區域內分列排布大量電極;適用于高通量的分析檢測要求,分離效率高且速度快。但陣列式電極對電極加工工藝和流程要求較高,電極間隙和相鄰電極間的距離有較為嚴格的要求,在設計芯片時,應先根據適用對象和目標使用數值模擬軟件得到其最佳的物理分布位置[43]。
3.2.2 環狀電極 隨著介電電泳技術的發展,單純的針狀或者對狀電極已經不能滿足實驗的需要。而且,隨著分離的細胞種類多樣化,對電場梯度的要求也越來越高。因此,一些新型電極,如環狀電極被設計出來(圖4)[44,45]。環狀電極的特點在于其電極形狀不是傳統的城墻形狀或者叉指形狀,而是根據實驗對象靈活多變,大多比較復雜,電極曲線比較光滑,如常見的螺旋電極。
3.2.3 柱狀電極 在介電電泳分離芯片中,常用的二維電極具有許多局限性,而且加工工藝復雜。傳統芯片微電極是厚度為幾百納米的金屬薄膜平面電極,其加工方法是在采用電鍍或濺射的方法在基片上形成特定圖案的金屬電極,對于過量的部分利用剝離、蝕刻,結合某些特殊的光刻加工工藝去除[46]。但二維電極產生的電場隨著粒子距電極表面距離的增加而呈指數型衰減[47],這意味著部分粒子由于距離電極較遠,受到電場的作用微弱,而無法實現有效控制。
為了解決上述問題,近年來越來越多的芯片采用雙側平面電極或三維電極來產生三維電場。與二維電極相比,三維電極的魯棒性更好,可承受的電流密度更大,且在電流熱效應作用下產生的焦耳熱較平面電極小,在平面電極發展的同時,三維電極以其空間的電場分布優勢,需要電壓小且捕捉更牢靠的優勢吸引了人們的視線[48]。三維電極中常采用柱狀電極,其使用頻率較高,加工難度較小,分離效果較好。
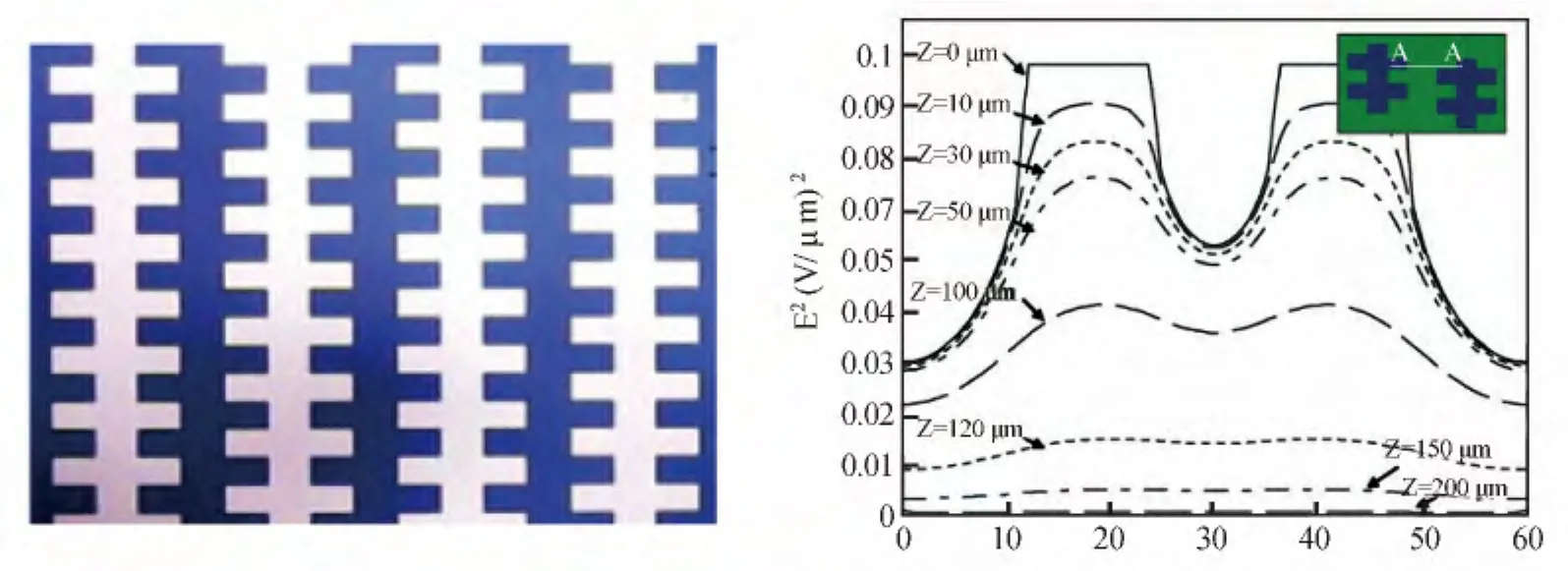
圖3 陣列式電極[42]Fig.3 Array of electrodes[42]a.電極結構(Electrode structure);b.電場仿真(Simulation of field)。

圖 4 環狀電極[44,45]Fig.4 Ringlike electrodes[44,45](a)螺旋電極(Picture of spiral electrodes);(b)同心環電極(Picture of concentric electrodes)。
Hunt等[49]設計并制作了圓柱狀電極微流控芯片(圖5a),每個柱狀電極由單獨的引線供電,故可在同一芯片區域選擇不同幅值、頻率和相位的信號配合使用,使該電場區域適合進行介電電泳分離活動。
Iliescu等[50]設計并制作了三維正方體柱狀電極細胞分離微流控芯片(圖5b),與Hunt等的圓柱形電極[49]相比,此電極截面為正方形,通過數值仿真可以看出正方形的4個頂點處電場梯度值最高,在介電電泳作用下,細胞吸附能力最強,較圓柱形電極的分離、富集效果更好,將其用于分離活、死酵母細胞的分離精度95%。
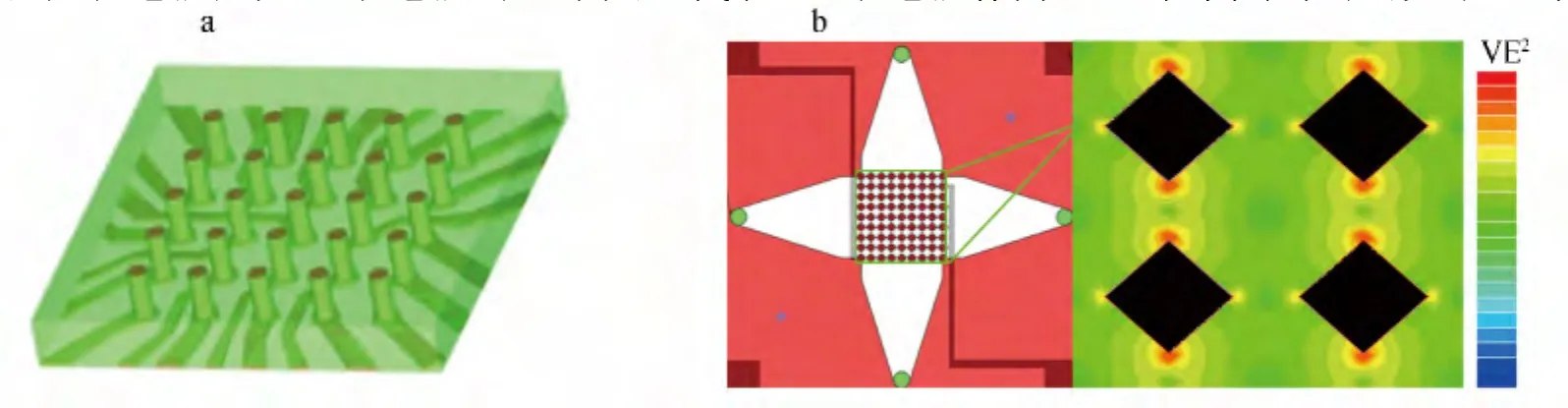
圖 5 三維電極[49,50]Fig.5 Three-dimensional(3D)electrodes[49,50](a)圓柱狀電極(Picture of columnar electrodes);(b)正方體柱狀電極、電場仿真圖(Picture and the numerical simulation of electric field of the cubic electrode)。
當然,柱狀電極只是三維電極的一個典型代表,三維電極作為近幾年來熱門的研究話題,其發展速度也是日新月異,各種形狀、各種材質的三維電極已經多次報道。
3.2.4 不規則電極 在介電電泳分離技術中,電極的設計占據了相對重要的地位。
由于分離目標的多樣化,導致了電極形狀和結構的多樣化。除了前面介紹的幾種常規電極,很多非常規的不規則電極也在使用。Hoettges等[51]發展了拉鏈狀環形電極(圖6a),并使用其進行了孢子的富集和分離,實驗觀察到孢子聚集在拉練環狀的中心處,在該裝置中,孢子受到nDEP作用。Malnar等[52]設計的條狀電極尖端有三角形彎折(圖6b),使得一種微粒被捕捉在電極處,而另一種微粒隨著流體的拖曳力流出。Gonzalez[53]設計了可分別加信號的棘齒狀電極(圖6c),成功進行了鐵磁礦物粒子和聚苯乙烯顆粒的捕捉和分離,分離效率高。Pethig等[54]設計了波浪形電極陣列,利用多重介電電泳和行波介電電泳的重疊,使得微粒達到分離目的(圖6d)。除了上述不同電極形狀之外,還有糖葫蘆狀、叉指電極等各式電極,其設計思路與分離對象也各不相同。
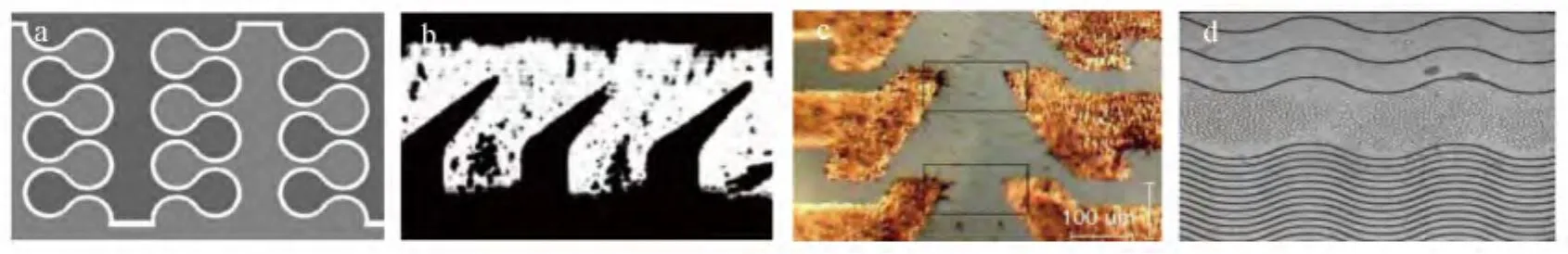
圖6 各種不規則電極Fig.6 Different kinds of irregular electrodes(a) 拉鏈環狀電極(Zipper annular electrodes)[51];(b) 彎折三角形電極(Bending triangle electrodes)[52];(c) 棘齒狀電極(Ratchet electrodes)[53];(d) 波浪形電極(Undulating electrodes)[54]。
以上分類是從電極形狀上考慮的,不能包含所有報道過的微電極,這是因為電極分類方法較多,分類標準不統一。在考慮芯片上微電極的設計時候,應當從實驗目的和實驗對象出發,綜合電極形狀、電極厚度、加工難度以及組裝集成的難度等方面來考慮。二維平面電極已經廣泛應用于各種微流控芯片中,最近幾年三維電極以其獨特的空間電場分布優勢正在逐漸擴展到微流控芯片的各個領域,是微電極發展的主要方向與趨勢之一。
3.3 基于激勵信號優化的介電電泳分離芯片
根據所施加的外加電場的種類不同,可以將介電電泳分離芯片分為直流式介電電泳芯片(DC-DEP Chip)、交流式介電電泳芯片(AC-DEP Chip),而交流式介電電泳芯片還可細分為常規介電電泳芯片、行波介電電泳芯片。
3.3.1 直流式-介電電泳芯片(DC-DEP Chip) 根據介電電泳的定義,當細胞處于非均勻直流電場中時,也會發生極化現象,產生介電電泳力。直流式-介電電泳芯片模式中,直流信號施加在介電電泳芯片微通道兩端,利用微通道內加工的絕緣障礙可以使電力線發生扭曲,從而產生非均勻電場,進而產生極化現象,實現樣品的介電電泳富集、分離操控。Blanca和Cummings研究小組證明了集成圓形絕緣微柱陣列的介電電泳芯片對分散性微粒和聚苯乙烯的介電電泳誘捕能力[55,56]。Ciprian等[57]采用相同的集成有圓形絕緣微柱陣列的介電電泳芯片實現了酵母細胞的介電電泳富集,其富集效率達到75%。魏慶華等[58]采用SU-8聚合物材料制作的絕緣微柱介電電泳芯片(圖7),用于分離和富集直徑為16 m的乳膠粒子。受到電場強度較大區域(微圓柱周圍)吸引的粒子將在圓柱周圍產生集中;而沒有受到吸引的粒子會在電場強度較小的區域(微圓柱與微圓柱之間)成串流動,從而達到微粒分離的目的。
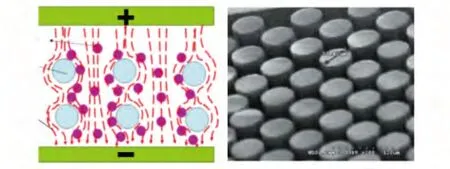
圖7 直流式-絕緣微柱電極[58]Fig.7 Direct current-insulated micro-column electrodes.
采用絕緣微柱構建的介電電泳芯片,由于直流電壓同時作為待分析樣品的驅動電壓和富集分離電壓,必然導致樣品緩沖液中電流值的增加,從而對生物樣品的活性造成破壞,如細胞膜被擊穿等。然而,在實際的科研中,使用直流介電電泳的機會較少,使用交流信號介電電泳則比較普遍,這是因為盡管介電電泳理論上并沒有限制直流電的使用,然而高頻交流電的使用可以更有效地消除直流電所引起的電解、電熱等問題,因此目前絕大部分實驗中都使用高頻交流電產生所需的電場,以避免在電極附近區域過熱或發生電解。
3.3.2 交流式-介電電泳芯片(AC-DEP Chip) 在直流介電電泳中,電場會以焦耳熱的形式產生功率損耗,相應的溫度變化可能會對細胞生理狀態產生負面影響。目前己知較高的溫度(高于細胞生理溫度4℃以上)將導致細胞迅速死亡。而在細胞內,細胞動力學過程和溫度呈指數關系,所以很小的溫度漂移也可能對細胞生理狀態造成影響。目前關于誘導細胞響應所需要的最小的溫度漂移還不清楚。所以實驗中必須盡力減小化溫度漂移。通常認為保持溫度變化<1℃是可以接受的,這個溫度變化和體內溫度變化相近,不會對細胞有明顯影響。而交流電在降低功率損耗方面具有相當的優勢,這就使得交流式-介電電泳在分離研究中較直流式-介電電泳具有更廣闊的應用。
(1)信號頻率恒定的介電電泳芯片 信號頻率恒定的介電電泳是最簡單、最基本、最早研究的介電電泳形式。其特點是使用兩相相位相反的交流信號,形成非均勻電場,使細胞在非均勻電場中產生感應偶極矩,從而受到介電電泳力的作用。根據細胞和懸浮液介電性質的差異,細胞將向電場中電場最強(pDEP)或者最弱的地方運動(nDEP)。利用微加工技術,現已設計制作出多種具有確定電場分布的信號頻率恒定的介電電泳芯片,電極的形狀主要有多項式函數形、正弦函數形、城堡形以及可單獨尋址的圓形電極陣列等。
2005年,韓國的Doh等[59]報道了一種可連續分離細胞的微流控芯片(圖8),在該芯片流路的底部或者通道側壁配置電極,施加恰當的交流信號,當混合樣品流過分離通道的時候,一種細胞受正向介電電泳作用從而產生一個與流路垂直的遠離原混合流體中心位置的橫向偏移量,隨著流動的持續,這種橫向偏移量會越來越大,細胞將從出口1流出;而另一種細胞受負向介電電泳作用,則仍按原軌跡運動,從出口2流出。Doh等[59]使用該方法進行了活、死酵母細胞的分離,由于缺乏對流體力與介電電泳力共同作用于樣品體系時受力情況的深入討論,采用該介電電泳芯片在出口處收集的酵母菌純度低于80%。
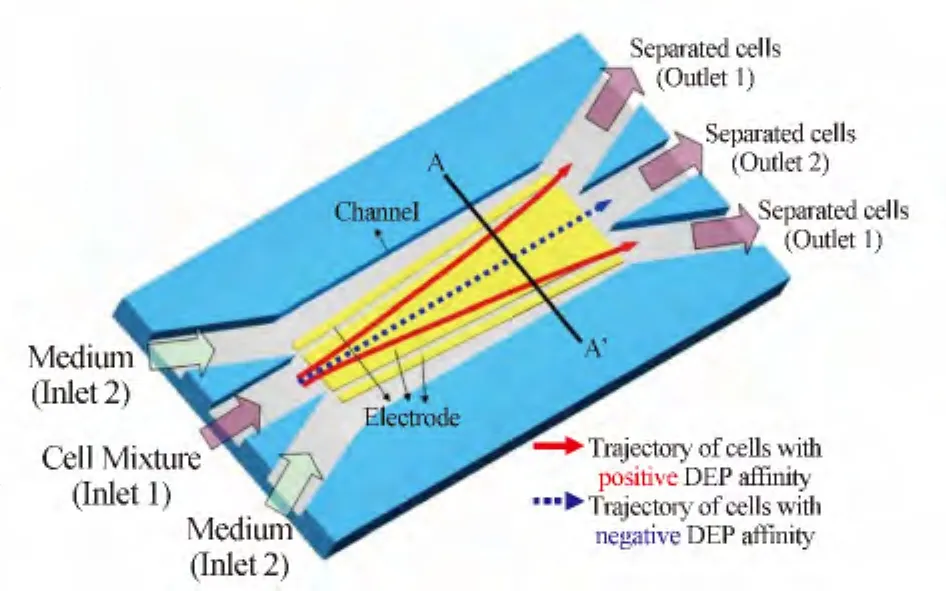
圖8 信號頻率恒定的介電電泳芯片[59]Fig.8 Dielectrophoretic chip with constant frequency signal[59]
信號頻率恒定的介電電泳芯片是使用非常廣泛的一種微流控芯片,該芯片對信號要求較低,只需選擇使兩種細胞分別處于正、負介電電泳的頻率即可完成分離,如果需要高精度的實驗結果,需考慮流場的影響。在條件不足的情況下,使用尋常的信號發生器也可以勉強用于實驗,對信號源的依賴性較小,但是為了獲得更好的分離效果,信號源的帶負載能力是不能忽視的指標。
(2)行波介電電泳芯片(Traveling wave dielectrophoresis,twDEP) 與信號頻率恒定的介電電泳不同,行波介電電泳一般采用四相交流信號,相鄰電極之間施加的信號相位差為90°。該方法一般通過在一系列線性排列的電極上施加上述交流信號,構建一個空間行波電場,其相位沿著電極排列的方向變化。當細胞處于這樣的電場中時不僅會受到由于電場強度分布不均勻產生的介電電泳力,即常規介電電泳力;同時也會受到由于電場相位分布不均勻而產生的介電電泳力,稱為行波介電電泳力[60]。細胞在行波介電電泳力作用下的運動稱為行波介電電泳。此處需注意的是,使用公式(1)計算行波介電電泳力并不合適,因為常規的介電電泳所用交變電場的頻率和相位是固定值,然而行波介電電泳的相位不固定,需使用更為復雜的計算方法。
最早開展這方面研究的是Masuda研究小組,他們于1980年代后期報道了在同步移動電場的作用下可以實現細胞與電場一起運動[61]。Fuhr及其合作者發展了他們的工作,研究了twDEP與電旋轉原理上的相似性,并提出了“異步”行波介電電泳的概念和具體實施方案[62]。目前,已有多種電極形狀和尺寸不同的行波介電電泳芯片被設計出來[63,64]。如圖9所示,圖中電極寬度與間距均為20 μm,電極與流動方向平行,在不同電極上施加不同相位(相位相差90°)的信號產生twDEP力,不同細胞或顆粒在twDEP作用下的側向運動速度存在差別,最終,在twDEP作用下使顆粒產生垂直于流動方向的運動,達到很好的空間效果[33]。行波介電電泳芯片對于信號要求較高,且電極分布需合理,理論較常規介電電泳較為復雜,但對于多種(大于兩種)細胞或者微粒的具有較為明顯的優勢,分離精度較高。
在分離操作中,外加電場信號是介電電泳分離活動的核心因素,是分離活動成功與否的關鍵,因此,針對不同的芯片結構,不同的分離目標以及對分離速度要求等因素的考慮,選擇合適的電場信號,能夠有效地提高分離效率。此外,除了外加信號的不同以外,流體的流動作用不可忽視,流體流動除了能推動細胞向分離區域流動外,還可改變細胞與電極之間的相對位置,對分離過程影響很大。單純依靠電場DEP作用只能在小范圍內對細胞進行操縱,想要分離過程滿足高通量和高效率,引入其它物理場是常采用的技術手段。現階段大多數研究人員認為多物理場之間是互不影響的,但事實卻并非如此。
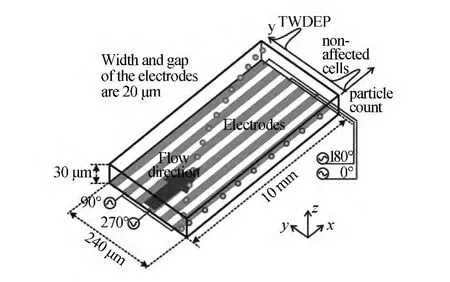
圖9 行波介電電泳分離細胞微流控芯片[33]Fig.9 Traveling wave dielectrophoresis(TWDEP)microfluidic chip[33]
4 結論和展望
自從1991年英國學者Pethig利用交流電場將細胞從液體中成功分離以來,使用介電電泳分離細胞已經開展了20余年的研究[8]。隨著微加工技術的發展,介電電泳和微流控芯片攜手,使細胞分離進入了微觀時代。在這期間,介電電泳理論得到長足的發展,新的細胞分離模型不斷出現,各種結構的微流控細胞分離芯片被報道出來,從最開始的單一非均勻電場到后來的多物理場相結合,每一次創新都是對該領域的重大貢獻。
基于介電電泳的細胞分離微流控芯片在未來的發展將著重于以下五方面:(1)在理論和仿真研究中,各種模型的建立還有待進一步完善。此處的模型不僅是指細胞模型,而且還有多物理場耦合時互相影響的模型。(2)分離過程的高精度和高效率。更多不同結構和不同分離方法的微流控芯片是有效的手段。(3)拓展介電電泳分離的應用范圍。可以對其它的些粒子進行分離,如礦物質粒子、膠體粒子等,而且對于粒子的形態也可以廣泛化,除了固態粒子,液態粒子也可以考慮作為分離對象之一;此外,分離尺寸從微米粒子到納米粒子都可以作為適用范圍。(4)芯片上多功能集成。實驗時需要在芯片上集成多種檢測分析方法,實時準確地觀察和分析細胞分離的進程;為了排除細胞懸液中其它物質的影響或者實現實驗細胞的富集,需要集成樣品前處理模塊;為了實現細胞的分析和再利用,需要集成細胞分離后的培養等模塊。(5)實驗系統的小型化、自動化。現階段實驗經常使用高倍數顯微鏡配置成像系統進行實驗觀察,新的顯微成像方法如無鏡頭陰影成像技術[65]等可以用于實驗,體積和造價均遠低于前者;分離之后統計的方法也有待進一步完善,現在的方法比較原始,采取顯微鏡視野下的人工計數得到結果,在今后的實驗中可以考慮引入圖像處理的方法進行細胞計數,效率更高,自動化程度更高。此外,在有些方面還需要進行改進,如分離后細胞的存活率分析[66]等。
基于介電電泳的細胞分離微流控芯片的發展與數學、物理、生物、分析化學、微加工技術的研究緊密相關。一方面,細胞分離微流控芯片的設計和制作,以微加工技術,數值模擬技術,生物標志和化學分析為基礎;另一方面,對基于介電電泳的細胞分離微流控芯片的研究,進一步推動微加工技術的發展,特別是芯片上細胞的操縱技術的發展,將對生物、分析化學技術的長足發展貢獻一份力量。隨著微流控技術的快速發展,相信在不遠的將來,高精度、高通量、高效率、多功能、便攜式、經濟實用的細胞分離微流控芯片將在生物、醫學、農業等領域得到廣泛應用。
1 Jinhee J,Seo S K,Joo Y D,Han K H.Sens.Actuators B,2011,157(1):314-320
2 Yuta N,Sakiko H,Takashi Y.Sen.Actuators B,2009,145(1):561-569
3 dela R C,Tilley P A,Fox J D,Kaler K V.IEEE TBiomed.Eng,2008,55(10):2426-2432
4 Moon H S,Nam Y W,Park J C,Jung H I.Environ.Sci.Technol,2009,43(15):5857 -5863
5 Chow K S,Du H J.Sens.Actuators A,2011,170(1-2):24 -31
6 Lackowski M,Krupa,Butrymowicz D.J.Electrostat.,2013,71(5):921 -925
7 Bert T,Smet H D.Displays,2003,24(4-5):223-230
8 Pohl H A.Dielectrophoresis,1978
9 Kadaksham J,Singh P,Aubry N.Mech.Res.Commun.,2006,33(1):108 -122
10 Deng Y L,Chang J S,Juang Y J.Bioresource.Technol.,2013,135:137 -141
11 Tomoyuki Y,Masato S,Hitoshi S,Tomokazu M .Sens.Actuators B,2009,142(1):400-403
12 Demierre N,Braschler T,Muller R,Renaud P.Sens.Actuators B,2008,132(2):388-396
13 FANG Zhao-Lun.Production and Application of Microfluidic Chip.Beijing:Chemical Industry Press,2005:102方肇倫.微流控分析芯片的制作及應用.北京:化學工業出版社,2005:102
14 LIU Shun-Dong,ZHANG Hong-Yan,SHEN Ping,CUI Hai-Hang.Micronanoelectronic Technology,2012,49(4):268-279劉順東,張鴻雁,沈 萍,崔海航.微納電子技術,2012,49(4):268-279
15 Cao J,Cheng P,Hong F J.Sci.China.Technol.SC,2009,52(12):3477 -3490
16 Robert B.Sensor.Rev,2013,33(4):300-304
17 Chen H Y,Liu Y,Zhang H T,Yu L,Zhu Yl,Li D.Chinese J.Chem.Eng.,2010,18(6):1034-1037
18 Lewpiriyawong N,Kandaswamy K,Yang C,Ivanov V,Stocker R.Anal.Chem.,2011,83(24):9579-9585
19 Chen C H,Tsai S L,Jang L S.Sens.Actuators B,2009,142(1):369-376
20 Cifra M,Fields J Z,Farhadi A.Prog.Biophys.Mol.Bio,2011,105(3):223-246
21 Hamada R,Takayama H,Shonishi Y,Mao L,Nakano M,Suehiro J.Sens.Actuators B,2013,181:439-445
22 Markx G H,Talary M S,Pethig R.J.Biotechnol,1994,32(1):29-37
23 Hughes M P,Morgan H,Rixon F J.BBA-Gen.Subjects,2002,1571(1):1 -8
24 Ravi P,Karan V K.Sens.Actuators B,2012,169(5):274-283
25 Wei C H,Wei T Y,Liang C H,Tai F C.Diam.Relat.Mater,2009,18(2-3):332-336
26 Wei C H,Wei T Y,Tai F C.Diam.Relat.Mater,2010,19(5-6):573-577
27 YIN Zhi-Wen.Dielectric Physics.Beijing:Science Press,2003:96殷之文.電介質物理學.北京:科學出版社,2003:96
28 Sun L N,Liu D L,Chen L G.Procedia.Eng.,2011,15:336-340
29 Cao J,Cheng P,Hong F J.J.Electrostat.,2008,66(11-12):620 -626
30 Pham P,Texier I,Larrea A S,Blanc R,Revol C F,Grateau H,Perraut F.J.Electrostat.,2007,65(8):511 -520
31 Song B Y,Liu D L,Sun L N,Chen L G.Procedia.Eng.,2011,15:341-345
32 Tomoyuki Y,Junko Y,Hitoshi S,Fumio M,Tomokazu M.Sens.Actuators B,2013,186:9-16
33 Sander D,Vivek R,Dietmar P E,Wojciech W,Michael J V.Sens.Actuators B,2012,170:207-214
34 Cen E G,Dalton C,Li Y,Adamia S,Pilarski L M,Kaler K V.J.Microbiol.Meth.,2004,58(3):387-401
35 Nuttawut L,Chun Y,Yee Ch L.Microfluid.Nanofluid,2012,12(5):723-733
36 Saar G,David E,Uri D.Sensors Actuators A,2008,142(1):138-146
37 Chin H K,Yee C L,Chun Y,Kamal Y T,Isabel R.J.Electrostat.,2008,66(9-10):514 -525
38 Wang X B,Yang J,Huang Y,Jody V,Frederick F B,Peter R C .Anal.Chem.,2000,72(4):832-839
39 Huang Y,Wang X B,Becker F F,Gascoyne P R.Biophys.J.,1997,73(2):1118-1129
40 Zhu J J,Robert C C,Gyunay K,Pallavi V,Tzeng T R,Xuan X C.Microfluid.Nanofluid,2011,11(6):743-752
41 ZENG Xue,XU Yi,CAO Qiang,HAO Dun-Ling,WU Yong-Jie.Micronanoelectronic.Technology,2009,46(1):34 - 40曾 雪,徐 溢,曹強,郝敦玲,吳永杰.微納電子技術,2009,46(1):34-40
42 Yang M,Zhang X.Sens.Actuators A,2007,135(1):73-79
43 Chin H K,Yee C L,Yang C,Kamal Y T,Isabel R.J.Electrostat.,2008,66(9-10):514 -525
44 Gascoyne P R,Vykoukal J V.IEEE.Inst.Electr.Electron.Eng.,2004,92(1):22 -42
45 Ho C T,Lin R Z,Chang W Y,Chang H Y,Liu C H.Lab Chip,2006,6(6):724-734
46 Wang L,Flanagan L,Lee A P.J.Microelectromech.S,2007,16(2):454-461
47 Hywel M,Alberto G I,David B,Nicolas G G,Antonio R.J.Phys.D.Appl.Phys.,2001,34(2708):1553 -1561
48 Masashi Y,Tomoyuki Y,Masato S,Satoshi K,Hitoshi S,Tomokazu M,Fumio M.Electrochim.Acta,2012,82:35-42
49 Hunt T P,Issadore D,Westervelt R M.Lab Chip,2008,8(1):81-87
50 Iliescu C,Xu G,Loe F C,Ong P L,Tay F E.Electrophoresis,2007,28(7):1107-1114
51 Hoettges K F,Hughes M P,Cotton A,Hopkins N A E,McDonnell M B.IEEE Proc.Nanobiotechnol.,2003,22(6):68-74
52 Malnar B,Malyan B,Balachandran W,Cecelja F.IEEE Proc.Nanobiotechnol.,2003,150(2):66 -9
53 Gonzalez C F.Doctor Paper,July 10,2007
54 Pethig R,Talary M S,Lee R S.IEEE Proc.Nanobiotechnol.,2003,22(6):43- 50
55 Blanca H,Blake A S,Eric B C,Yolanda F.Anal.Chem.,2004,76(6):1571-1579
56 Cummings E B.IEEE Proc.Nanobiotechnol.,2003,22(6):75 -84
57 Ciprian I,Yu L M,Francis E H,Chen B T.Sens.Actuators B,2008,129(1):491-496
58 WEI Qing-Hua,HUANG Zhong-Ren,LU Jin-Tu,HAN Wen-Xiang,XU You-Ming.Polymer Annual Conference Papers,2006魏慶華,黃忠仁,呂金涂,韓文祥,徐佑銘.高分子年會會議論文,2006
59 Doh I,Cho Y H.Sensors.Actuat.A,2005,121(1):59 -65
60 Hagedorn R,Fuhr G,Müller T,Gimsa J.Electrophoresis,1992,13(1-2):49-54
61 Masuda S,Washizu M,Iwadare M.IEEE Trans.Ind.Appl,1988,23:474- 480
62 Fuhr G,Fiedler S,Muller T.Sens.Actuators A,1994,41:230-239
63 Morgan H,Green N G,Hughes M P,Monaghan W.J.Micromech.Microeng,1997,7:65-70
64 Wang X B,Huang Y,Becker F F.IEEE Ias.Trans,1997,33:660 -669
65 Jin G,Yoo I H,Pack S P,Yang J W,Ha U H,Paek S H,Seo S.Biosens.Bioelectron.,2012,38(1):126-131
66 Alazzam A,Stiharu,Bhat R,Meguerditchian A N.Electrophoresis,2011,32(11):1327-1336

