高相對分子質量多環芳烴的生物共代謝降解
李 政, 顧貴洲, 趙朝成, 趙東風, 楊 磊
(1. 遼寧石油化工大學 化學化工與環境學部, 遼寧 撫順 113001; 2. 中國石油大學 化學工程學院, 山東 青島 266555)
高相對分子質量多環芳烴的生物共代謝降解
李 政1, 顧貴洲1, 趙朝成2, 趙東風2, 楊 磊1
(1. 遼寧石油化工大學 化學化工與環境學部, 遼寧 撫順 113001; 2. 中國石油大學 化學工程學院, 山東 青島 266555)
為了研究高相對分子質量多環芳烴(PAHs)芘的生物共代謝降解,考察了低相對分子質量PAHs芴和菲的加入對芘產生的影響,并采用GC-MS測定了生物降解后代謝產物的組成。結果表明,單一PAHs的生物降解中,芴在培養的第5 d已被完全降解,生成5種代謝產物,菲在第7 d降解率達到98.93%,生成10種代謝產物,芘在第9 d時降解率僅為65.73%,生成較多代謝產物,其中6種可基本定性; 3種PAHs混合降解時,芴、菲和芘分別在第3 d、5 d和8 d完全被除去,共產生8種代謝產物,其中芘在第8 d時只產生了3種代謝產物。芴和菲的存在不僅促進了芘的完全快速降解,而且能夠促進芘代謝產物的去除,芘的存在也促進了芴和菲的降解和代謝產物的去除。
多環芳烴;共代謝;生物降解
多環芳烴(Polycyclic aromatic hydrocarbons,PAHs)是由2個或2個以上芳香環稠合在一起的一類化合物[1],主要來源于石油污染、油輪泄漏、汽車尾氣,以及煤、石油等天然燃料的不完全燃燒等。由于部分PAHs對生物具有“三致”作用,美國環境保護署將其中16種確定為優先控制的有機污染物[2]。PAHs在環境中的去除途徑包括揮發、光氧化、化學氧化、生物積累、土壤吸附、浸濾作用、微生物降解等,其中,微生物降解占有重要地位[3]。PAHs的微生物降解有2種方式[4]。一是4個苯環以下的低相對分子質量PAHs被作為唯一的碳源和能源而完全礦化;二是4個苯環及以上高相對分子質量PAHs被微生物以共代謝的方式降解[5]。所謂的共代謝作用,就是在外加碳源情況下,難生物降解污染物有可能被微生物轉化,甚至完全降解[6]。共代謝作用由微生物細胞分泌的關鍵酶決定,與被降解底物的結構有著密切關系[7]。為了提高目標污染物降解性能,投加它的類似物,利用類似物誘導細胞酶的產生,提高酶活性,促進目標污染物的降解[8]。近年來,為了有效提高PAHs的降解,共代謝被廣泛應用在PAHs污染的生物修復中,共代謝機理的研究逐漸成為目前PAHs降解研究的熱點之一。但由于共代謝過程涉及到許多因素以及因素間的相互作用[6],其相關研究并不深入,有些解釋還是假設性質的,有待于進一步探索。筆者通過考察低相對分子質量PAHs芴和菲的加入對高相對分子質量PAHs芘產生的影響,運用GC-MS測定單一PAHs生物降解和混合PAHs降解的降解速率和代謝產物組成的變化,來研究高相對分子質量PAHs的生物共代謝降解過程,為共代謝機理的研究提供參考。
1 實驗部分
1.1 材料和試劑
1.1.1 試劑
芴、菲、芘(質量分數98.7%),美國Supelco公司產品;磷酸氫二鈉(Na2HPO4)、磷酸二氫鉀(KH2PO4)、硝酸鈉(NaNO3)、硫酸鎂(MgSO4)、氯化鈣(CaCl2)、硫酸亞鐵(FeSO4)、無水硫酸鈉、丙酮、環己烷,均為分析純,國藥集團化學試劑有限公司產品;酵母粉,國藥集團化學試劑有限公司產品。
1.1.2 無機鹽培養基(MSM)
分別將0.6 g Na2HPO4、0.2 g KH2PO4、4.0 g NaNO3、0.3 g MgSO4、0.01 g CaCl2、0.01 g FeSO4和0.5 g 酵母粉按順序逐一溶解,用蒸餾水定容至1000 mL。
1.1.3 菌源
從新疆克拉瑪依油田黑油山公園的油泥中分離得到一組石油降解菌群。該菌群包含12株可分離培養的單菌,來自假單胞菌屬(Pseudomonassp.)、動桿菌屬(Acinetobactersp.)、節桿菌屬(Arthrobactersp.)、紅球菌屬(Rhodococcussp.)、芽孢桿菌屬(Bacillussp.)和蒼白桿菌屬(Ochrobactrumsp.)6個不同的菌屬。在無菌條件下制備石油降解菌群的菌懸液,最終使液體中菌含量為1.0×108CFU/mL。
1.2 單一PAHs的降解
取10 mg芴完全溶解于丙酮中,加入100 mL已滅菌的MSM,最終使芴質量濃度為100 mg/L。置于搖床中過夜使丙酮揮發完全,接種1%(體積分數)菌懸液,然后于30℃、轉速160 r/min的搖床中避光振蕩培養,在第3、5、7、9 d分別取樣測定。試驗設3個平行樣品,同時設不接種菌懸液的對照樣品。菲和芘的降解方法同上。
1.3 混合PAHs的降解
分別取10 mg芴、菲、芘完全溶解于丙酮中,加入100 mL已滅菌的MSM,最終使混合PAHs中每種PAHs質量濃度為100 mg/L,具體降解方法同1.2節。
1.4 降解菌降解多環芳烴的紫外光度分析
待測樣品經10000 r/min轉速離心除去菌體,用環己烷萃取上清液中的多環芳烴。萃取3遍,合并萃取液,并用無水硫酸鈉脫水,定容至10 mL。用紫外分光光度計測其吸光度。從標準曲線得到降解后芴、菲、芘的質量濃度。
1.5 降解菌降解PAHs的中間代謝產物分析
采用Agilent5975氣相色譜-質譜聯用儀分析PAHs降解中間產物。色譜儀進樣口溫度290℃;接口溫度290℃;色譜柱DB-5(30 m×0.25 mm×0.25 μm); 60℃保持2 min,以6℃/min升到270℃,保持20 min;氦氣作載氣,流速1.10 mL/min,壓力65.2 kPa;不分流進樣。質譜儀離子源溫度為200℃,溶劑延遲時間6 min,檢測器電壓1 kV,電子轟擊源(EI),電離電壓70 eV。
2 結果與討論
2.1 單一多環芳烴的生物降解率和降解產物
2.1.1 單一多環芳烴的生物降解率
對降解菌分別降解質量濃度為100 mg/L的芴、菲和芘進行了紫外光度法分析,其降解率隨培養時間的變化示于圖1。由圖1可以看出,降解菌對芴的降解效果最好,降解率也最高,在培養的第5 d,芴已經被完全降解(降解率為100%);對菲的降解效果也很好,在第7 d降解率達到98.93%;對芘的降解效果最差,第9 d時降解率僅為65.73%。由此可見,隨著PAHs苯環數的增加,降解菌對其降解效率逐漸下降,這主要是因為高相對分子質量PAHs分子結構復雜,穩定性高,疏水性強,水溶性低,生物可利用性低,對微生物的毒性大,難以被微生物利用。
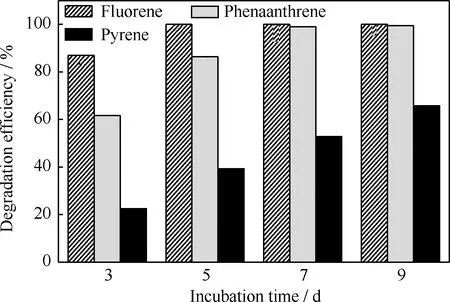
圖1 微生物降解單一多環芳烴的降解率隨培養時間的變化
2.1.2 芴的微生物降解產物
芴降解中間產物的GC-MS總離子流色譜如圖2所示。經質譜數據系統檢索并結合人工譜圖解析,對相對豐度較高并且能夠基本定性的色譜峰進行了鑒定。由圖2可知,芴降解后產生5種可基本確定的代謝物。峰2為9-芴酮(9-Fluorenone),峰3、4和5的保留時間不同,但是具有相同的質譜離子(質荷比為254、239、165、73),說明是羥基取代位置不同的單羥基芴[9],分別為9-羥基芴(9- Hydroxy fluorene)、1-羥基芴(1- Hydroxy fluorene)和3-羥基芴(3- Hydroxy fluorene)。峰6是4-羥基-9-芴酮(4- Hydroxy-9- fluorenone)。
2.1.3 菲的微生物降解產物
菲降解中間產物的GC-MS總離子流色譜如圖3所示。由圖3可知,菲降解后產生10種可基本確定的代謝物,有峰1的水楊酸(Salicylic acid)、峰2的鄰苯二甲酸(Phthalic acid)、峰3的二羥基萘(Dihydroxynaphthalene)、峰5的1-羥基-2-萘酸(1- Hydroxy-2- naphthalene)、峰6的7, 8-苯并香豆素(7, 8- Benzo coumarin)。此外,峰7、8分別鑒定為3-羥基菲(3-Hydroxyphenanthrene)和1-羥基菲(1-Hydroxyphenanthrene),峰9(Dihydroxyphenanthrene)、峰10(DihydroxyphenanthreneⅡ)和峰11(Dihydroxyphenanthrene Ⅲ)是羥基取代位置不同的二羥基菲(保留時間不同,但是有相同的質荷比354、339、266、236、73)[10]。

圖2 芴降解中間產物GC-MS總離子流色譜圖

圖3 菲降解中間產物GC-MS總離子流色譜圖
2.1.4 芘的微生物降解產物分析及其代謝途徑的推導
芘降解中間產物的GC-MS總離子流色譜圖如圖4所示。由圖4可知,芘降解后產生較多代謝物,有6種可基本定性。峰2和峰3分別確定為4-羥基菲(4-Hydroxyphenanthrene)和4-菲羧酸(4- Phenanthrene carboxylic acid),峰4為1-羥基芘(1-Hydroxypyrene),峰5為3, 4-二羥基菲(DihydroxyphenanthreneⅠ)。此外,存在2種羥基取代位置不同的二羥基芘(保留時間不同,但質荷比相同378、290、260、73)[11-13],即峰6(DihydroxypyreneⅠ)和峰7(DihydroxypyreneⅡ)。

圖4 芘降解中間產物GC-MS總離子流色譜圖
2.2 混合多環芳烴的共代謝降解
混合PAHs中每種組分的降解效果如圖5所示。由圖5可知,經過8 d的培養,3種PAHs均得到完全的降解,其中芴在第3 d時就已經完全去除,菲在第5 d時得到全部降解,較單一芴和單一菲為底物時降解效果更優(見圖1)。同時,芴和菲的存在促進了芘的降解,在培養的第8 d已經得到完全去除,而單一芘為底物時在培養的第9 d降解率僅為65.73%(見圖1)。可見,容易被微生物利用的芴和菲促進了難降解芘的共代謝降解,增強了降解菌降解芘的能力,同時芴和菲的降解也沒有因為芘的存在受到負面影響。
混合PAHs降解中間產物的GC-MS總離子流色譜圖如圖6所示。由圖6可知,混合PAHs降解后產生8種可基本確定的代謝物。其中峰5的4-羥基-9-芴酮(4- Hydroxy -9- fluorenone)為芴的代謝產物,峰1的水楊酸(Salicylic acid)、峰2的鄰苯二甲酸(Phthalic acid)、峰3的1-羥基-2-萘酸(1- Hydroxy -2- naphthalene acid)和峰7的二羥基菲Ⅱ(DihydroxyphenanthreneⅡ)在單一菲的降解產物中存在,峰6的二羥基菲Ⅰ(DihydroxyphenanthreneⅠ)在單一菲和單一芘的代謝產物中均出現過,峰4的4-羥基菲(4-Hydroxyphenanthrene)和峰8的二羥基芘(DihydroxypyreneⅡ)在單一芘的降解產物中存在。而當芴、菲和芘單獨降解時,分別產生5種、10種和6種代謝物,可見,3種PAHs混合降解有利于代謝產物的去除。

圖5 混合PAHs中每種PAHs的降解率隨培養時間的變化

圖6 混合多環芳烴降解中間產物的GC-MS總離子流色譜圖
為進一步考察芴和菲的存在對芘降解產生的影響,將芘單獨降解的代謝產物與混合降解時產生的代謝產物峰面積進行對比,結果示于圖7。由圖7可知,當芘單獨降解時,經過9 d的培養檢測到6種代謝產物,包括初始氧化產物(二羥基芘Ⅰ、二羥基芘Ⅱ和1-羥基芘)和環裂解產物(4-菲羧酸和4-羥基菲),其中初始氧化產物含量較大;而當芴和菲存在時,芘在第8 d時只產生了3種代謝產物,初始氧化產物二羥基芘Ⅰ和1-羥基芘已經檢測不到,二羥基芘Ⅱ峰面積減少,環裂解產物4-羥基芘峰面積有所增加。微生物利用不同的碳源作為生長基質共代謝芘時會誘導出不同的酶系[14],因此,芴和菲的加入有可能誘導出新的降解芘及其代謝產物的酶系。此外,芴和菲較容易被微生物利用,能支持降解菌的快速增殖,從而分泌更多的降解酶來促進芘和芘的代謝產物的降解,通過增大生物量來促進難降解物的轉化[15]。總之,芴和菲的存在不僅促進了芘的完全快速降解,而且能夠促進芘代謝產物的去除,并且芘的存在也促進了芴和菲的降解和代謝產物的去除。

圖7 芘單獨降解9 d與混合降解8 d時降解中間產物峰面積對比
3 結 論
(1) 單一多環芳烴的生物降解中,芴的降解效果最好,降解率也最高,在培養的第5 d,芴已經被完全降解,有5種代謝產物生成;菲的降解效果也很好,在第7 d降解率達到98.93%,生成10種代謝產物;芘的降解效果最差,第9 d時降解率僅為65.73%,代謝產物較多,其中6種可基本定性。由此可見,隨著苯環數的增加,多環芳烴的降解效果逐漸下降,代謝產物逐漸增多。
(2) 3種多環芳烴混合降解時,芴、菲和芘分別在第3 d、5 d和8 d得到完全的去除,共產生8種代謝產物,其中芘在第8 d時只產生了3種代謝產物。可見,芴和菲的存在不僅促進了芘的完全快速降解,而且能夠促進芘代謝產物的去除,并且芘的存在也促進了芴和菲的降解,以及代謝產物的去除。
[1] BAMFORTH S M, SINGLETON I. Bioremediation of polycyclic aromatic hydrocarbons: Current knowledge and future directions[J]. Journal Chemical Technology Biotechnology, 2005, 80(7): 723-736.
[2] KEITH L H, TELLIARD W A. Priority pollutants I—A perspective view[J]. Environmental Science and Technology, 1979, 13: 416-423.
[3] 張金麗, 鄭天凌. 多環芳烴污染環境的控制與生物修復研究進展[J]. 福建環境, 2002, 19(2): 26-29. (ZHANG Jinli, ZHENG Tianling. The pollution control of polycyclic aromatic hydrocarbons and the research prospect of bioremediation[J]. Fujian Environment, 2002, 19(2): 26-29.)
[4] 于秀艷, 丁永生. 多環芳烴的環境分布及其生物修復研究進展[J]. 大連海事大學學報, 2004, 30(4): 55-59. (YU Xiuyan, DING Yongsheng. Advances of studies on the environmental distribution of polycyclic aromatic hydrocarbons and its bioremediation[J]. Journal of Dalian Maritime University, 2004, 30(4): 55-59.)
[5] JUHASZ A, NAIDU R. Bioremediation of high molecular weight polycyclic aromatic hydrocarbons: A review of the microbial degradation of benzo[a]pyrene[J]. International Biodeterioration & Biodegradation, 2000, 45: 57-88.
[6] 羅瑋. 難降解污染物微生物共代謝作用研究進展[J]. 土壤通報, 2012, 43(6): 1515-1521. (LUO Wei. Progress on co-metabolism of biorefractory pollutants[J]. Chinese Journal of Soil Science, 2012, 43(6): 1515-1521.)
[7] 錢忠寧, 張騰江, 楊賡. 難降解廢水生物處理中的共代謝作用[J]. 福建環境, 2003, 20(5): 37-39. (QIAN Zhongning, ZHANG Tengjiang, YANG Geng. Cometabolism on biodegradation of refractory wastewater[J]. Fujian Environment, 2003, 20(5): 37-39.)
[8] MCNALLY D L, MIHELCIC J R, LUEKING D R. Biodegradation of mixtures of polycyclic aromatic hydrocarbons under aerobic and nitrate-reducing conditions[J]. Chemosphere, 1999, 38(6): 1313-1321.
[9] LUAN T G, FANG S H, ZHONG Y, et al. Determination of hydroxy metabolites of polycyclic aromatic hydrocarbons by fully automated solid-phase microextraction[J]. Journal of Chromatography A, 2007, 1173: 37-43.
[10] CAJTHAMLA T, ERBANOVA P,AEK V, et al. Breakdown products on metabolic pathway of degradation of benz[a]anthracene by a ligninolytic fungus[J]. Chemosphere, 2006, 64(4): 560-564.
[11] HRITKAMP M A, FREEMAN J P, MILLER D W, et al. Pyrene degradation by aMycobacteriumsp.: Identification of ring oxidation and ring fission products[J]. Applied and Environmental Microbiology, 1988, 54(10): 2556-2565.
[13] REHMANN K, NOLL H P, STEINBERG C E W, et al. Pyrene degradation byMycobacteriumsp. strain KR2[J]. Chemosphere, 1998, 36(14): 2977-2992.
[14] KRIVOBOK S, KUONY S, MEYER C, et al. Identification of pyrene-induced proteins inMycobacteriumsp. strain 6PY1: Evidence for two ring-hydroxylating dioxygenases[J]. Journal of Bacteriology, 2003, 185(13): 3828-3841.
[15] GUHA S, PETERS C A, JAFFé P R. Multisubstrate biodegradation kinetics of naphthalene, phenanthrene, and pyrene mixtures[J]. Biotechnology and Bioengineering, 1999, 65(5): 491-499.
Co-Metabolism Biodegradation of Polycyclic Aromatic Hydrocarbons With High Relative Molecular Mass
LI Zheng1, GU Guizhou1, ZHAO Chaocheng2, ZHAO Dongfeng2, YANG Lei1
(1.CollegeofChemistry,ChemicalEngineeringandEnvironmentalEngineering,LiaoningShihuaUniversity,Fushun113001,China;2.CollegeofChemicalEngineering,ChinaUniversityofPetroleum,Qingdao266555,China)
In order to study the co-metabolism biodegradation of the polycyclic aromatic hydrocarbons (PAHs) with high relative molecular mass, an influence of the addition of fluorene and phenanthrene, the PAHs with low relative molecular mass, on pyrene biodegradation was investigated and the composition of the biodegradation metabolites was determined by GC-MS. The results showed that in the biodegradation of single PAHs, fluorene was completely degraded throughout 5 d incubation to generate five metabolites, the degradation rate of phenanthrene reached 98.93% to generate ten metainbolites after 7 d incubation and only 65.73% of pyrene was degraded throughout 9 d incubation to generate more metabolites, six of which could be qualitative. In the degradation of mixture of fluorene, phenanthrene and pyrene, they were completely removed after 3 d, 5 d and 8 d incubation, respectively, and a total of eight metabolites were produced, and only three metabolites were produced from pyrene after 8 d incubation. Therefore, fluorene and phenanthrene not only promoted the degradation of pyrene rapidly and completely, but also promoted the removal of the metabolites of pyrene, meanwhile, the presence of pyrene also contributed to the degradation of fluorene and phenanthrene and the removal of their metabolites.
polycyclic aromatic hydrocarbons; co-metabolism; biodegradation
2014-02-18
遼寧省教育廳科學研究項目(L2014148)資助
李政,女,講師,博士,從事石油污染土壤生物修復方面的研究;Tel: 024-53847679;E-mail: lizheng.zz@163.com
1001-8719(2015)03-0720-06
X172
A
10.3969/j.issn.1001-8719.2015.03.016

