注射用氟尿嘧啶對晚期胃癌患者亞甲基四氫葉酸還原酶、谷胱甘肽硫轉移酶及腫瘤標志物的影響
陳庭富,嚴琦敏
(1.中國人民解放軍第63870部隊醫院 消化內科,陜西 華陰 714200;2.中國人民解放軍第323部隊醫院內科,陜西 西安 710000)
?
注射用氟尿嘧啶對晚期胃癌患者亞甲基四氫葉酸還原酶、谷胱甘肽硫轉移酶及腫瘤標志物的影響
陳庭富1,嚴琦敏2
(1.中國人民解放軍第63870部隊醫院 消化內科,陜西 華陰 714200;2.中國人民解放軍第323部隊醫院內科,陜西 西安 710000)
目的 探討注射用氟尿嘧啶對晚期胃癌患者亞甲基四氫葉酸還原酶(methylene tetrahydrofolate reductase,MTHFR),谷胱甘肽硫轉移酶(glutathione S-transferase,GST)及腫瘤標志物的影響。方法 選取中國人民解放軍第63870部隊醫院2013年8月~2014年8月確診為晚期胃癌的患者48例,根據隨機數字表法隨機分為2組:對照組(n=24)予卡培他濱為基礎的化療方案;實驗組(n=24)予注射用氟尿嘧啶為基礎的化療方案。觀察2組患者血清中MTHFR濃度、GST水平及患者腫瘤標志物(糖類抗原199、癌胚抗原、甲胎蛋白)水平,進而對注射用氟尿嘧啶的療效機制進行分析。結果 與對照組相比,實驗組患者血清中亞甲基四氫葉酸還原酶濃度較高(P<0.05),谷胱甘肽硫轉移酶活性較低(P<0.05),腫瘤標志物水平降低(P<0.05),臨床癥狀改善的總有效率較高[16(66.67)vs.22(91.67),χ2=4.55,P<0.05],不良反應發生率較低[14(58.33)vs.6(25.00),χ2=5.49,P<0.05]。結論 注射用氟尿嘧啶化療方案能夠升高血清中MTHFR濃度,降低GST活性,臨床療效明顯、不良反應少、對治療晚期胃癌具有重要意義。
注射用氟尿嘧啶;晚期胃癌;亞甲基四氫葉酸還原酶;谷胱甘肽硫轉移酶;腫瘤標志物
胃癌的發生是一個由多因素參與的復雜過程,與生活環境、飲食、幽門螺旋桿菌感染等密切相關。胃黏膜上皮細胞的增殖和凋亡保持動態平衡,這種平衡一旦被破壞,胃黏膜上皮細胞就會過度增殖但又無法啟動凋亡,久而久之便會進展為胃癌[1]。氟尿嘧啶屬于5-FU的衍生物,是尿嘧啶的氟化類似物5-FU 是一種抗代謝藥物,它對很多實體腫瘤有較好活性。5-FU 抗腫瘤活性是通過干擾DNA 合成和mRNA 翻譯來實現的[2],其進入人體后可選擇性地在腫瘤組織激活,具有靶向性的治療作用,5-氟尿嘧啶(5-FU)是治療胃癌的基礎藥物。有研究證實[3],以氟尿嘧啶為基礎藥物治療晚期胃癌時,療效較好,不良反應也較少。
有研究表明[4],亞甲基四氫葉酸還原酶(methylene tetrahydrofolate reductase,MTHFR)及谷胱甘肽硫轉移酶(glutathione S transferase,GST)與晚期胃癌患者的腫瘤標志物密切相關。臨床上根據腫瘤標志物是否下降可以評判當時治療方法是否有效[5],病灶被控制時腫瘤標志物下降至正常或維持在較低水平,腫瘤標志物短暫下降后又上升代表病情進展。目前關于注射用氟尿嘧啶治療晚期胃癌患者對MTHFR、GST及腫瘤標志物影響的相關研究較少。本文通過觀察注射用氟尿嘧啶治療晚期胃癌患者對MTHFR、GST及腫瘤標志物的影響,探究注射用氟尿嘧啶治療晚期胃癌的機制。
1 資料與方法
1.1 一般資料 收集中國人民解放軍第63870部隊醫院2013年8月~2014年8月確診為晚期胃癌的患者48例,按照隨機數字法將患者隨機分為實驗組和對照組。實驗組24例,年齡40~75歲,平均年齡(62.25±7.54)歲,男性11例,女性13例;病程1~5年,平均(3.16±0.59)年。對照組24例,年齡40~75歲,平均年齡(63.06±7.72)歲,男性11例,女性13例;病程1~5年,平均(3.23±0.62)年。本實驗獲得患者知情同意,并得到本院倫理委員會批準,批準日期為2013年7月26日。納入標準:①診斷根據胃腸道癌前病變和癌的WHO診斷新標準關于晚期胃癌的診斷標準[6]:具有上腹疼痛、食少納差、體質量減輕等臨床癥狀,并經內鏡檢查加活檢證實為胃癌晚期;②年齡在45~70歲之間;③治療前1個月內未進行系統的化療治療;④愿意接受以氟尿嘧啶為基礎的化療方案治療;⑤生存時間預計在3個月以上。排除標準:①伴有嚴重的肝功能、腎功能不全;②患者或家屬拒絕參與本實驗;③伴有心衰、嚴重高血壓、呼吸衰竭及血液系統疾病等嚴重的原發疾病;④伴有精神疾病,無法配合的患者;⑤年齡小于40歲或大于75歲;⑥伴有嚴重的急慢性感染。
1.2 治療方法 對照組患者以卡培他濱為基礎的化療方案進行治療,具體方案如下:卡培他濱(上海羅氏制藥有限公司,國藥準字H20073024,生產批號:20120515)1250 mg/m2,每天2次口服(早晚各1次,日總劑量為2500 mg/m2),治療2周后停藥1周,3周為1個療程。聯用多西紫杉醇(湖北華源世紀藥業有限公司,國藥準字H20083578,生產批號:20080616)75 g/m2,加入5%葡萄糖注射液500 mL,在每個療程第1天靜脈滴注1 h,每3周進行重復治療。實驗組以注射用氟尿嘧啶為基礎的化療方案進行治療,具體方案如下:注射用氟尿嘧啶(海南長安國際制藥有限公司,國藥準字H20050981,生產批號:20100817)0.5 g/d,每天1次,溶于250 mL 0.9%氯化鈉注射液中靜點,治療2周后停藥1周,3周為1個療程。聯用多西紫杉醇使用方法同對照組,服藥期間,患者每個療程結束后復查1次,共跟蹤隨訪1年。服藥期間詳細記錄服藥過程中出現的任何不良反應。2組晚期胃癌患者均在治療前、3個療程治療結束后空腹采集5 mL肘靜脈血,裝入預先裝有EDTA的抗凝采血管中。將采血管按3000 r/min離心10 min,待離心結束后將上層血清裝入EP管中,放入-80 ℃冰箱中保存備用。以上均由本院檢驗科專業人員負責操作。
1.3 觀察指標及檢測方法
1.3.1 血清中亞甲基四氫葉酸還原酶濃度的測定:本研究采用雙抗體夾心法檢測所有研究對象血清中亞甲基四氫葉酸還原酶的濃度水平。首先用人亞甲基四氫葉酸還原酶抗體免疫實驗微孔板,再分次向微孔中加入亞甲基四氫葉酸還原酶,與辣根過氧化物酶(HRP)標記的白介素抗體結合,形成抗體-抗原-酶標抗體復合物,最后加底物3′,3′,5,5′-四甲基聯苯胺(TMB)顯色。顯色后,TMB在HRP酶的催化下發生連續的顏色轉化,最后變為黃色。由于顏色深淺與標本血清中的白介素濃度呈正比例關系,用伯樂680全自動酶標儀(北京泰澤瑞達科技有限公司)測定標本的吸光度(OD值),最終通過繪制標準曲線可精確計算標品中的亞甲基四氫葉酸還原酶濃度。具體操作步驟參照試劑盒(上海經科化學科技有限公司)說明書進行。
1.3.2 血清中谷胱甘肽硫轉移酶活性的測定:參照有關文獻[7]的實驗方法,所有試劑均購于上海經科化學科技有限公司。聚體步驟如下:依次向容器中加入250 μL磷酸鹽緩沖液,25 μL谷胱甘肽硫轉移酶,適量的酶溶液及25 μL 1-氯-2,4-二硝基苯試劑,最終混合為500 μL的液體,反應從加入1-氯-2,4-二硝基苯試劑開始,在NanoDrop Lite分光光度計(賽默飛世爾科技)30 ℃保溫10 min,記錄340 nm波長下谷胱甘肽硫轉移酶與1-氯-2,4-二硝基苯結合物的生成量。在30 ℃條件下,應用1 mM谷胱甘肽硫轉移酶和1-氯-2,4-二硝基苯每分鐘催化形成1 μM S-2,4-二硝基苯谷胱甘肽為1個酶活性單位。
1.3.3 血清腫瘤標志物的測定:本研究采用雙抗體夾心酶聯免疫吸附(ELISA)法檢測所有研究對象血清中腫瘤標志物糖類抗原199(CA199)、癌胚抗原(carcino-embryonic antigen,CEA)、甲胎蛋白腫瘤標志指標的濃度水平(試劑盒由武漢博士的生物技術有限公司提供),其操作方法按照說明書嚴格操作。以上所有操作均由本院檢驗科專業人員負責操作。
1.3.4 臨床療效及不良反應的觀察:療效判定標準:顯效:入組前的病灶最大徑總和縮小≥60%以上,上腹疼痛明顯減輕,體力狀況評分明顯升高;有效:入組前的病灶最大徑總和縮小≥30%,上腹疼痛有所緩解,體力狀況評分升高;無效:入組前的病灶最大徑總和未見明顯縮小或增大,體力狀況評分無變化或降低。總有效率=(顯效例數+有效例數)/總例數×100%。詳細記錄患者服藥期間出現的任何不良反應,并及時予以對癥治療。體力狀況評分標準是由ECOG(美國東部腫瘤協作組)Karnofsky(卡氏評分,KPS)提出,并依據患者能否正常活動、病情、生活自理程度,KPS把患者的健康狀況視為總分100分,10分為1個等級[8]。

2 結果
2.1 2組患者血清中亞甲基四氫葉酸還原酶和谷胱甘肽硫轉移酶的比較 本研究顯示,治療前2組患者血清中MTHFR和GST的水平相比較,差異無統計學意義,基線可比。治療后2組患者血清中MTHFR濃度水平均比治療前升高(P<0.05),實驗組患者血清中MTHFR的濃度高于對照組(P<0.05)。治療后2組患者血清中GST活性均比治療前降低(P<0.05),且實驗組患者血清中GST的活性低于對照組(P<0.05)。見表1。
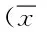
表1 2組患者血清中亞甲基四氫葉酸還原酶和谷胱甘肽硫轉移酶的比較±s)Tab.1 Comparison of MTHFR and GST between two ±s)
*P<0.05,與同組治療前比較,compared with the same group before treatment;#P<0.05,與對照組治療后比較,compared with control group after treatment
2.2 2組患者腫瘤標志物水平比較 治療前2組患者腫瘤標志物水平無明顯差異。經治療后,2組腫瘤標志物水平均降低(P<0.05),與對照組相比,實驗組CA199、CEA與AFP水平較低(P<0.05)。見表2。
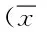
表2 2組患者腫瘤標志物水平比較±s)Tab.2 Comparison of tumor marker between two groups ±s)
*P<0.05,與同組治療前比較,compared with the same group before treatment;#P<0.05,與對照組治療后比較,compared with control group after treatment
2.3 2組患者臨床療效的比較 本研究結果顯示,經過3個療程的治療后,實驗組患者的總有效率為91.67%,對照組患者的總有效率為66.67%,實驗組總有效率明顯高于對照組(χ2=4.55,P<0.05)。見表3。

表3 2組患者臨床療效的比較[n(%)]Tab.3 Comparison of clinic effect between two groups[n(%)]
#P<0.05,與對照組比較,compared with control group
2.4 2組患者不良反應發生率的比較 本研究顯示,對照組有14例患者出現不良反應,其中腹瀉2例,胃脹3例,惡心4例,手足綜合征2例,脊髓抑制1例,其他2例;實驗組有6例患者出現不良反應,其中腹瀉3例,胃脹2例,惡心1例;對照組不良反應發生率58.33%顯著高于實驗組的25.00%(χ2=5.49,P<0.05)。
3 討論
近年來,胃癌在我國的發病率呈上升趨勢,對人們的身體健康和生活質量造成嚴重的危害。研究證實[9],化療是改善晚期胃癌患者生活質量、延長其生存時間的有效措施。目前,世界范圍內尚無關于晚期胃癌化療的標準方案。卡培他濱是5- 氟尿嘧啶的前體藥物,口服后完整地通過胃腸壁,首先經肝臟羧酸酯酶催化代謝為5’-脫氧-5- 氟胞苷,然后經肝臟和腫瘤細胞中的胞苷脫氨酶催化轉化為5’-脫氧-氟尿嘧啶,最后經胸苷磷酸化酶催化轉化為5- 氟尿嘧啶。而5- 氟尿嘧啶則直接通過不同的生化途徑產生單磷酸氟脫氧尿苷、三磷酸氟脫氧尿苷和三磷酸氟尿苷分別干擾細胞DNA 及RNA 復制合成,產生細胞毒效應,與5,10-亞甲基四氫葉酸(5,10-MTHF)和胸苷酸合成酶反應,形成穩定的共價化合物,干擾腫瘤細胞DNA的合成與修復,從而抗癌[10]。亞甲基四氫葉酸還原酶是一種還原酶,主要作用是在葉酸代謝通路中將5,10-MTHF轉化為具有生物學功能的5-MTHF,參與廣泛的DNA甲基化反應。谷胱甘肽S-轉移酶(GSTs)是在肝臟中參與生物轉化第二相反應的一種生物酶。谷胱甘肽(GSH)在肝細胞液GST 催化下,可與許多鹵代化合物和環氧化合物結合,生成含GSH 的結合產物。GSTs 與毒物包括致癌物代謝解毒有關[11]。有研究表明[12],谷胱甘肽硫轉移酶減少,抗癌藥物的降解時間將延長,可能增加抗癌藥物化療的作用時間及敏感性。
本研究結果發現,經化療后,2組患者血清中MTHFR濃度水平均比治療前升高,實驗組患者血清中MTHFR的濃度高于對照組(P<0.05);化療后2組患者血清中GST活性均比治療前降低,且實驗組患者血清中GST的活性低于對照組(P<0.05)。四氫葉酸還原酶是葉酸代謝過程中的關鍵酶,將 5,10-亞甲基四氫葉酸(5,10-methylene tetrahydrofolate,5,10-MTHF)轉變成 5-甲基四氫葉酸(5-methyltetrahydrophplate,5-MTHF),前者與DNA合成及修復過程密切相關,可影響5-FU類藥物代謝,后者為細胞內 DNA 甲基化反應提供原料,即參與蛋氨酸(methionine,Met)循環和各種基因 DNA 的甲基化[13]。MTHFR主要催化5,10-MTHF還原為具有生物學功能的5-MTHF,參與廣泛的DNA甲基化反應。如果MTHFR濃度較低,DNA甲基化過低,便會導致癌基因的高表達和修復基因的低表達,促進腫瘤的發生[14]。經化療后,2組患者血清中MTHFR濃度升高(P<0.05),促進DNA甲基化,抑制癌基因的表達,促進修復基因的表達,從而延緩胃癌的進展。與對照組比較,實驗組患者血清中MTHFR濃度升高明顯(P<0.05),由此可見,實驗組的治療效果優于對照組。谷胱甘肽硫轉移酶能夠催化使某些內源性或外來有害物質親電子基團的疏水性增加,從而加快分解排出體外。經化療后,2組患者血清中GST活性均降低(P<0.05),抗癌物質在體內排出時間延長,從而使作用時間延長。實驗組患者血清中GST活性低于對照組(P<0.05),表明實驗組治療效果優于對照組。由此可見,以氟尿嘧啶為基礎的化療方案能后升高血清中MTHFR濃度,抑制癌基因表達,降低GST活性,延長化療藥的作用時間,對晚期胃癌患者的治療具有重要的意義。
腫瘤標志物是惡性腫瘤在發生和增殖過程中,由腫瘤細胞的基因表達而合成分泌或是由機體對腫瘤反應異常而產生的,是反映腫瘤存在和生長的一類物質。在一定程度上能反映癌的發生發展,可以在腫瘤病變組織,血液和排泄物中檢出。腫瘤標志物主要與腫瘤增殖和腫瘤細胞絕對數量直接相關,檢測血清腫瘤標志物水平是臨床評價腫瘤治療效果和預后復發常用方法[15]。在臨床研究中大部分血清腫瘤標志物水平變化和腫瘤治療效果相關。在成功的治療后,包括手術、化療,腫瘤標志物即明顯下降。一般認為化療有效的病例,腫瘤標志物的濃度應該下降50%[16],至少應該降至正常參考值上限附近,既往所應用的腫瘤單一指標檢測已經被證明特異性低、靈敏度差,因此國內外學者均主張多指標聯合、動態檢測。本研究結果表明,氟尿嘧啶能夠明顯降低晚期胃癌患者血清腫瘤標志物水平,提示臨床療效顯著。
研究表明[17],以氟尿嘧啶為基礎,聯合多西紫杉醇的化療方案可以有效改善晚期胃癌患者的臨床癥狀,減少不良反應,但相關研究較少。本研究結果顯示,經過3個療程的治療后,實驗組患者的總有效率為91.67%,對照組患者的總有效率為70.83%,實驗組總有效率明顯高于對照組(P<0.05)。2組患者在治療過程中均未出現嚴重的肝腎功能不全、出血等不良反應,2組患者出現的不良反應主要有腹瀉、胃脹、惡心、手足綜合征、脊髓抑制等,其中實驗組出現腹瀉、胃脹的不良反應低于對照組(P<0.05)。絕大部分不良反應經對癥治療后均可緩解。由此可見,以卡培他濱為基礎的化療方案治療晚期胃癌有效率高,臨床癥狀改善明顯,不良反應少。
實驗通過對48例晚期胃癌患者血清中的MTHFR、GST及腫瘤標志物等情況進行比較分析,證實了以卡培他濱為基礎的化療方案能夠升高血清中MTHFR濃度,降低GST活性,降低腫瘤標志物水平,臨床療效明顯、不良反應少。因此,以卡培他濱為基礎的化療方案對治療晚期胃癌患者具有重要意義。在下一步研究中,本課題組將尋找新的信號分子和目的基因,為本實驗所反映的現象做出進一步論證和分析。
[1] 惠起源,魏曉萍.幽門螺桿菌致胃癌機制的研究進展[J].中國腫瘤,2003,12(2):89-91.
[2] 袁吉,倪孟祥.5-氟尿嘧啶及其衍生物的研究進展[J].藥物生物技術,2012,(5):462-465.
[3] 吳芳,陳述嫦,盧致輝,等.紫杉醇脂質體或紫杉醇聯合5-氟尿嘧啶一線治療晚期胃癌的臨床療效分析[J].中華腫瘤雜志,2010,32(3):234-236.
[4] 于國偉,梁會.胃癌遺傳易感性基因的研究進展[J].世界華人消化雜志,2014,22(1): 53-58.
[5] 王英,黃文成,黃玲莎.血清腫瘤標志物聯合檢測在惡性腫瘤診斷中的臨床應用[J].貴州醫藥,2004,12(2):145-146.
[6] 朱雄增.胃腸道癌前病變和癌的 WHO 診斷新標準[J].中華病理學雜志,2003,32(2): 168-169.
[7] 王奇,范燦鵬,陳錕慈,等.三種磺胺類藥物對羅非魚肝臟組織中谷胱甘肽轉移酶 (GST) 和丙二醛 (MDA)的影響[J].生態環境學報,2010,19(5):1014-1019.
[8] Buccheri G,Ferrigno D,Tamburini M.Karnofsky and ECOG Performance Status Scoring in Lung Cancer: A Prospective, Longitudinal Study of 536 Patients From a Single Institution[J].Eur J Cancer,1996,32a(7):1135-1141.
[9] 曹妮達,趙愛光,朱瑩杰,等.進展期胃癌化療療效的中國文獻分析[J].世界華人消化雜志,2008,16(4):436-442.
[10] 宋衛峰,王雷,蔡訊,等.5-氟尿嘧啶血藥濃度預測卡培他濱聯合順鉑一線治療晚期胃癌的療效和安全性的單中心臨床研究[J].腫瘤,2013,33(9):795-801.
[11] 姜躍龍,Liu XS,Chan DKY.谷胱甘肽-S-轉移酶P1基因多態性與胃癌和食管腺癌的關系研究進展[J].中國綜合臨床,2014,30(1):97-99.
[12] 高雅瓊,王彩麗.谷胱甘肽硫轉移酶基因多態性與疾病關系的研究進展[J].醫學綜述,2013,19(1):29-31.
[13] 郭興坡.MTHFR 基因多態性與結直腸癌易感性及與5-FU類藥物化療毒副反應的相關研究[D].蘇州大學,2014.
[14] 陸建偉,高長明,吳建中,等.亞甲基四氫葉酸還原酶基因 C677T 多態性與胃癌患者對 5-FU 化療敏感性的關系[J].癌癥:英文版,2004,23(8):958-962.
[15] 朱海濤.血清腫瘤標志物在胃癌療效觀察、術后預后判斷和復發監測中的臨床價值[J].中外健康文摘,2013(51):202.
[16] 斯基爾.癌癥化療手冊[M].科學出版社,2002.
[17] 何清.卡培他濱聯合多西紫杉醇與L-OHP+5-FU/CF治療晚期胃癌的對比研究[D].大連醫科大學,2008.
(編校:王儼儼)
Effect of fluorouracil for injection on methylenetetrahydrofolate reductase, glutathione S-transferase and tumor markers on patients with advanced gastric cancer
CHEN Ting-fu1, YAN Qi-min2
(1.Department of Internal Medicine, The 63870th Hospital of Chinese People’s Liberation Army, Huayin 714200, China; 2.Department of Internal Medicine, The 323th Hospital of Chinese People’s Liberation Army, Xi’an 710000, China)
ObjectiveTo investigate the effect of fluorouracil for injection on methylene tetrahydrofolate reductase (MTHFR), glutathione S-transferase (GST) and tumor markers in patients with advanced gastric cancer.MethodsForty-eight cases with advanced gastric cancer were selected from August 2013 to August 2014 in the hospital and divided into two groups.The control group (n=24) were treated with capecitabine plan, and the experiment group (n=24) were treated with fluorouracil for injection plan.MTHFR concentration, GST activity and tumor markers [carbohydrate antigen-199(CA199), carcinoembryonic antigen (CEA), alpha fetoprotein(AFP)] levels were compared before and after treatment.ResultsCompared with control group, MTHFR concentration of experiment group was higher (P<0.05), GST activity was lower (P<0.05), the tumor markers levels were lower (P<0.05), total effective rate of clinical symptoms was higher [16(66.67) vs.22(91.67),χ2=4.55,P<0.05], and incidence of adverse reactions was lower [14(58.33) vs.6(25.00),χ2=5.49,P<0.05].ConclusionFluorouracil for injection chemotherapy could increase the serum MTHFR concentration, reduce GST activity, and its clinical curative effect is obvious with less adverse reactions, which has important significance in treatment of patients with advanced gastric cancer.
fluorouracil for injection; advanced gastric cancer; methylene tetrahydrofolate reductase; glutathione S-transferase; tumor markers
陳庭富,男,本科,主治醫師,研究方向:消化內科疾病治療,E-mail:ctf13311588571@163.com。
R735
A
1005-1678(2015)07-0085-04

