基于吐溫—姜黃素復合物的熒光探針檢測脂肪酶活性
湯燕+張衛+左煥楨+劉佳+江凌+田丹碧

摘 要 本實驗以姜黃素作為信號探針,吐溫作為脂肪酶的底物和包裹姜黃素的載體,建立了一種檢測脂肪酶活性的熒光法。實驗發現,采用0.3 mmol/L 吐溫40, 25 μmol/L 姜黃素,并且脂肪酶水解吐溫40的時間為35 min時,姜黃素的熒光強度變化值與脂肪酶濃度在0.002~0.05 mg/mL和0.05~0.25 mg/mL范圍內呈現線性關系,檢出限為0.6 mg/L (S/N=3)。此探針在高通量檢測脂肪酶活性以及與脂肪酶相關疾病檢測領域中有較好的應用前景。
關鍵詞 姜黃素; 吐溫40; 脂肪酶; 熒光探針
1 引 言
許多疾病都與生物體內特定酶的活性密切相關,因此在生理條件下準確檢測酶活性十分關鍵【1】,其中,脂肪酶(Lipase E.C. 3.1.1.3)是作用于羧酸酯鍵的一類水解酶,與急性胰腺炎、肥胖癥、動脈粥樣化等疾病密切相關【2】。脂肪酶的催化機理與其它的水解酶并不相同,其催化水解反應發生在油-水界面上【3~5】,并且,它的底物為水不溶性酯類化合物,在測定酶活性過程中,通常需要乳化,乳化劑的加入會顯著影響酶活性檢測的真實性【6,7】,所以建立一種可靠、簡單、靈敏的檢測脂肪酶活性的方法尤為重要。
姜黃素是一種天然疏水性抗癌藥物,其自身具有紫外和熒光性質【8,9】,可作為熒光信號探針;同時,吐溫是一種兩親性的、生物相容性良好的非離子表面活性劑【10,11】,它既作為脂肪酶的底物,又作為包封姜黃素的載體。因此,本研究利用姜黃素作為信號探針,吐溫作為脂肪酶的底物和姜黃素的載體,構建了吐溫-姜黃素復合物這一傳感平臺,用于脂肪酶活性的檢測。與傳統的滴定法、平板法和濁度法等相比,本方法無需乳化底物、操作簡單、成本低廉,靈敏度得到明顯提高。
2 實驗部分
2.1 儀器與試劑
SpectraMax M3微孔板檢測系統(美國分子儀器公司),HH-S1恒溫水浴鍋(金壇市醫療儀器廠),電子天平 (德國賽多利斯公司)。吐溫20、40、60、80,姜黃素 (Curcumin),無水甲醇等均為分析純 (國藥集團化學試劑有限公司)。豬胰腺脂肪酶 (PPL)和人血清購于北京索萊寶科技有限公司。除姜黃素是用無水甲醇配制以外,其余所有樣品均在10 mmol/L磷酸鈉緩沖液(PBS, pH 7.4)中制備得到。
2.2 脂肪酶的熒光檢測
分別移取1 mL 0.3 mmol/L 吐溫40和10 μL 2.5 mmol/L姜黃素溶液于2 mL離心管中,混勻,加入10 μL不同濃度的PPL在 37 ℃下反應35 min后,在微孔板檢測系統上測量體系加入PPL前后的熒光強度(圖1)。最終,以F0 -F (ΔF505)為縱坐標,PPL濃度為橫坐標,繪制標準曲線,F0和F分別表示加入PPL前后的熒光強度。
2.3 實際樣品測定
將人血清在10000 r/min下離心10 min,向所獲得的上層清液中分別加入不同濃度的PPL溶液,配制成最終濃度分別為0.025, 0.5和1.0 mg/mL PPL的人血清樣品,按照繪制標準曲線的方法進行檢測。
3 結果與討論
3.1 吐溫-姜黃素復合物熒光檢測脂肪酶活性
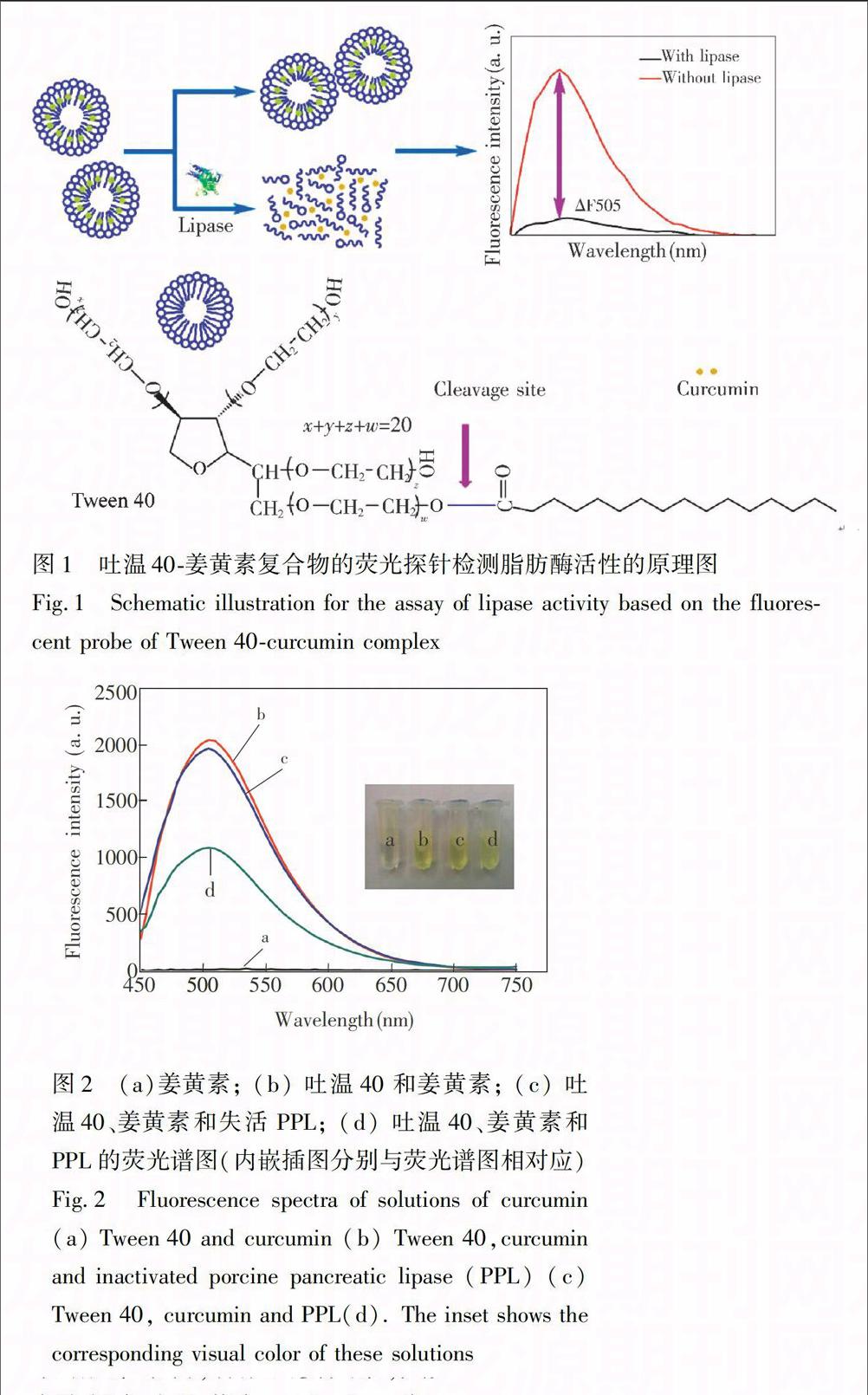
圖1為吐溫40-姜黃素復合物的熒光探針檢測脂肪酶活性的原理圖。當沒有脂肪酶存在時,吐溫40-姜黃素復合物仍然保持著膠束結構,姜黃素無法釋放到緩沖溶液中發生降解,依然具有很高的熒光強度;當脂肪酶存在時,它水解切割吐溫40中的羧酸酯鍵,
破壞了吐溫40-姜黃素復合物的膠束結構,使得姜黃素從中釋放出來,在緩沖溶液中發生降解,熒光強度大大降低。為了驗證這一傳感機理,如圖2所示。姜黃素存在于10 mmol/L PBS (pH 7.4)時,發生降解,幾乎沒有熒光強度,溶液顏色為無色 (圖2a,a離心管);當吐溫40存在時,其姜黃素被包裹在內,無法發生降解,具有很高的熒光強度,溶液顏色為黃色 (圖2b,b離心管),說明吐溫40保護姜黃素避免它與緩沖溶液相互作用而發生降解,從而擁有很高的熒光強度;當加入PPL時,會使吐溫40發生水解,破壞了吐溫40-姜黃素復合物的膠束結構,釋放出姜黃素,其熒光強度大大減弱,溶液顏色為淡黃色 (圖2d,d離心管),表明PPL具有破壞吐溫40的作用,進而使得姜黃素游離出來并與緩沖溶液相互作用發生降解,熒光強度減弱;同時,為了說明是PPL水解吐溫40,使姜黃素釋放到緩沖溶液中發生降解,對照實驗采用失活的PPL(100 ℃煮沸一段時間)加入到吐溫40-姜黃素復合物溶液中,其熒光強度與未加酶時幾乎一致,且溶液顏色也是一致的 (圖2c,c離心管)。以上實驗結果表明,脂肪酶、姜黃素和吐溫40三者之間的相互作用關系, 即在PPL的作用下,吐溫40-姜黃素復合物的結構遭到破壞,姜黃素釋放出來與緩沖液相互作用發生降解,熒光強度減弱。因此,本方法可成功檢測脂肪酶活性。
為了進一步探究該傳感機理,采用紫外譜圖進行研究。在中性水溶液中,姜黃素在430和355 nm處有兩個特征吸收峰,其中355 nm處出現的峰是由于水分子與姜黃素之間相互作用所導致的【8,12】。當姜黃素加入到pH 7.4的PBS緩沖溶液中時,反應1 min,發現在425 nm處出現一個低強度的吸收峰,并且在355 nm處有個不明顯的峰(圖3b);35 min后,425 nm處的峰完全消失,355 nm處有一個明顯的吸收峰(圖3a), 圖3 (a)磷酸鈉緩沖溶液與姜黃素反應35 min;(b)磷酸鈉緩沖溶液和姜黃素反應1 min;(c)吐溫40、姜黃素和PPL反應35 min;(c)吐溫40與姜黃素反應35 min的紫外譜圖
Fig.3 UV-vis spectra of curcumin after reacted with (a) PBS for 35 min, (b) PBS for 1 min, (c) mixture of Tween 40 and PPL for 35 min and (d) Tween 40 for 35 minendprint
說明隨著反應時間的不斷延長,355 nm處的峰越來越明顯,其姜黃素與緩沖溶液相互作用越強。當吐溫40存在時,355 nm處的峰完全消失,在425 nm處出現一個高強度的吸收峰 (圖3d);加入PPL后,同樣355 nm處的峰完全消失,但是在425 nm處的吸收峰的強度要低于沒有加酶的(圖3c),表明了吐溫40的存在能夠顯著降低姜黃素與緩沖溶液的相互作用,加入PPL后,會增強姜黃素與緩沖溶液的相互作用,導致姜黃素不斷降解。這些現象再次驗證此傳感策略能很好地用于檢測脂肪酶活性。
3.2 實驗條件的優化
采用熒光光譜考察了吐溫類型與濃度、姜黃素濃度以及PPL水解吐溫時間對此傳感策略性能的影響。吐溫有多種類型,如吐溫20, 40, 60和80等,都可以作為PPL的底物和包裹姜黃素的載體【10,12~15】,但是PPL對其水解程度不一樣,并且它們包裹姜黃素的能力也不一樣,因此選擇合適的吐溫十分關鍵,結果如圖4A所示,當選用吐溫40作為PPL底物和包裹姜黃素載體時,熒光信號差值最大。
吐溫40濃度的選擇對于該傳感器的構建尤為重要,低濃度不利于形成膠束,以包裹姜黃素,高濃度不利于PPL對其水解催化(圖4B)。在吐溫40濃度為0.05~0.30 mmol/L時,熒光信號差值不斷增大,當濃度超過0.30 mmol/L時,熒光信號差值下降,因此選擇0.30 mmol/L 吐溫40作為最佳實驗條件。
姜黃素作為該策略的信號傳感元件,信號的強弱與其濃度大小相關。如圖4C所示,隨著姜黃素濃度的增加,熒光信號差值也相應增大,至濃度達到25 μmol/L時,熒光信號差值趨向穩定。因此,姜黃素的濃度選為25 μmol/L。
在PPL催化水解吐溫40的過程中,反應時間是評價傳感策略的重要因素,結果如圖4D所示。在0~35 min反應時間內,隨著反應時間的延長,熒光信號差值不斷增加,35 min后,熒光信號差值趨于穩定,表明PPL催化水解吐溫40達到平衡狀態,因此選擇PPL催化水解吐溫40的時間為35 min。
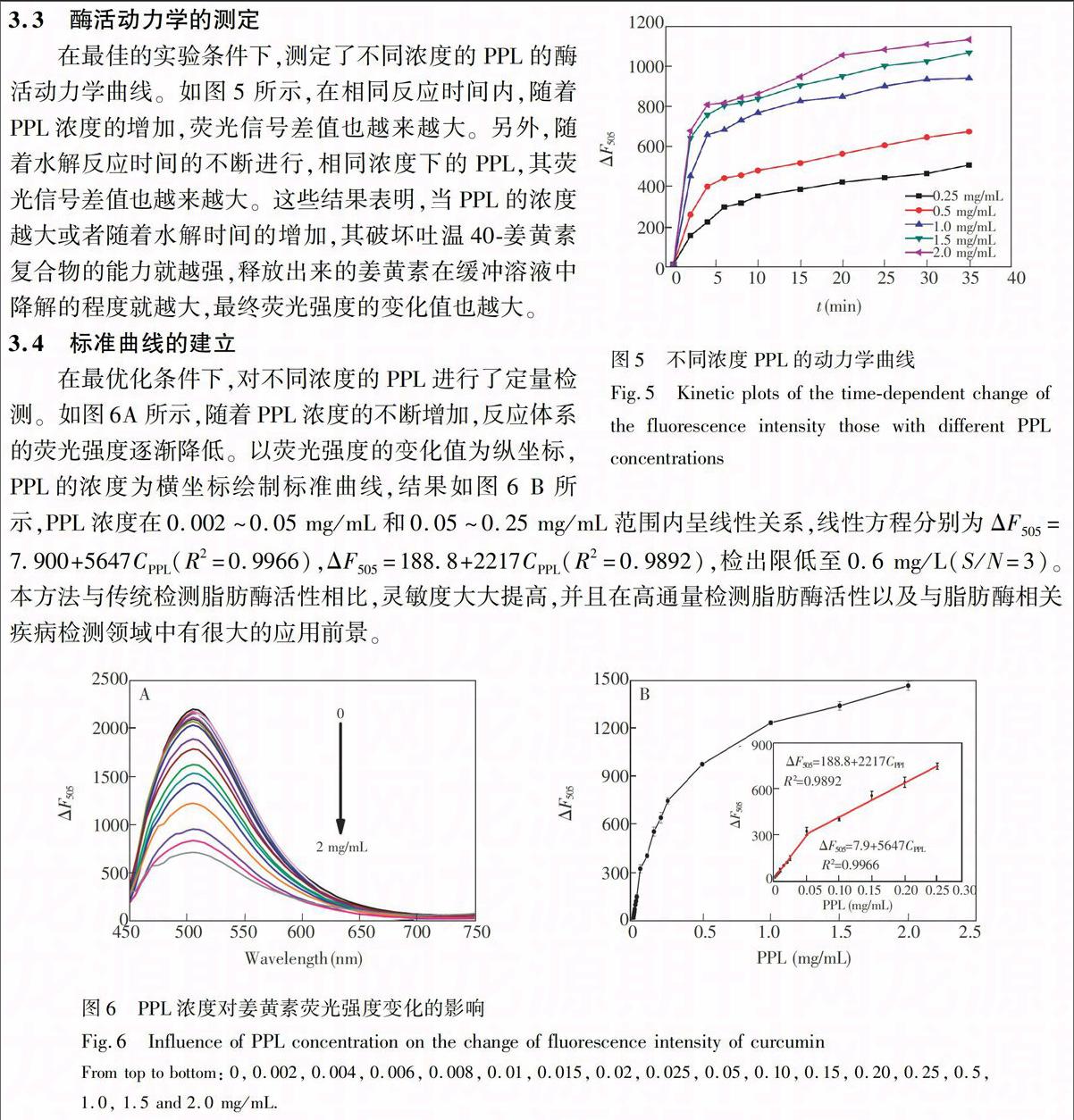
3.3 酶活動力學的測定
在最佳的實驗條件下,測定了不同濃度的PPL的酶活動力學曲線。如圖5所示,在相同反應時間內,隨著PPL濃度的增加,熒光信號差值也越來越大。另外,隨著水解反應時間的不斷進行,相同濃度下的PPL,其熒光信號差值也越來越大。這些結果表明,當PPL的濃度越大或者隨著水解時間的增加,其破壞吐溫40-姜黃素復合物的能力就越強,釋放出來的姜黃素在緩沖溶液中降解的程度就越大,最終熒光強度的變化值也越大。
3.4 標準曲線的建立
在最優化條件下,對不同濃度的PPL進行了定量檢測。如圖6A所示,隨著PPL濃度的不斷增加,反應體系的熒光強度逐漸降低。以熒光強度的變化值為縱坐標,PPL的濃度為橫坐標繪制標準曲線,結果如圖6 B所示,PPL濃度在0.002~0.05 mg/mL和0.05~0.25 mg/mL范圍內呈線性關系,線性方程分別為ΔF505=7.900+5647CPPL(R2=0.9966),ΔF505=188.8+2217CPPL(R2=0.9892),檢出限低至0.6 mg/L(S/N=3)。本方法與傳統檢測脂肪酶活性相比,靈敏度大大提高,并且在高通量檢測脂肪酶活性以及與脂肪酶相關疾病檢測領域中有很大的應用前景。
3.5 人血清中PPL的標準加入回收率
按照所建立的熒光檢測方法,通過標準加入法對人血清中的PPL進行回收率計算。檢測結果如表1所示。結果表明,此傳感方法可以適用于實際樣品的檢測。
References
1 Hutter E, Maysinger D. Trends Pharmacol. Sci., 2013, 34(9): 497-507
2 Gupta R, Gupta N, Rathi P. Appl. Microbiol. Biotechno., 2004, 64(6): 763-781
3 Gupta R, Rathi P, Gupta N, Bradoo S. Biotechnol. Appl. Biochem., 2003, 37(1): 63-71
4 Gomes N, Goncalves C, Garcia-Roman M, Teixeira J A, Belo I. Anal. Methods, 2011, 3(4): 1008-1013
5 Hasan F, Shah A A, Hameed A. Biotechnol. Adv., 2009, 27(6): 782-798
6 Beisson F, Tiss A, Rivière C, Verger R. Eur. J. Lipid Sci. Technol., 2000, 102(2): 133-153
7 Gilham D, Lehner R. Methods, 2005, 36(2): 139-147
8 Sahu A, Bora U, Kasoju N, Goswami P. Acta Biomater., 2008, 4(6): 1752-1761
9 Ke D, Wang X, Yang Q, Niu Y, Chai S, Chen Z, An X, Shen W. Langmuir, 2011, 27(23): 14112-14117
10 Kerwin B A. J. Pharmacol. Sci., 2008, 97(8): 2924-2935
11 Plou F, Ferrer M, Nuero O, Calvo M, Alcalde M, Reyes F, Ballesteros A. Biotechnol. Tech., 1998, 12(3): 183-186
12 Mandal S, Banerjee C, Ghosh S, Kuchlyan J, Sarkar N. J. Phys.Chem. B., 2013, 117(23): 6957-6968
13 Sakai Y, Hayatsu M, Hayano K. Soil Sci. Plant Nutr., 2002, 48(5): 729-734
14 Carson L A, Favero M S, Bond W W, Petersen N J. Appl.Microbiol., 1973, 25(3): 476-483
15 Baradi A F, Bourne G H. Nature, 1951, 168(4284): 977-979endprint

