熱加工食品中呋喃的生成機制
張 穎,梁宇航,張 健,呂曉玲
(1. 食品營養與安全教育部重點實驗室,天津科技大學食品工程與生物技術學院,天津 300457;2. 工業發酵微生物教育部重點實驗室,天津科技大學生物工程學院,天津 300457)
熱加工食品中呋喃的生成機制
張 穎1,梁宇航1,張 健2,呂曉玲1
(1. 食品營養與安全教育部重點實驗室,天津科技大學食品工程與生物技術學院,天津 300457;2. 工業發酵微生物教育部重點實驗室,天津科技大學生物工程學院,天津 300457)
呋喃是一種常見于熱加工食品中的環狀烯醚,對人體具有潛在的致癌性,國際癌癥研究機構(IARC)已將其定義為“2B”類致癌物.盡可能降低熱加工食品中的呋喃含量,可有效提升食品的安全性,而闡明熱加工食品中呋喃的形成機制,則是調控其中呋喃含量的前提和基礎.為此,從熱加工食品中呋喃生成的分子路線與影響因素兩個方面入手,較為全面地綜述了近年來有關呋喃形成機制的相關研究,深入分析和總結了現有研究的不足,并提出了相應的解決方案.
呋喃;熱加工食品;生成機制
1 確認前體及前體轉化的分子路線
1.1 糖類轉化生成呋喃
糖類,又稱碳水化合物(carbohydrate),是多羥基醛或多羥基酮及其縮聚物和某些衍生物的總稱,一般由碳、氫、氧3種元素所組成,主要分為4大類:單糖、雙糖、低聚糖和多聚糖.1979年Maga等[8]曾指出:糖類的熱降解反應是呋喃生成的一種重要途徑;Limacher等[9]對己糖進行了碳組標記技術(carbon module labeling,CAMOLA)實驗,發現己糖類生成呋喃主要有兩種途徑:一種是由糖類自身的C鏈進行環化等一系列反應生成,一種是在丙氨酸、蘇氨酸或絲氨酸等氨基酸存在的條件下,由C2鏈或C3鏈的糖碎片進行重組而得,而在糖類降解過程中生成的甲酸和乙酸也驗證了C1或C2鏈的裂解.
在有氨基酸存在時,Locas等在2004年通過CAMOLA技術發現單糖類生成呋喃的途徑主要有4種(見圖1[10]).
A:通過美拉德反應生成1-脫氧鄰酮醛糖,再經過α-二羰基裂解反應將C1-C2鏈與C3-C6鏈斷開生成丁醛糖,再經過環化反應及脫水等反應生成呋喃;
B:直接由反醛醇裂解反應生成丁醛糖,再按照A途徑生成呋喃,A、B兩種途徑生成的呋喃均為C3-C6鏈框架;
C:經過脫水反應和反醛醇裂解反應將C1-C4鏈與C5-C6鏈斷開,生成2-脫氧-3-酮基丁醛糖,再經過脫水環化反應和還原反應生成呋喃;
D:經過α-二羰基裂解反應將C1鏈與C2-C6鏈斷開,生成3-脫氧-鄰酮醛糖,再由氧化反應和脫羧反應去掉C6,生成2-脫氧丁醛糖,最后經過脫水生成呋喃.
需要說明的是:A、B兩種途徑生成的丁醛糖經過環化和脫水后生成3-呋喃酮和2(5H-)呋喃酮,其中3-呋喃酮經過還原反應和進一步脫水后可以生成呋喃,而2(5H-)呋喃酮則不能生成呋喃.但是M?rk等[11]研究發現赤蘚糖即丁醛糖生成呋喃的量很少,因此這條途徑發生的可能性也較小,所以這些途徑機制仍需要進一步進行實驗驗證.
相應地,五碳糖也可單獨生成呋喃,不過在有氨基酸存在的條件下生成量更多.五碳糖可以通過與氨基酸反應或者進行C3鏈上的脫水反應生成3-脫氧戊酮糖,進而通過α-二羰基裂解反應生成2-脫氧丁醛糖.
1.2 抗壞血酸轉化生成呋喃
維生素C(ascorbic acid),又名L-抗壞血酸,是一種水溶性維生素.雖然維生素C在人體中含量極少,但卻是人體骨骼、血管等發育所必需的,因此需要每日補充一定量的維生素C.維生素C有兩種活性結構:抗壞血酸及其氧化衍生物脫氫抗壞血酸,因此經常將抗壞血酸與脫氫抗壞血酸含量之和表示為維生素C的含量.
抗壞血酸作為一種常用的抗氧化劑,其本身也是呋喃的一種重要前體物.抗壞血酸很容易被氧化成脫氫抗壞血酸;脫氫抗壞血酸被水解為2-二酮古洛糖酸,再經過脫羧反應與α-二羰基裂解生成丁醛糖進而生成呋喃.但在大部分無氧熱解條件下,抗壞血酸并不能被氧化為2-二酮古洛糖酸,而是通過水解和β-消除反應后,再經過脫羧反應生成3-脫氧戊酮糖,按照核糖的分解途徑(α-二羰基裂解)生成2-脫氧丁醛糖.2-脫氧丁醛糖并非像其他丁醛糖衍生物一樣需要幾步還原反應,而是可以直接生成呋喃[10].因此,在無氧熱解條件下,抗壞血酸與脫氫抗壞血酸相比,是一種更為有效的呋喃前體物.在有氧熱降解條件下,則會有相反的情況:例如在高壓熱加工條件下,脫氫抗壞血酸的呋喃生成量要比抗壞血酸的呋喃喃生成量高出10倍左右[12].Limacher等[13]發現在水溶液環境中,脫氫抗壞血酸在pH為7時比抗壞血酸生成的呋喃量要多,但在pH為4時差距不大.這表明抗壞血酸衍生物生成的呋喃量很大程度取決于反應體系的條件.
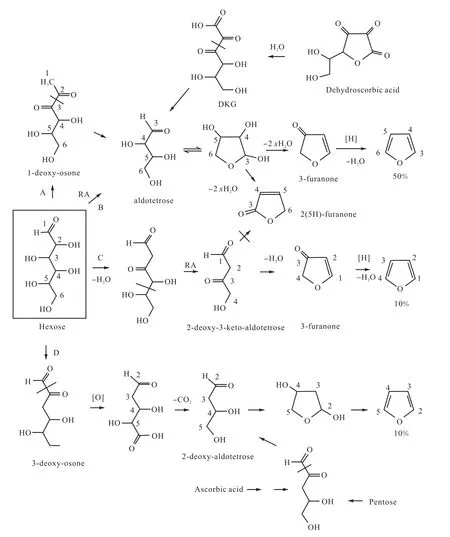
圖1 由碳組標記技術標記的單糖類生成呋喃的4種反應途徑Fig. 1 4 pathways of CAMOLA labeled monosaccharide generated furan
由于在食品體系中抗壞血酸很易被氧化為脫氫抗壞血酸,因此一般情況下兩者經常共存并相互影響.Owczarek-Fendor等[14]發現,抗壞血酸與脫氫抗壞血酸的比例變化對于呋喃的生成反應并沒有太大的影響,當脫氫抗壞血酸單獨存在時生成的呋喃量會有明顯降低,這為上文中無氧熱解條件下抗壞血酸是更為有效的呋喃前體物的觀點提供了依據.
相關文獻[11]表明,相同量的單一抗壞血酸與添加了其他呋喃前體物如糖類、氨基酸或脂肪酸的抗壞血酸相比,抗壞血酸單獨生成的呋喃量要多很多;甚至將呋喃的各直接前體物組合在一起的模擬體系都會比只含抗壞血酸的模擬體系的呋喃生成量要少.另外,在干熱條件下,脫氫抗壞血酸通過環化反應以半縮酮的形式存在,進而可以有效防止呋喃的生成.
1.3 氨基酸轉化生成呋喃
氨基酸是含有氨基和羧基的一類有機化合物的通稱.氨基酸也是呋喃的一種重要前體物,只是其單獨生成的呋喃量沒有抗壞血酸和糖類多.在沒有還原糖等其他呋喃前體物存在時,某些氨基酸可通過熱降解反應生成羥基乙醛與乙醛,再由羥醛縮合反應生成丁醛糖衍生物,進而生成呋喃,例如絲氨酸、半胱氨酸.Locas等[10]的研究表明:不是所有氨基酸都可以單獨生成呋喃,蘇氨酸、丙氨酸和天門冬氨酸在降解過程中只能生成乙醛,還需要還原糖提供羥基乙醛才可以生成呋喃.同時Locas等通過CAMOLA將絲氨酸的3個碳原子分別進行標記發現:絲氨酸可以通過一系列反應(包括A、B、C、D)生成乙醛與羥基乙醛,為呋喃的前體物質提供來源(見圖2[10]).
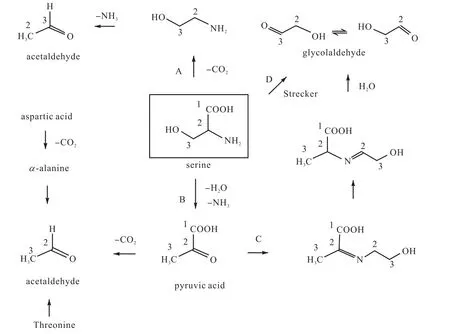
圖2 由CAMOLA標記的氨基酸生成乙醛和羥基乙醛反應途徑Fig. 2 Pathways of CAMOLA labeled amino acid to produce acetaldehyde and glycolaldehyde
A:通過脫羧反應除去C1鏈,由C2-C3鏈生成乙醇胺,再脫去一個氨分子生成乙醛;
B:經過脫水與去氨基反應生成丙酮酸,然后脫羧反應除去C1鏈并由C2-C3鏈生成乙醛;
C:經過B途徑生成的丙酮酸與乙醇胺反應、與亞胺異構反應,以及脫水縮合生成羥基乙醛;
D:直接進行斯特雷克(Strecker)氨基酸反應脫去C1鏈生成羥基乙醛.
以上4種途徑生成的乙醛和羥基乙醛,通過醇醛縮合反應生成相應的丁醛糖衍生物之后,再由環化與脫水反應生成呋喃;而由前文所述可知,絲氨酸生成的呋喃中4個碳原子均來自于C2與C3鏈,這也間接驗證了呋喃前體羥醛縮合反應機理的正確性.
1.4 脂肪酸轉化生成呋喃
脂肪酸(fatty acid)是由碳、氫、氧3種元素組成的一種有機化合物.按照碳氫鏈飽和與不飽和的不同可以分為3類:飽和脂肪酸(SFA)、單不飽和脂肪酸(MUFA)與多不飽和脂肪酸(PUFA).在模擬體系下的研究表明,只有多不飽和脂肪酸,如亞油酸和亞麻酸等可以在加熱條件下生成呋喃[12],并且隨著脂肪酸氧化程度的提高,呋喃的生成量相應也會呈現增加的趨勢.Owczarek-Fendor等[15]在研究淀粉基質中脂肪氧化對呋喃生成的影響實驗中發現,脂肪酸的成分與氧化程度對于呋喃生成量影響很大.如果氧化的油脂含有α-亞麻酸,則產生呋喃的量很顯著,過氧化值和產生的呋喃的量沒有明確的相關性,但是在豆油中,隨著氧化程度的增加,呋喃的生成量顯著升高.另外Blank[16]的報道發現,等量的亞油酸生成的呋喃量要比亞麻酸多4倍左右,同時氯化鐵的存在可以催化呋喃的生成.兩者的甘油三酸酯生成的呋喃量相差不多,只有加入氯化鐵之后,比游離的脂肪酸更易生成呋喃.
多不飽和脂肪酸的氧化反應是生成呋喃的主要途徑.一般情況下,多不飽和脂肪酸的氧化是通過活性氧的非酶作用或者脂氧合酶的酶促反應生成脫氫過氧化物(見圖3[10]),再經過過渡金屬離子的催化進行裂解反應生成不同的裂解產物,尤其是性質活潑的醛類,如4-羥基-2-丁烯醛,再經環化與脫水反應生成呋喃.Sayre等[17]研究發現,5-戊基呋喃作為脂質酸敗氧化的一種化學指示物,與4-羥基-2-壬烯醛(4-HNE)的生成有關;而4-羥基-2-壬烯醛是4-羥基-2-丁烯醛的高級同系物,并且在酸性條件下的4-HNE乙醇溶液經過回流可以生成呋喃.Gérard-Monnier等[18]也驗證了這一結論.
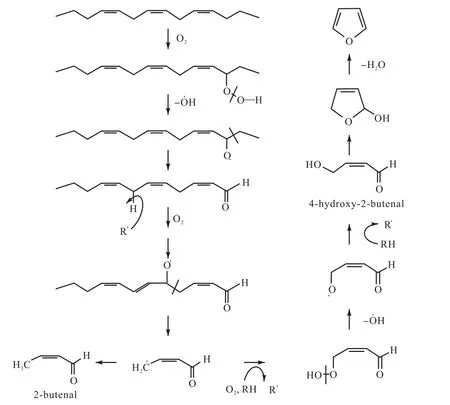
圖3 多不飽和脂肪酸氧化生成呋喃的反應途徑Fig. 3 Pathways of furan generation through polyunsaturated fatty acid oxidation
1.5 類胡蘿卜素轉化生成呋喃
類胡蘿卜素是一類脂溶性天然色素的總稱,是普遍存在于動植物、真菌、藻類和細菌中的色素.主要包括β-胡蘿卜素和γ-胡蘿卜素.類胡蘿卜素和抗壞血酸都是常用的抗氧化劑,同時類胡蘿卜素也被認為是呋喃的一種前體物[12].Owczarek-Fendor等[19]的研究發現,在不飽和脂肪酸的氧化過程中,β-胡蘿卜素的加入對于呋喃的生成有比較明顯的促進作用.新鮮的油脂中加入β-胡蘿卜素與未加入β-胡蘿卜素相比,呋喃的生成量較多;但當β-胡蘿卜素與油脂混合在一起再進行氧化后,生成的呋喃量與油脂氧化后再加入β-胡蘿卜素相比要多.這也驗證了β-胡蘿卜素本身也可能是呋喃的一種前體物質.同時由Owczarek-Fendor等已得的結果表明,新鮮的β-胡蘿卜素與其氧化中間產物之間,對于呋喃的生成量多少似乎有著某種競爭關系.
然而,類胡蘿卜素作為呋喃的一種前體物質,關于它對呋喃生成反應的影響研究并沒有太多的相關報道.類胡蘿卜素作為一種抗氧化劑在添加到油脂中的氧化過程中,由于反應的復雜性和條件的不確定性,并不清楚中間產物的主要反應機理和途徑;與單糖、抗壞血酸和氨基酸的研究深度相比,類胡蘿卜素還是只停留在原料基礎上得知是呋喃的前體物質,沒有對其具體途徑進行實驗分析和推測.
2 明確轉化途徑影響因素
食品的加工過程按照溫度的不同可以分為熱加工與冷加工兩大類.呋喃多在食品的熱加工過程中產生,尤其在咖啡、果蔬肉類罐頭、奶粉等罐裝食品中含量較多.結合上文中呋喃的5種前體物的具體生成途徑可以發現,食品原料的熱加工過程中的pH、加熱時間和溫度、加工方式等都可以明顯地促進糖類美拉德反應的進行和脂肪酸等物質的氧化,是生成呋喃的重要影響因素.
2.1 pH的影響
在熱加工過程的食品體系中,由于食品原料的特性,pH一般在中性與酸性之間.研究表明在其他因素條件不變的情況下,pH由低到高變化時,一些前體物質的呋喃生成量會受到不同的影響,但具體如何影響呋喃的生成目前還沒有充足的理論來證明.Owczarek-Fendor等[15]的研究表明在含有糖類和糖醇類的模擬體系中,隨著pH的升高,糖類和糖醇類的裂解和烯醇化反應會導致呋喃生成量的增加,例如乳糖、葡萄糖、果糖.Limacher等[9]的研究也發現在pH為7時所測糖類的呋喃生成量均比pH為4時要多;然而,對于蔗糖則是相反的情況:Fan[20]發現在pH為3時,蔗糖的呋喃生成量顯著高于pH為6時的情況,這與Limacher等[9]的研究結果很相似.這可能是由于蔗糖在酸性條件下水解為葡萄糖和果糖,進而促進了呋喃的生成.
對于抗壞血酸來說,較低的pH反而會促進呋喃的生成.Owczarek-Fendor[14]研究發現:隨著pH由3.5升至6.5,在含有抗壞血酸鹽的淀粉基質模型體系中,呋喃的生成量降低了1/3~1/6.Limacher等[13]在關于抗壞血酸在食品模擬體系中呋喃生成的研究中也發現,在pH為7時,抗壞血酸本身生成呋喃的量極少,并不是一種有效的前體物質;而在pH為4時則很容易生成呋喃.Fan等[21]也在其他模型體系中發現了相似的pH影響效果.
2.2 緩沖溶液類型的影響
除了pH對食品體系呋喃的產生具有影響之外,模擬體系中緩沖溶液的類型也是一種潛在的影響因素.在相同pH的條件下,加入緩沖溶液與不加入緩沖溶液的模擬體系生成的呋喃量是不同的.
在含有糖類和抗壞血酸的模擬體系中加入磷酸鹽緩沖溶液或檸檬酸緩沖溶液會促進呋喃的生成,有相關文獻[22]表明這兩種緩沖溶液對于呋喃的生成有類似的促進作用,隨著緩沖液濃度的提高,呋喃的生成量也隨之增加.但其中具體的反應機制和途徑目前還不太清楚,需要進一步的研究探索.不過,磷酸鹽離子對于糖類降解和美拉德反應的刺激作用已有相關文獻的研究報道[23-24].
2.3 溫度與時間的影響
在罐裝食品的熱加工過程中,原料蒸煮、高溫滅菌等加工過程都需要較高的溫度,而溫度的高低對食品中美拉德反應以及脂肪酸、氨基酸等物質的氧化降解有著非常明顯的影響.Owczarek-Fendor等[14]的研究數據也證實了呋喃的生成量與加熱溫度有著正相關關系,尤其是在抗壞血酸存在的條件下.一些嬰兒食品為了保證殺菌徹底以及盡量延長貨架期,長時間的高溫殺菌以及抗壞血酸的加入都會間接促進呋喃的生成.
Fan等[21]的研究發現,在90,℃下對蘋果醋進行加熱10,min只有極少量的呋喃生成,而在120,℃加熱相同時間則生成了約3,ng/mL的呋喃,與加熱溫度呈明顯的線性關系.Owczarek-Fendor等[14]的研究也發現了類似的溫度-呋喃關系,同時在加熱時間的實驗中,在樣品中心達到目標溫度之前并無明顯的呋喃生成量,而持續加熱到20~40,min時呋喃的生成量明顯增多.
為了保證食品的質量安全,同時盡可能防止營養物質的流失,食品的加工溫度通常在90~120,℃范圍內[25],而在這一溫度段加熱很少的時間就可以生成大量的呋喃.因此,尋求更為合適的食品熱加工條件對于減少加工過程的呋喃污染情況是十分重要的,尤其對于嬰兒罐裝食品類更需引起重視.
2.4 熱加工方式的影響
我國傳統的食品熱加工方式通常為蒸、煮、煎、炒、油炸、燉等,而高溫油炸和高溫烘焙對于呋喃的生成影響非常明顯.在加工過程中,油脂等有機物的高溫裂解反應或者燃燒不完全都會產生更多的呋喃類物質.
Limacher等[9]通過將相同的前體物質分別置于高溫烘焙(200,℃)模擬體系和高壓蒸煮(120,℃)模擬體系中進行實驗,發現高溫烘焙產生的呋喃量在40.2~2,051,μmol/mol,而高壓蒸煮產生的呋喃量在0.66~326,μmol/mol;可以看出,相同的前體物在高溫烘焙和高壓蒸煮的條件下產生的呋喃量差異性非常明顯.
在真實食品方面,咖啡、面包和肉類等食物也常利用高溫烘焙和燒烤的方式進行加工.La Pera等[26]利用HS-SPME-GC-MS技術對不同源產地的烘焙咖啡粉中的呋喃含量進行了檢測,呋喃含量高達57.3~587.3,ng/g;Petisca等[27]對不同烘焙速度的咖啡粉中呋喃含量進行了研究,發現隨著烘焙速度的提高,呋喃類衍生物的含量會逐漸增多;Arisseto等[28]測得在經過烘焙后咖啡樣品中的呋喃含量在911~5,852,ng/g,而在未烘焙的綠色咖啡豆中沒有檢測出呋喃;另外,一些肉類制品的高溫加工過程除了可以生成呋喃類衍生物之外,還會有丙烯酰胺等其他有毒成分的生成.以上這些研究報道表明,高溫烘焙相對于其他加工方式更易致使呋喃的生成.
3 展 望
危害物呋喃的前體物質有氨基酸、碳水化合物、抗壞血酸類和脂類物質等[29-34].然而,并非所有的氨基酸都可單獨反應生成呋喃,有些氨基酸必須和碳水化合物進行美拉德反應才可生成呋喃[29],對此我們的認識還不夠,我們并未總結出規律性的結論.有報道稱己糖、戊糖、四碳糖甚至三碳糖(甘油醛)都能產生呋喃[35],然而除了己糖和戊糖,研究其他糖的很少,僅有個別報道.鑒于呋喃骨架本身就有4個碳原子,三碳糖不可能作為呋喃的唯一前體,還有1個碳原子來源于何處?除了上述前體化合物外,個別報道稱核黃素和類黑精亦能產生呋喃[26],這些還有待進一步證實.因為13C標記的葡萄糖種類較為齊全,既有全部標記的也有C1位、C2位或C6位標記的,所以人們對葡萄糖單獨存在時的熱降解或與氨基酸共同存在時的美拉德反應途徑的研究[34]相對最為透徹;而13C標記的抗壞血酸缺乏全標記的產品,因此某些反應過程只能推斷[33].除了葡萄糖和抗壞血酸,人們對氨基酸和脂類生成呋喃的過程認識的更少,多數反應途徑都是在前人對氨基酸和脂類物質熱氧化或分解的研究基礎上,結合有機化學知識的推斷,缺乏碳標記氨基酸和脂肪酸的呋喃形成機理研究.對呋喃轉化途徑影響因素的研究多是在簡單的模擬系統中,對單條形成途徑進行的單因素研究[12,32-33,36].未見同時考慮多因素對單轉化途徑的協同作用,亦未見多因素對不同轉化途徑中反應速率的影響,更缺乏相關的動力學研究,難以進行呋喃含量的控制和預測.
早期的研究雖然取得了很大的成績,真實食品體系的復雜性遠超簡單的模擬體系,食品組分、外源添加物和加工過程的多樣性,使得呋喃產生過程更為復雜多變.事實上,很多學者已經證實,將模擬體系中呋喃形成的研究結論應用于解釋真實食品中呋喃含量的變化時,往往出現很大偏差,因此必須謹慎[33-34].因為食品加工過程中呋喃的產生具有動態性、實時性、非線性以及不確定性等復雜特點,所以在研究加工過程中呋喃的形成機制時,必須要正確認識和把握這種多層次的復雜性,由簡至繁(一元模擬體系—多元模擬體系—真實食品體系),由微觀到宏觀(分子路線—影響因素—構建模型)研究其中呋喃的形成機制,才能全面綜合反映呋喃與其產生底物以及加工過程之間的互動關系.
[1] International Agency for Research on Cancer,WHO. IARC monographs on the evaluation of carcinogenic risks to humans:Dry cleaning,some chlorinated solvents and other industrial chemicals[R]. IARC,1995,63:393.
[2] US Food and Drug Administration. Office of plant and dairy foods:Exploratory data on furan in food [EB/OL]. 2004. http://www. cfsan. fda. gov.
[3] European Food Safety Authority. Report of the scientific
panel on contaminants in the food chain on provisional findings of furan in food[R]. EFSA Journal,2004,a, 137:1-20.
[4] European Food Safety Authority. Report of the contam panel on provisional findings on furan in food[R]. 2004,b,http://www. efsa. europa. eu.
[5] Jestoi M,J?rvinen T,J?rvenp?? E,et al. Furan in the baby-food samples purchased from the Finnish markets:Determination with SPME-GC-MS[J]. Food Chemistry,2009,117(3):522-528.
[6] 劉平,薛穎,金慶中,等. 頂空氣相色譜-質譜法測定嬰幼兒食品中的呋喃[J]. 色譜,2008,26(1):35-38.
[7] 何碧英,孫健,柳潔,等. 頂空氣相色譜-質譜法測定食品中呋喃[J]. 中國衛生檢驗雜志,2009,19(12):2790-2792.
[8] Maga J A,Katz I. Furans in foods[J]. Critical Reviews in Food Science & Nutrition,1979,11(4):355-400.
[9] Limacher A,Kerler J,Davidek T,et al. Formation of furan and methylfuran by Maillard-type reactions in model systems and food[J]. Journal of Agricultural and Food Chemistry,2008,56(10):3639-3647.
[10] Locas C P,Yaylayan V A. Origin and mechanistic pathways of formation of the parent furan:A food toxicant[J]. Journal of Agricultural and Food Chemistry,2004,52(22):6830-6836.
[11] M?rk J,Pollien P,Lindinger C,et al. Quantitation of furan and methylfuran formed in different precursor systems by proton transfer reaction mass spectrometry[J]. Journal of Agricultural and Food Chemistry,2006,54(7):2786-2793.
[12] Becalski A,Seaman S. Furan precursors in food:A model study and development of a simple headspace method for determination of furan[J]. Journal of AOAC International,2005,88(1):102-106.
[13] Limacher A,Kerler J,Conde-Petit B,et al. Formation of furan and methylfuran from ascorbic acid in model systems and food[J]. Food Additives and Contaminants,2007,24(S1):122-135.
[14] Owczarek-Fendor A,De Meulenaer B,Scholl G,et al. Furan formation from vitamin C in a starch-based model system:Influence of the reaction conditions[J]. Food Chemistry,2010,121(4):1163-1170.
[15] Owczarek-Fendor A,De Meulenaer B,Scholl G,et al. Furan formation in starch-based model systems containing carbohydrates in combination with proteins,ascorbic acid and lipids[J]. Food Chemistry,2012,133(3):816-821.
[16] Blank I. Furan in Processed Foods;Bioactive Compounds in Foods[M]. New York:Blackwell Pub Professional,2008.
[17] Sayre L M,Arora P K,Iyer R S,et al. Pyrrole formation from 4-hydroxynonenal and primary amines[J]. Chemical Research in Toxicology,1993,6(1):19-22.
[18] Gérard-Monnier D,Erdelmeier I,Régnard K,et al. Reactions of 1-methyl-2-phenylindole with malondialdehyde and 4-hydroxyalkenals. Analytical applications to a colorimetric assay of lipid peroxidation[J]. Chemical Research in Toxicology,1998,11(10):1176-1183.
[19] Owczarek-Fendor A,De Meulenaer B,Scholl G,et al. Furan formation from lipids in starch-based model systems,as influenced by interactions with antioxidants and proteins[J]. Journal of Agricultural and Food Chemistry,2011,59(6):2368-2376.
[20] Fan X T. Formation of furan from carbohydrates and ascorbic acid following exposure to ionizing radiation and thermal processing[J]. Journal of Agricultural and Food Chemistry,2005,53(20):7826-7831.
[21] Fan X T,Huang L H,Sokorai K J B. Factors affecting thermally induced furan formation[J]. Journal of Agricultural and Food Chemistry,2008,56(20):9490-9494.
[22] Huang X S,Duan H Y,Barringer S A. Effects of buffer and temperature on formation of furan,acetic acid and formic acid from carbohydrate model systems[J]. LWT -Food Science and Technology,2011,44(8):1761-1765.
[23] Adams A,De Kimpe N. Chemistry of 2-acetyl-1-pyrroline,6-acetyl-1,2,3,4-tetrahydropyridine,2-acetyl-2-thiazoline,and 5-acetyl-2,3-dihydro-4H-thiazine:Extraordinary Maillard flavor compounds[J]. Chemical Reviews,2006,106(6):2299-2319.
[24] Rizzi G P. Role of phosphate and carboxylate ions in Maillard browning[J]. Journal of Agricultural and Food Chemistry,2004,52(4):953-957.
[25] 王允圃,劉玉環,阮榕生,等. 食品熱加工與非熱加工技術對食品安全性的影響[J]. 食品工業科技,2011,32(7):463-467.
[26] La Pera L,Liberatore A,Avellone G,et al. Analysis of furan in coffee of different provenance by head-space solid phase microextraction gas chromatography-mass spectrometry:Effect of brewing procedures[J]. Food Additives and Contaminants,2009,26(6):786-792.
[27] Petisca C,Pérez-Palacios T,Farah A,et al. Furans and other volatile compounds in ground roasted and espresso coffee using headspace solid-phase microextraction:Effect of roasting speed[J]. Food and Bioproducts Processing,2013,91(3):233-241.
[28] Arisseto A P,Vicente E,Ueno M S,et al. Furan levels in coffee as influenced by species,roast degree,and brewing procedures[J]. Journal of Agricultural and Food Chemistry,2011,59(7):3118-3124.
[29] Arisseto A P,Vicente E,Furlani R P,et al. Occurrence of furan in commercial processed foods in Brazil[J]. Food Additives and Contaminants,2012,29(12):1832-1839.
[30] Egle J L Jr,Gochberg B J. Respiratory retention and acute toxicity of furan[J]. American Industrial Hygiene Association Journal,1979,40(4):310-314.
[31] Burka L T,Washburn K D,Irwin R D. Disposition of[14C]furan in the male F344 rat[J]. Journal of Toxicology and Environmental Health,1991,34(2):245-257.
[32] National Toxicology Program. Toxicology and carcinogenesis studies of furan(CAS No. 110-00-9)in F344-N rats and B6C3Fl mice(gavage studies)[J]. National Toxicology Program Technical Report Series,1993,402:1-286.
[33] 馮新昌,李擁軍. 食品中吠喃的檢測方法研究進展[C]//西北地區第七屆色譜學術報告會暨甘肅省第十二屆色譜年會論文集. 蘭州:中國化學會,甘肅省化學會,2012:26-28.
[34] 封麗紅,蔡海霞,吳偉. 氣相色譜頂空進樣方法的改進[J]. 山西建筑,2010,36(4):203-204.
[35] Altaki M S,Santos F J,Galceran M T. Analysis of furan in foods by headspace solid-phase microextraction:Gas chromatography-ion trap mass spectrometry[J]. Journal of Chromatography A,2007,1146(1):103-109.
[36] Yaylayan V A. Precursors,formation and determination of furan in food[J]. Journal für Verbraucherschutz und Lebensmittelsicherheit,2006,1(1):5-9.
責任編輯:周建軍
The Mechanism of Furan Formation in Heat-processed Food
ZHANG Ying1,LIANG Yuhang1,ZHANG Jian2,Lü Xiaoling1
(1. Key Laboratory of Food Nutrition and Safety,Ministry of Education,College of Food Engineering and Biotechnology,Tianjin University of Science & Technology,Tianjin 300457,China;2. Key Laboratory of Industrial Fermentation Microbiology,Ministry of Education,College of Biotechnology,Tianjin University of Science & Technology,Tianjin 300457,China)
Furan is a cyclic enol ether which commonly exists in heat processed food. It has been classified as “possibly carcinogenic to humans” in group 2B by the International Agency for Research on Cancer(IARC). Reducing the furan content in heat processed food as much as possible can effectively improve food safety and elucidating the mechanism of furan formation in heat processed food is the premise and basis of the regulation of furan content in foods. Therefore,on the basis of the molecular route and influential factors of furan formation in thermally processed foods,we give a comprehensive overview of relevant researches on furan formation mechanism in recent years,thoroughly analysed and summarizedthe inadequacies of existing researches,and then proposed a corresponding solution.
furan;heat-processed food;formation mechanism
TS207.3 文獻標志碼:A 文章編號:1672-6510(2015)01-0001-08
10.13364/j.issn.1672-6510.20140034
呋喃(furan),分子式為C4H4O,是一種小分子環狀烯醚,具有無色、芳香、親脂和易揮發(沸點31,℃)的特性[1].很久以前,人們就在多種食品中發現了呋喃的存在,然而直到1995年,國際癌癥研究機構(IARC)發現呋喃是鼠的強致癌物,并將呋喃歸類為可能使人類致癌的“2B”類致癌物后[2],人們才逐漸認識到呋喃的危害性.2004年,美國食品藥品監督管理局(FDA)發布數據顯示,在很多經過加熱處理的食品中檢出了危害物呋喃[3];之后,歐盟食品安全局(EFSA)等也都報道從11大類的受檢食品中發現了呋喃[4].鑒于食品中存在的呋喃可能會引起潛在的消費恐慌,2005年9月1日,FDA出臺了行動綱要,對食品中呋喃的暴露情況及其對人體的潛在影響進行深入研究.通過研究,FDA與EFSA的科研人員發現含有呋喃的食品幾乎都經過熱加工處理,其含量高的食品則大多是罐裝食品[3,5].
人們已經認識到,要提升熱加工食品的安全性,必須盡可能降低其中的呋喃含量,而闡明食品中呋喃的形成機制,則是調控熱加工食品中呋喃含量的前提和基礎,意義深遠.在2010年之前,除了寥寥幾篇關于食品中呋喃檢測的文章[6-7]外,國內關于“食品中呋喃的形成機制”的報道極為少見.相比而言,國外學者圍繞“食品中危害物呋喃”做了更多的研究工作.因為人們對危害物呋喃的重視始于2004年,所以大量的呋喃相關報道都出現在2004年以后,內容主要涉及食品中呋喃的檢測方法、毒理學評估、暴露監測、行為效應和形成機制等方面.因為食品基質成分復雜,相態各異,且加工方式多樣,對食品中危害物呋喃的生成、釋放、消長和定量都有很強的干擾,所以現有的關于“呋喃形成機制”的研究多是在簡化的一元(單一前體)或二元(兩種前體)模擬體系中,模擬燒烤或蒸煮(滅菌)條件進行的,所取得的研究進展主要包含以下兩個方面.
2014-03-19;
2014-07-10
國家自然科學基金資助項目(31201354,31101275)
張 穎(1978—),女,天津人,高級實驗師;通信作者:呂曉玲,教授,lxling@tust.edu.cn.

