MnO2-CuO-CeO2復合催化劑的制備及處理化工集裝罐清洗廢水的應用
李桂菊,田 明,朱麗香,孟攀攀
(天津市海洋資源與化學重點實驗室,天津科技大學海洋科學與工程學院,天津 300457)
MnO2-CuO-CeO2復合催化劑的制備及處理化工集裝罐清洗廢水的應用
李桂菊,田 明,朱麗香,孟攀攀
(天津市海洋資源與化學重點實驗室,天津科技大學海洋科學與工程學院,天津 300457)
針對非均相貴重金屬催化劑成本高,非均相過渡金屬催化劑性能良好、成本低,但使用壽命短、易流失的特點,研制高效復合MnO2-CuO-CeO2非均相過渡金屬催化劑.采用正交實驗對催化劑制備過程中的n(Cu)∶n(Mn)、Ce的摩爾分數、焙燒溫度、焙燒時間進行探討,確定最佳制備條件,并對其結構和組成通過掃描電鏡分析、X射線衍射分析及熱重分析進行表征.用該催化劑催化氧化模擬苯酚廢水,對催化劑用量、氧化劑H2O2用量、反應溫度、反應時間進行優化,確定最佳反應條件并利用其進行降解化工集裝罐清洗廢水的應用研究.研究表明催化劑MnO2-CuO-CeO2的最佳制備條件為:n(Cu)∶n(Mn)=4∶6、Ce的摩爾分數為10%、焙燒溫度為600,℃、焙燒時間為4,h.催化氧化法處理苯酚廢水的最佳工藝參數:催化劑用量0.8,g/L、H2O2用量與COD比值為3、反應溫度170,℃、反應時間1,h.化工集裝罐清洗廢水COD去除效果顯著,COD去除率達到95%左右.
MnO2-CuO-CeO2催化劑;制備方法;催化氧化;集裝罐清洗廢水
隨著物流業的迅速發展,越來越多的化工貨物利用集裝罐裝運,裝過危險貨物或其他化學品的集裝罐不同程度地受到所裝貨物的污染.按國際貨物運輸的規定,集裝罐在具備清潔、干燥、無異味的基本條件后才能再次使用,因此,開展化工集裝罐清洗業務勢在必行.洗罐中產生的廢水種類多、濃度高,難生物降解,容易對環境造成污染.其危害不亞于各種工業廢水,對周圍環境的污染日益嚴重[1-3],迫使人們從科學上和技術上重視新的水凈化技術的開發[4-7],以保護自然資源和環境.多組分催化劑濕式催化氧化處理(CWO)是一項非常有前景且可行的技術,能有效礦化許多難生物降解污染物、有害或難以用傳統生物方法處理的有機底物[8-9].但是,貴金屬催化劑需要高溫(>473,K)條件下才能進行濕式催化氧化,從經濟角度考慮不適合常規應用[10].因此,研制一種有效而價格低廉的濕式催化氧化催化劑迫在眉睫.鐵、銅和錳催化劑被認為是非常有效的CWO催化劑[11-14],因此,與貴金屬系催化劑相比,多組分過渡金屬仍然是更佳的選擇.
本研究通過沉淀法制備了MnO2-CuO-CeO2催化劑,確定了制備方法及最佳制備條件,并對催化劑的性能進行了表征.利用該催化劑進行了應用實驗,為環境中難降解的有機污染物的去除提供了一個簡單、方便、有工業應用前景的新方法.
1 實 驗
1.1 實驗裝置
本實驗采用大連通達反應釜廠生產的磁力驅動高壓反應釜,主要結構包括熱電偶、高壓釜體、加熱外套、磁力攪拌器、控制儀等,具體結構如圖1所示.

圖1 濕式催化氧化反應裝置簡圖Fig. 1 Diagram of wet oxidation reactor
1.2 催化劑的制備與表征
1.2.1 催化劑的制備方法
將1,mol/L的硝酸銅溶液、1,mol/L硝酸錳溶液按一定比例混合,分別在每種比例的混合溶液中加入一定量的濃度為1,mol/L的硝酸鈰溶液,在恒溫磁力攪拌器上利用電節點溫度計控溫,邊攪拌邊加熱至所需反應溫度(50,℃),到達反應溫度后待溫度穩定,以5,s一滴的速度向混合鹽溶液中滴加沉淀劑(氨水)并不斷攪拌,直到溶液pH達到8.7后停止沉淀劑的滴入,保持反應溫度并繼續攪拌陳化3,h,達到陳化時間后,撤走熱源繼續攪拌至室溫,將冷卻后的混合物用蒸餾水進行充分濾洗,所得濾餅放入恒溫干燥箱內在105,℃的溫度下烘干過夜,烘干后用研缽研成粉末,再放入馬弗爐中在實驗所設定的溫度下焙燒一定時間,制得MnO2-CuO-CeO2復合催化劑.
1.2.2 催化劑制備條件的篩選
采用正交實驗考察制備因素n(Cu)∶n (Mn)、Ce的摩爾分數、焙燒溫度、焙燒時間對催化活性的影響.表1為4因素3水平正交實驗的設計.

表1 正交實驗的設計Tab. 1 Design of the orthogonal experiment
1.2.3 催化劑的表征
為了觀察催化劑表面細致的形貌,了解催化劑表面的微觀結構,采用JEOL公司JSM-6380LV型掃描電鏡對催化劑進行形貌分析.
采用美國TA公司的Q50TGA型熱分析儀進行熱重實驗,實驗中通入流量為60,mL/min的氮氣以保持動態氣氛,實驗終溫為900,℃,升溫速率為10,℃/min.通過熱重分析可以分析催化劑在熱處理過程中的失水、分解、結晶等現象.
采用日本Rigaku公司D/max 2500型X射線衍射儀測定催化劑的晶體結構.測試條件:Cu靶(λ= 1.540,6,nm)作為X射線源,掃描速度為8°/min,掃描范圍10°~90°.
1.3 工藝條件的確定
利用自制的催化劑,探討催化劑用量、氧化劑H2O2用量、反應溫度、反應時間對模擬苯酚廢水的濕式催化氧化降解的影響.實驗采用單因素實驗法,初始工藝條件為:反應溫度170,℃、反應時間1,h、H2O2投加量為原水COD的3倍、催化劑用量為1.0,g/L.改變其中任意一個條件,以處理后COD去除率為評價指標,進行單因素實驗,確定適宜的工藝參數.
1.4 應用實驗
利用自制的多組分催化劑,對化工集裝罐清洗下來的10種清洗廢水,在最佳工藝條件下進行催化氧化應用實驗,通過COD的去除率,評價其實際應用的前景.
2 結果與討論
2.1 催化劑制備條件的篩選
根據4因素3水平正交實驗,制備9種不同的催化劑,并在相同反應條件下,即:取200,mL苯酚模擬廢水(初始COD為1,600,mg/L,pH為5.16)、按照1.0,g/L加入催化劑、過氧化氫加入量為COD的3倍、反應溫度為170,℃、反應時間為1,h,通過COD的去除率確定9種催化劑的催化性能,正交實驗結果見表2.

表2 正交實驗結果Tab. 2 Results of the orthogonal test
由表2可知4個影響因素的顯著水平為:n(Cu)∶n(Mn)>焙燒時間>焙燒溫度>Ce的摩爾分數.金屬Ce對催化劑的性能影響最小,是因為其主要作用是防止催化劑活性組分的流失,提高催化劑的使用壽命[1].由表2可以確定催化劑制備條件最佳組合為A3B2C3D2,即,n(Cu)∶n(Mn)=4∶6、Ce的摩爾分數20%、焙燒溫度600,℃、焙燒時間4,h.以最佳組合制備的催化劑處理模擬廢水后出水COD為178.63,mg/L,COD的去除率為88.84%.與第7組相比較,最佳組合去除率略低,最終確定銅錳鈰系列催化劑最佳制備條件為n(Cu)∶n(Mn)=4∶6、Ce的摩爾分數10%、焙燒溫度600,℃、焙燒時間4,h.
2.2 催化劑的表征
2.2.1 掃描電鏡分析
圖2是最佳條件下制備的催化劑的掃描電鏡圖.由圖2可知:該催化劑顆粒非常細,有晶體結構.研究[15]表明催化劑中的小半徑的Cu、Mn取代了CeO2中的大半徑的Ce,進入到CeO2晶格中,從而產生很多的表面空位,形成缺陷結構,加快了供氧速度,從而提高了催化劑活性.

圖2 催化劑的掃描電鏡圖Fig. 2 SEM photograph of the catalysts
2.2.2 X射線衍射分析
最佳條件下制備的催化劑的XRD圖譜如圖3所示.由圖3可知:該催化劑的活性成分為CeO2、CuO和MnO2.在600,℃焙燒后,3種金屬都處于高價態,因此其活性會較高[16].

圖3 催化劑的XRD圖譜Fig. 3 XRD pattern of the catalysts
2.2.3 熱重分析
對最佳制備方法制備的催化劑進行熱重分析.結果如圖4所示.圖4中TG曲線上在700~830,℃有一個顯著失重,可能是由于3種金屬氧化物的受熱分解造成的.通過各催化劑的TG曲線可以看出,該催化劑熱穩定性好.
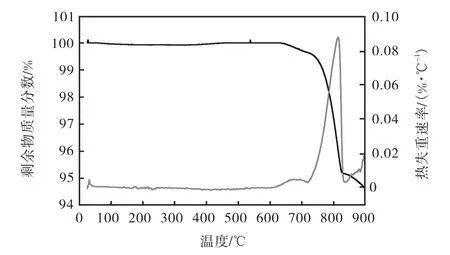
圖4 催化劑TG-DTG曲線Fig. 4 TG-DTG curve of the catalysts
2.3 工藝條件的選擇
2.3.1 催化劑用量
取質量濃度為0.4,g/L(COD約為1,000,mg/L)的模擬苯酚廢水200,mL,加入3,g/L的H2O2作為氧化劑,催化劑用量分別取0.5、0.8、1.0、1.5,g/L,將混合液放入反應釜內,調節反應溫度為170,℃,反應時間為1,h,考察其對COD的去除率的影響,確定最佳的催化劑用量,結果如圖5所示.
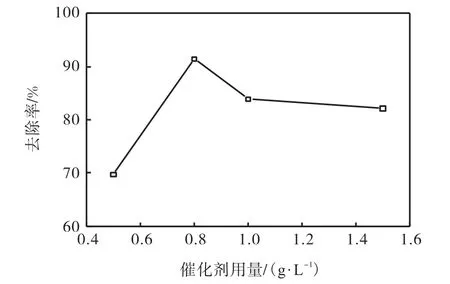
圖5 催化劑用量對COD去除率的影響Fig. 5 Effect of the dosage of catalyzer on COD removal rate
由圖5可知:催化劑用量由0.5,g/L增加到0.8,g/L,出水COD去除率由69.7%升到91.4%,繼續增加催化劑用量,出水COD去除率則開始下降;當催化劑用量為1.5,g/L時,出水COD去除率降到82.1%,所以最佳催化劑用量為0.8,g/L.
分析原因,Mn+的催化氧化反應機理為:Mn+首先與H2O2作用產生M(n-1)+和HO2·,M(n-1)+和HO2·再分別與H2O2反應產生氧化性更強的HO·,HO·進攻有機物RH,引發自由基反應,達到氧化降解有機物的目的.反應機理[12]表示如下:


過量的Mn+抑制反應機理中式(2)的正向進行,因而在相同的反應時間內不僅使產生HO·減少,而且使反應體系中存在大量的M(n-1)+而發生式(4),消耗HO·,導致苯酚去除率稍有所降低.
2.3.2 氧化劑H2O2用量
取質量濃度為0.4,g/L(COD約為1,000,mg/L)的模擬苯酚廢水200,mL,加入0.8,g/L催化劑,氧化劑用量為變量,分別控制H2O2用量為2、3、4、5,g/L(即H2O2用量與原水COD的比值分別為2、3、4、5),將混合液放入反應釜內,調節反應溫度為170,℃,反應時間為1,h,考察其對COD的去除情況,結果如圖6所示.
從圖6可以看出:隨著H2O2用量的增加,處理后苯酚廢水的COD去除率增加,當H2O2用量為3,g/L時,COD去除率達到最高值91.7%;而繼續增加H2O2用量處理后苯酚廢水的COD去除率反而降低.即,H2O2用量與原水COD的比值為3時,COD去除效果最好.分析原因,當H2O2用量較低時,由式(2)知,產生HO·的數量自然就減少.另外,由于H2O2是HO·的捕捉劑,H2O2用量過高時又會使產生的HO·大大減少.
2.3.3 反應溫度
取質量濃度為0.4,g/L(COD約為1,000,mg/L)的模擬苯酚廢水200,mL,加入0.8,g/L催化劑,加入3,g/L H2O2,將混合液放入反應釜內,分別在130、150、170、190,℃下反應,反應時間為1,h,考察其對COD的去除情況,結果如圖7所示.
由圖7可以看出:當溫度從130,℃升到170,℃,苯酚廢水COD去除率從58.3%明顯增加到90.1%,說明反應溫度對H2O2發生均裂產生HO·的影響很大,反應溫度越高,吸收的能量越高,O—O越容易斷裂,產生的HO·越多,對氧化降解苯酚越有利.在170,℃后再提高溫度,COD去除率基本不變,而且在170,℃去除率已經達到90.1%,從能耗角度考慮,選擇最佳反應溫度為170,℃.
2.3.4 反應時間
取質量濃度為0.4,g/L(COD約為1,000,mg/L)的模擬苯酚廢水200,mL,加入0.8,g/L催化劑,加入3,g/L H2O2,將混合液放入反應釜內,反應溫度為170,℃,將反應時間作為變量,反應0.5、1、1.5、2,h,考察其對COD去除率的影響,結果如圖8所示.由圖8可知:反應體系的苯酚廢水COD去除率隨時間的增加先不斷上升,當去除率達到91.4%以后略有下降.理論上講,反應時間越長對降解苯酚越有利,從經濟角度考慮,選擇最佳反應時間為1,h.

圖8 反應時間對COD去除率的影響Fig. 8 Effect of reaction time on COD removal rate
2.4 應用實驗
選10種典型的化工集裝罐清洗廢水,利用自制的催化劑,根據上述實驗得出的最佳操作條件(催化劑用量0.8,g/L、氧化劑H2O2用量與COD的比值為3、反應溫度170,℃、反應時間1,h)進行催化氧化處理,結果見表3.

表3 清洗廢水的水質指標Tab. 3 Water quality index after treatment
從表3可以看出,濕式催化氧化工藝對化工集裝罐清洗廢水的處理效果非常顯著,COD去除率達到95%左右.
3 結 論
(1)通過沉淀法制備復合非均相MnO2-CuO-CeO2催化劑.通過正交實驗得出各影響因素對催化劑制備的顯著水平為:n(Cu)∶n(Mn)>焙燒時間>焙燒溫度>Ce的摩爾分數.催化劑制備的最優條件是:n(Cu)∶n(Mn)=4∶6、Ce的摩爾分數10%、焙燒溫度600,℃、焙燒時間4,h.其活性成分為CeO2、CuO和MnO2.
(2)利用該催化劑,在催化劑用量0.8,g/L、氧化劑H2O2用量與COD的比值為3、反應溫度170,℃、反應時間1,h的工藝條件下對常見的10種化工集裝罐清洗廢水進行催化氧化處理,處理效果顯著,COD去除率都達到95%左右.處理后的水可以作為化工集裝罐清洗水回用,實現節能減排.
[1] Li G J,Lei G X,Zhang J,et al. Catalytic wastewater treatment from chemical container cleansing[J]. Russian Chemical Bulletin,2010,59(8):1523-1527.
[2] 高廷耀,陳洪斌,夏四清,等. 我國水污染控制的思考[J]. 給水排水,2006,32(5):9-13.
[3] 雷崗星,李桂菊,朱麗香. 濕式催化氧化法處理罐式集裝箱清洗廢水的研究[J]. 水處理技術,2009,35(4):89-92.
[4] Comninellis C,Pulgarin C. Anodic oxidation of phenol for waste water treatment[J]. Journal of Applied Electrochemistry,1991,21(8):703-708.
[5] Alnaizy R,Akgerman A. Advanced oxidation of phenolic compounds[J]. Advances in Environmental Research,2000,4(3):233-244.
[6] 蔡乃才,簡翠英,董慶華. TiO2光催化劑表面載鉑方法的研究[J]. 催化學報,1989,10(2):137-142.
[7] 鐘理,陳建軍. 高級氧化處理有機污水技術進展[J].工業水處理,2002,22(1):1-5.
[8] Arena F,Trunfio G,Negro J,et al. Optimization of the MnCeOxsystem for the catalytic wet oxidation of phenol with oxygen(CWAO)[J]. Applied Catalysis B:Environmental,2008,85(1/2):40-47.
[9] Miranda B,Díaz E,Ordó?ez S,et al. Oxidation of trichloroethene over metal oxide catalysts:Kinetic studies and correlation with adsorption properties[J]. Chemosphere,2007,66(9):1706-1715.
[10] 董岳剛,嚴蓮荷,趙曉蕾,等. 濕式催化氧化法廢水處理中催化劑和實驗條件的優選[J]. 精細化工,2002,19(3):149-151.
[11] 張文兵. 均相和非均相高級氧化技術處理水中有機污染物的研究[D]. 廣州:中國科學院研究生院(廣州地球化學研究所),2003.
[12] 何莼,奚紅霞,張嬌,等. 沸石和活性炭為載體的Fe3+和Cu2+型催化劑催化氧化苯酚的比較[J]. 離子交換與吸附,2003(4):289-296.
[13] Ho?evar S,Kra?ovec U O,Orel B,et al. CWO of phenol on two differently prepared CuO-CeO2catalysts[J]. Applied Catalysis B:Environmental,2000,28(2):113-125.
[14] Neri G,Pistone A,Milone C,et al. Wet air oxidation of p-coumaric acid over promoted ceria catalysts [J]. Applied Catalysis B:Environmental,2002,38(4):321-329.
[15] Shan W J,Feng Z C,Li Z L,et al. Oxidative steam reforming of methanol on Ce0.9Cu0.1Oycatalysts prepared by deposition-precipitation,coprecipitation,and complexation-combustion methods[J]. Journal of Catalysis,2004,228(1):206-217.
[16] 潘履讓. 固體催化劑的設計與制備[M]. 天津:南開大學出版社,1991.
責任編輯:周建軍
Preparation of Composite Catalyst MnO2-CuO-CeO2and Treatment of Wastewater from Chemical Container Cleaning
LI Guiju,TIAN Ming,ZHU Lixiang,MENG Panpan
(Tianjin Key Laboratory of Marine Resources and Chemistry,College of Marine Science and Engineering,Tianjin University of Science & Technology,Tianjin 300457,China)
Aiming at the high cost of heterogeneous catalysts of noble metals and theshort service life of heterogeneous transition metal catalysts which are easy to drain,an efficient heterogeneous transition metal catalyst was studied with MnO2-CuO-CeO2as the active component. The effects of the molar ration of Cu-Mn,molar percentage of Ce,calcination temperature and calcination time on the performance of the composite catalyst MnO2-CuO-CeO2were explored. The optimal preparation conditions were determined with orthogonal experiment and the structure and composition of the catalysts were characterized with scanning electron microscopy(SEM),X-ray diffraction(XRD)and thermal analysis(TA). The technical parameters such as the dosages of oxidant(H2O2)and catalyst,reaction time and temperature were studied by treating simulated phenol wastewater. Eventually,practial research on the treatment of the cleaning wastewater of containers was carried out under the optimal technological conditions. The results showed that the optimum preparation conditions were achieved when the molar ratio of Cu-Mn was 4∶6,the molar percentage of Ce was 10%,calcination temperature 600,℃ and calcination time 4,h. The optimum treatment efficiency was achieved when the dosage of catalyst was 0.8,g/L,the molar ratio of H2O2to COD was 3∶1,reaction time 1,h and reaction temperature 170,℃. The COD removal rate of the waste water of ten categories of containers cleaning wastewater was about 95%.
MnO2-CuO-CeO2catalyst;preparation method;catalytic oxidation;wastewater from chemical container cleaning
X703.1 文獻標志碼:A 文章編號:1672-6510(2015)01-0067-06
10.13364/j.issn.1672-6510.20140078
2014-05-19;
2014-11-01
李桂菊(1969—),女,黑龍江人,教授,liguij@tust.edu.cn.

