乙酸甲酯催化加氫制乙醇工藝
楊天宇,曹祖賓,韓冬云,趙榮祥,李秀萍,鄧小丹,王艷清
(1 遼寧石油化工大學化學化工與環境學部,遼寧 撫順 113001;2 中國寰球工程公司遼寧分公司,遼寧 撫順 113006;3 中國石油撫順石化公司石油三廠,遼寧 撫順 113001)
乙醇作為一種重要的化工原料和有機溶劑,廣泛應用于化工、醫藥、農藥、食品工業以及香料、化妝品等行業[1]。國內對用于基礎化工原料及稀釋劑的乙醇的總需求量逐年遞增,目前乙醇的年需求量已經迫近400 萬噸/年,預計年增長量為8%~10%[1]。2013 年最新數據顯示,我國的乙醇總產量為420 萬噸/年。乙醇還是一種清潔、綠色、高辛烷值的汽油添加劑,作為可再生液體燃料的代表之一,燃料乙醇可補充化石燃料資源、降低石油資源對外依存度、減少溫室氣體和污染物排放[2],值得在能源市場進行推廣。在原油價格日益走高的形勢下,乙烯水合法制乙醇的經濟性不被看好。因此,開辟非糧食非石油路線乙醇制備的新途徑,有效降低工業乙醇生產成本,具有極大的現實意義[3]。
煤、天然氣、生物質等通過氣化手段制得合成氣,再由合成氣制乙醇,是當前熱門的研究路線。由合成氣制乙醇有直接法[4]和間接法兩大類,各有優缺點。乙酸直接加氫工藝具備工藝流程短的優點,可以省去酯化步驟,但是存在加氫催化劑昂貴、乙酸轉化率低、設備腐蝕和產品分離能耗大的缺點[5]。相比較而言,乙酸酯化加氫主要是利用價格較低的銅基催化劑,除了酯化塔外,其余設備無須特殊材質,設備投資小,并且可以同時生產乙酸酯和乙醇兩種產品。對于副產乙酸酯充足的企業,通過酯加氫生產乙醇是更好的選擇[6]。
20 世紀80 年代,BASF 公司開發了一種乙醇連續生產和多步蒸餾技術,先由甲醇羰基化合成乙酸甲酯和乙酸,乙酸甲酯分離出來后利用銅基催化劑加氫為乙醇[7]。國外的Enerkem 公司申請了乙酸酯加氫制乙醇的相關專利[8]。BP 公司近年開發了酯加氫法制乙醇技術,發現進料水含量有重要影響,適量的水可提高時空產率、轉化率和選擇性[9]。國內的西南化工研究設計院對乙酸酯化加氫制乙醇技術進行了研究,利用Cu/SiO2催化劑,在250℃、2.5MPa條件下進行乙酸甲酯加氫反應,得出乙醇的選擇性為57%,時空收率為0.7g/(g 催化劑·h)[10]。江蘇丹化公司開發了乙酸酯加氫制乙醇的催化劑及方 法[11-12]。2013 年初,四川維尼綸廠公布了其乙酸甲酯加氫制乙醇工藝的小試結果:甲酯含量<2%,乙酯含量<1%,甲醇含量51%左右,乙醇含量47%左右。2014 年2 月,中國石化上海石油化工研究院與四川維尼綸廠共同承擔的“280kt/a 乙酸甲酯利用項目工藝包”通過了中國石化公司相關的技術審查。
以往的文獻尚無Cu-Zn-Al2O3催化劑應用于乙酸甲酯加氫的案例,因此本工作將該催化劑用于乙酸甲酯加氫工藝當中,與以往的報道相比,乙酸甲酯的轉化率、乙醇的選擇性和目的產品含量都有很大程度的提高。在不同溫度、壓力、原料配比、空速等操作條件下考察乙酸甲酯加氫反應的效果,并根據結果優選確定最佳的工藝條件參數。利用乙酸甲酯為原料,既可以緩解乙酸產能過剩的現狀,又能開拓乙酸及乙酸酯加氫生產乙醇新工藝路線。
1 實驗部分
1.1 主要儀器與試劑
PCF 型50mL 加氫實驗反應裝置(沈陽施博達儀器儀表有限公司),SP-2100A 型氣相色譜儀(北京北分天普儀器技術有限公司)。乙酸甲酯(質量分數≥99.7%),高純氫(遼寧省撫順市工業氣體廠)。本文采用由沉積沉淀法制備的Cu-Zn 催化劑,主要性質見表1。

表1 催化劑主要性質
1.2 合成方法
以乙酸甲酯和氫氣為原料催化加氫制乙醇的工藝流程如圖1 所示。稱取一定質量的乙酸甲酯注入進料罐,通過調壓閥調節H2壓力至實驗所需壓力。待H2充滿整個系統,升溫至反應溫度開始反應。反應在180~300℃、8~10h、2~10MPa 以及氫氣/乙酸甲酯(摩爾比)2.0~20 的條件下進行,待反應完成后,從產品罐取出液體產品,并采用氣相色譜分析混合產物組成。
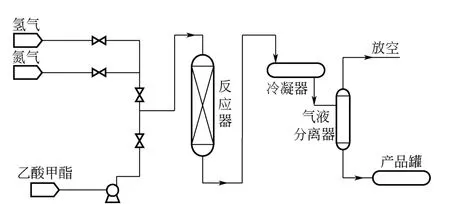
圖1 乙酸甲酯加氫合成乙醇工藝流程
1.3 反應機理
乙酸甲酯加氫主反應方程如式(1)。
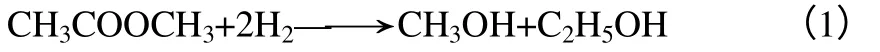
關鵬博[13]對酯類加氫工藝研究得到的反應機理如式(2)。
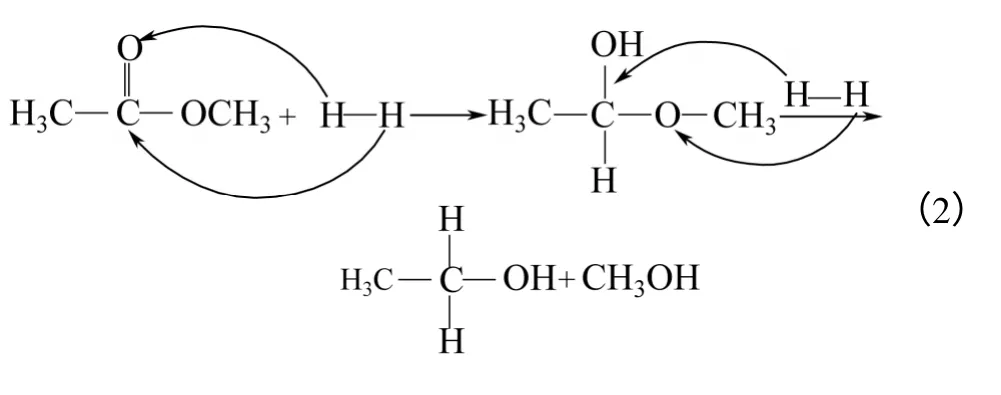
(1)化學吸附 氫氣在金屬銅表面上發生化學吸附,如式(3)。
乙酸甲酯和金屬銅表面化學吸附的氫形成雙位吸附,如式(4)。
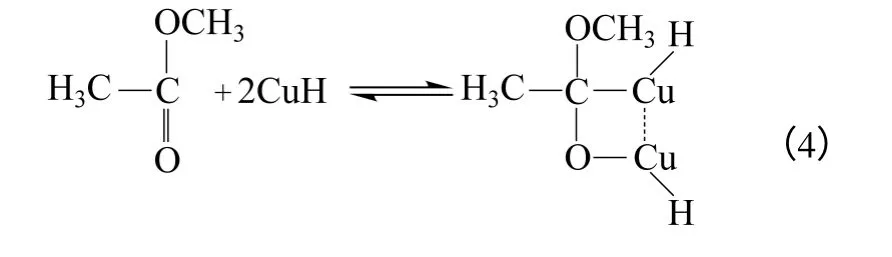
(2)表面反應 化學吸附的乙酸甲酯和化學吸附的氫在金屬銅表面上進行反應,如式(5)、式(6)。
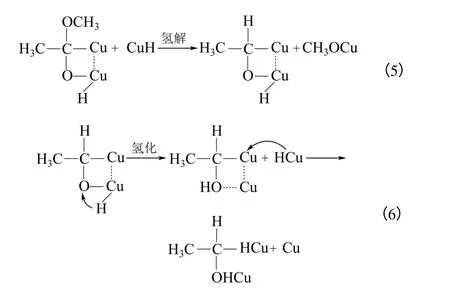
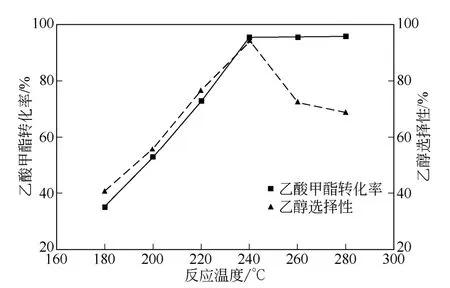
圖2 溫度對加氫反應的影響
(3)化學脫附 在金屬銅表面進行反應生成的物質發生化學脫附,如式(7)、式(8)。
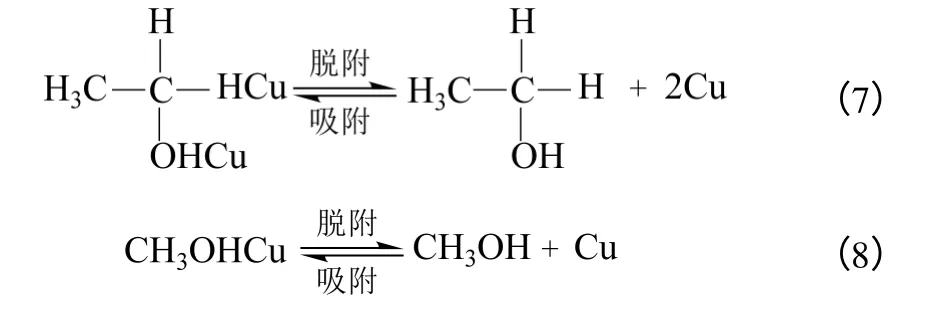
乙酸甲酯分子在催化劑表面發生解離,生成乙酰基和甲氧基,二者分別在銅基催化劑表面加氫得到乙醇和甲醇。
1.4 分析方法
產物中的主要成分為甲醇、乙醇、乙酸甲酯、乙酸乙酯。采用SP-2100A 氣液相色譜儀進行定性定量分析,確定反應產物中各種物質組分的含量。色譜條件:色譜柱為Innowax 毛細管柱,接氫火焰檢測器(FID),Porapark Q 填充柱,接反吹氣體氦氣,色譜載氣為He;氣化室溫度200℃;柱箱溫度為40℃保持5~8min,之后以10℃/min 的升溫速率升至100℃,保持5min;采樣方法為采用10μL 針筒注射器進行快速連續進樣。氣體樣品進樣后進入毛細管柱分離,在FID 上檢測。
2 結果與討論
主要考察溫度、壓力、空速、氫酯比這4 種反應條件對乙酸甲酯催化加氫反應的影響,采用控制變量法進行分析。
2.1 反應溫度的影響
反應溫度是影響反應結果的重要因素之一。在壓力8MPa、液時空速1h-1、氫酯比9∶1 的條件下,在200~280℃溫度范圍內進行反應來考察溫度對乙酸甲酯轉化率和乙醇選擇性的影響。實驗結果見圖2。
由圖2 可以看出,隨著反應溫度的升高,乙酸甲酯的轉化率和乙醇的選擇性整體趨勢呈現先增大后減小。根據加氫反應機理和動力學分析,完全氣化的原料酯與H2組成氣體混合物吸附在催化劑的活性中心上,進而在催化劑表面發生加氫反應,在適宜范圍內,反應溫度越高催化劑表面的化學吸附能力越強,就越有利于乙酸甲酯加氫反應的進行。較高的溫度能夠顯著增大加氫反應速率,減少加氫反應時間,然而從熱力學上考慮,催化加氫為放熱過程,溫度過高不利于乙醇的生成,并且在這種情況下容易發生副反應,致使催化劑失去活性,產品的收率下降。由此可見,乙酸甲酯加氫制乙醇反應的最佳溫度為240℃。
2.2 反應壓力的影響
在溫度240℃、液時空速1h-1、氫酯比9∶1 的條件下,在3~10MPa 壓力范圍內進行反應來考察不同壓力對乙酸甲酯轉化率和乙醇選擇性的影響。結果見圖3。
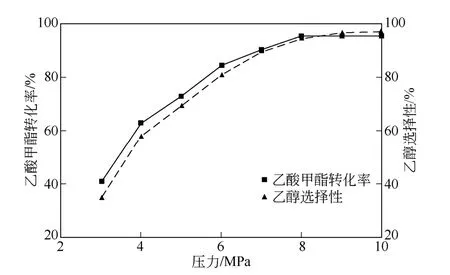
圖3 壓力對加氫反應的影響
如圖3 所示,壓力為8MPa 時,乙酸甲酯的轉化率和乙醇的選擇性達到峰值。究其原因,增大壓力可以增加催化劑活性表面吸附氫氣的能力,提高傳質速率和反應速率,提高原料轉化率。在合理范圍內,提高壓力亦可增大氫氣在混合物中的濃度,促進產物乙醇的生成,同時避免不必要的動力消耗。因此,所探究的最佳反應壓力為8MPa。
2.3 液時體積空速對加氫反應的影響
空速是衡量催化加氫反應效果好壞與否的一個重要指標。空速過大,物料在反應器內停留時間過短,導致乙酸甲酯加氫反應不充分,乙酸甲酯轉化率過低,影響產品質量。反之,如果空速過小,乙酸甲酯在反應器內催化劑表面上的停留時間長,加氫反應進行比較徹底,但在溫度和壓力不變的情況下,可能因過度加氫而增加副產物量。本文在溫度240℃、壓力8MPa、氫酯比9∶1、乙酸甲酯液相體積空速0.5~2.5h-1的條件下進行反應,考察液時空速對乙酸甲酯轉化率和乙醇選擇性的影響。實驗結果見圖4。
從圖4 可以得出,在選定空速范圍內,乙酸甲酯轉化率隨空速增大呈現先增加后減小趨勢,乙醇選擇性逐漸增大,增幅由大變小。反應初期,增大空速,單位時間與氫氣發生反應的原料量增多,使得轉化率增大,達到1h-1后,若繼續增大空速,會 使原料的停留時間變短,導致加氫反應不能充分進行,原料轉化率降低,因而最佳空速條件為1h-1。
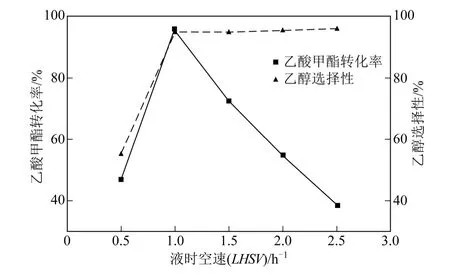
圖4 液時空速對加氫反應的影響
2.4 氫氣與乙酸甲酯摩爾比的影響
反應溫度為240 ℃、反應壓力為8MPa、液時空速為1h-1下,分別在氫酯摩爾比為2∶1,5∶1,9∶1,12∶1,15∶1,20∶1 條件下進行實驗來考察其對乙酸甲酯轉化率及乙醇選擇性的影響。實驗結果見圖5。
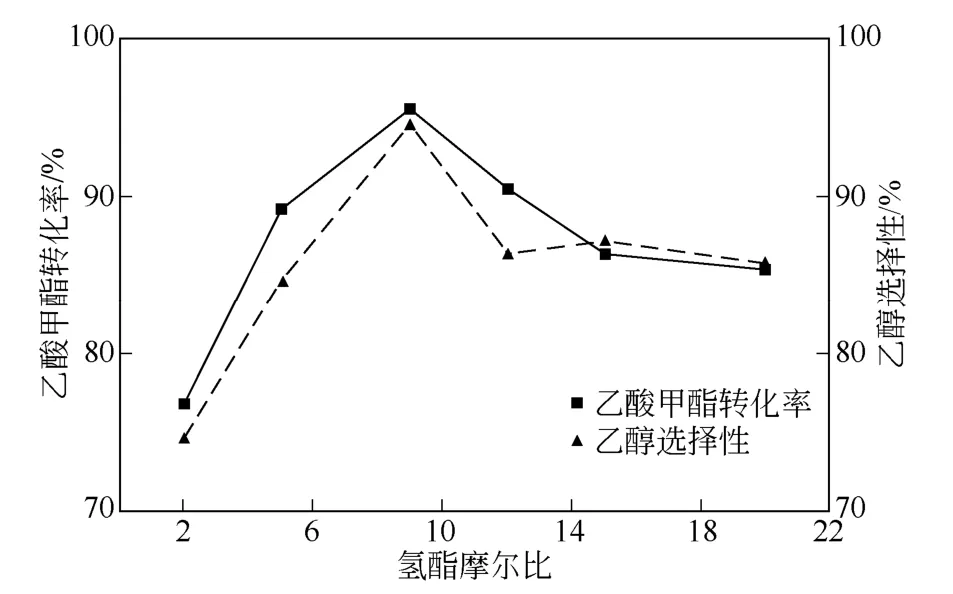
圖5 氫酯比對加氫反應的影響
由圖5 可知,氫酯比為9∶1 時,乙酸甲酯轉化率和乙醇選擇性均達到最大值。氫酯比較大時,氫氣可作為熱載體將反應產生的熱量及時地從反應器內轉移出去,減緩固定床層溫升,使反應在適宜的溫度下進行,有利于提高產物乙醇的選擇性,延長催化劑的使用壽命。然而較高的氫酯比同時會增加氫氣的消耗量和冷氫的注入量,增加動力消耗。因此最佳氫酯比為9∶1。
2.5 乙酸甲酯加氫主要副反應分析
乙酸甲酯催化加氫反應的主要產物是乙醇和甲醇,同時會發生一系列副反應,產生乙酸乙酯、乙醛、乙烯和乙烷等主要的副產物。乙酸乙酯產生的原因是乙酸甲酯與乙醇發生酯交換反應,乙醛是乙醇在銅基催化劑載體表面進行脫氫的產物,一般認為乙烯和乙烷的生成與催化劑活性金屬本身和載體間的協同作用有關。這些反應副產物和中間產物也容易在催化劑表面酸性位上形成積炭,包覆在催化劑上,部分堵塞催化劑孔道,導致催化劑活性下 降[3]。接下來針對主要副反應進行分析。
2.5.1 乙酸甲酯和乙醇的酯交換反應
根據相關文獻,乙酸甲酯催化加氫反應的主要副反應為酯交換反應[式(9)],也有研究者認為這一反應是乙酸甲酯加氫制乙醇反應網絡中的一個中間反應[14]。有研究認為溫度增高,反應時間長都有利于酯交換反應。結合實驗結果分析,在200~300℃區間內,產物乙醇可與乙酸甲酯發生酯交換反應,生成少量乙酸乙酯。

2.5.2 乙醇脫氫生成乙醛
在加氫反應中,乙酸甲酯在銅基催化劑表面以烷氧基和乙酰基兩種形式進行吸附,均可轉化為乙醇。有研究認為乙醛是乙醇發生部分脫氫反應的產物。式(10)為吸熱反應,溫度升高有利于乙醇脫氫生成乙醛,脫氫過程中Cu-Zn-Al 催化劑可起到催化作用,加快反應進程。
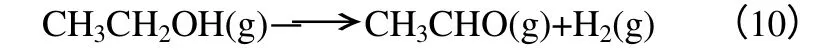
2.5.3 乙醇脫水生成C2烴類
乙酸甲酯加氫制乙醇反應中,乙烯和乙烷是主要的氣體副產物,生成這兩種C2烴消耗了乙醇,降低了銅基催化劑的選擇性。在乙酸甲酯加氫反應中,乙醇催化脫水生成乙烯,乙烯與富裕氫氣發生加成反應生成乙烷,如式(11)、式(12)。
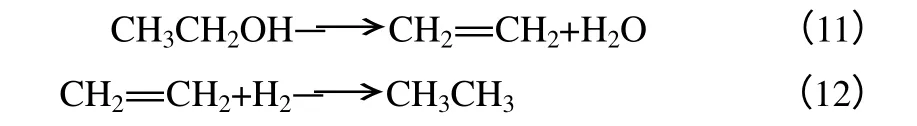
一般認為,反應平衡常數越大,該反應的平衡轉化率越高。有研究者發現,乙醇脫水生成乙烯和乙烯加氫生成乙烷的反應平衡常數都較大,說明乙酸甲酯加氫反應容易生成副產物C2烴。
2.6 最優條件下產品分析
在表2 的最優條件下,液體產品收率為97%,乙酸甲酯的轉化率為 95.5%,乙醇的選擇性為94.6%。其中液體產物的主要成分是甲醇、乙醇、未反應的原料乙酸甲酯以及由酯交換反應生成的乙酸乙酯。液體產物的色譜分析圖如圖6 所示。
如圖6 所示,甲醇、乙醇、未完全反應的乙酸甲酯、主要副產物乙酸乙酯的保留時間分別為2.231min、3.127min、3.672min、6.286min。各組分依次出峰,分離程度較好。液體產物的平衡組成為:甲醇38.12%,乙醇59.52%,乙酸甲酯0.86%,乙酸乙酯1.29%。在最優條件下,乙醇的收率較高,產品中殘留乙酸甲酯和生成的乙酸乙酯所占比例很小,表明該催化劑對羰基加氫的活性較高,對生成乙醇具有較高的選擇性,而對乙酸乙酯的選擇性很低,能夠有效抑制主要副產物乙酸乙酯的生成。

表2 乙酸甲酯加氫制乙醇工藝最優條件
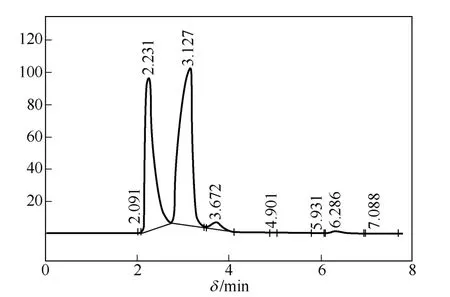
圖6 氣相色譜分析圖
3 結 論
(1)Cu-Zn-Al 催化劑在乙酸甲酯加氫合成乙醇工藝中取得了良好的效果,能夠有效地提高乙酸甲酯加氫反應中乙醇的選擇性,抑制副反應的發生,達到了預期的目標,同時合理地采用較低的氫酯比,減少了氫氣的消耗。適宜的溫度、壓力、液時空速、氫酯比有利于提高乙酸甲酯轉化率以及乙醇的選擇性,減少副反應的發生。實驗得出最佳工藝條件為:溫度240℃、壓力8MPa、乙酸甲酯液相體積空速1h-1、氫氣與乙酸甲酯的摩爾比9∶1。
(2)利用乙酸甲酯催化加氫制取乙醇,既可在一定程度上緩解目前國內乙酸產能過剩的局面,又能夠拓寬乙醇的生產路徑。結合乙酸甲酯、甲醇、乙醇價格以及投資成本考慮,乙酸甲酯催化加氫制備乙醇路線具備良好的經濟性。將達標乙醇添加到燃料汽油中,可以提高燃燒性能,減少環境污染。因此,這一工藝路線既環保,又符合我國的基本國情,具有巨大的現實意義。
[1] 李揚,曾健,王科,等. 醋酸酯化合成乙醇工藝及經濟性分析[J]. 精細化工原料及中間體,2011(11):6-10.
[2] 李振宇,李頂杰,黃格省,等. 燃料乙醇發展現狀及思考[J].化工進展,2013,32(7):1457-1467.
[3] 李永剛,謝璇,尹馮懿,等. Cu/SiO2催化劑上醋酸甲酯加氫制乙醇失活研究[J]. 復旦學報:自然科學版,2012(6):51.
[4] 唐宏青. GSP 工藝技術[J]. 中氮肥,2005(2):14-18.
[5] 王科,李揚,范鑫,等. 乙酸酯化加氫制乙醇技術開發與經濟性分析[J]. 化工進展,2012,31(s1):304.
[6] 王彪,王熙庭,徐國輝. 醋酸和醋酸酯加氫制乙醇技術進展[J]. 天然氣化工:C1 化學與化工,2013(3):79.
[7] Kummer R,Taglieber V,Schneider H W. Continuous production of ethanol and plural stage distillation of the same : US ,4454358[P].1984-12-06.
[8] Chornet E,Avila Y,Lavoie J M,et al.Production of ethanol from methanol:EP,2244993[P]. 2010-03-11.
[9] John D B,Gracey B P. Process for the production of alcohol from a carbonaceous feedstock:EP,20080253656[P]. 2009-05-20.
[10] 西南化工研究設計院. 一種用醋酸酯加氫制備乙醇的催化劑及其制備方法:中國,102423710A[P]. 2012-04-25.
[11] 吳曉金,劉志剛,胡曉鳴,等. 一種醋酸酯加氫制乙醇的催化劑及其制備方法和應用:中國,101934228A[P]. 2011-01-05.
[12] 吳曉金,潘學平,吳維果,等. 一種一氧化碳與氫氣間接合成乙醇的方法:中國,101941887A[P]. 2010-01-12.
[13] 關鵬博.脂肪醇制造與應用[M]. 北京:輕工業出版社,1990:226-227.
[14] Monti D M,Cant N W,Trimm D L,et al.Hydrogenolysis of methyl formate over copper on silicaⅠ:Study of surface species by in situ infrared spectroscopy[J]. J.Catal.,1986,100(1):17-27.

