外周T細胞淋巴瘤非特異型的臨床研究進展
鄧秀文 李曄雄
北京協和醫學院中國醫學科學院腫瘤醫院放射治療科,北京100021
外周T細胞淋巴瘤非特異型的臨床研究進展
鄧秀文 李曄雄#
北京協和醫學院中國醫學科學院腫瘤醫院放射治療科,北京100021
外周T細胞淋巴瘤非特異型(peripheral T-cell lymphoma,not otherw ise specified,PTCL-NOS)是一組臨床表現及生物學行為有明顯異質性的成熟T細胞淋巴瘤。其診斷需結合病理學、遺傳學表現及臨床特征,并排除其他特異型外周T細胞淋巴瘤亞型。PTCL-NOS缺乏明顯的臨床病理特征,病程呈高度侵襲性,預后差,5年生存率僅為20%~40%。由于發病率低,目前尚無標準的治療方案,常規化療療效不佳。日益發展的分子遺傳學技術在PTCL-NOS的診斷、治療及預后判斷上表現出巨大的潛力。
外周T細胞淋巴瘤非特異型;治療;預后;ALK陰性間變大細胞淋巴瘤
外周T細胞淋巴瘤(peripheral T-cell lymphoma,PTCL)是一組起源于胸腺后成熟T淋巴細胞或NK/T細胞的臨床異質性疾病,占非霍奇金淋巴瘤(non-Hodgkin's lymphoma,NHL)的5%~20%[1]。根據WHO 2008分類標準,PTCL包括結外鼻型NK/T細胞淋巴瘤(extranodal NK/T-cell lymphoma,nasal type,EN-NKTCL)、ALK+間變大細胞淋巴瘤(anaplastic large cell lymphoma,ALCL)、ALK-間變大細胞淋巴瘤、血管免疫母T細胞淋巴瘤(angioimmunoblastic T-cell lymphoma,AITL)及 PTCLNOS等。其中PTCL-NOS是指排除其他已知的PTCL獨立病種后診斷的一類疾病,是西方國家最常見的PTCL亞型[2-3]。在中國,其發病率僅次于EN-NKTCL,約占PTCL的15%[4-5]。由于PTCLNOS缺乏明顯的臨床病理特征,治療效果不佳、預后差,近年來受到國內外學者的廣泛關注。
1 病理學和遺傳學表現
20世紀70年代,隨著免疫學的發展,Lukes-Collins及Kiel分類首次以細胞來源作為區分NHL的標準,提出T細胞、B細胞的概念。1994年,國際淋巴瘤研究組提出新的“修訂歐美淋巴瘤分類方案(REAL分類)”,其綜合考慮了病理形態學、免疫表型、細胞來源、遺傳學和臨床特點,第一次明確定義了PTCL和PTCL-NOS。2008年,WHO造血和淋巴組織腫瘤分類繼續提出了三種變異型,即淋巴上皮樣型(Lennert淋巴瘤)、濾泡變異型和T區變異型。
1.1 病理形態
PTCL-NOS的病理形態呈多樣性。主要表現為:淋巴結正常結構被破壞,腫瘤細胞位于副皮質區或彌散浸潤;瘤細胞具有廣泛的形態譜系,可呈多形性或單形性。多為中等大小或大細胞,細胞核形狀不規則,核染色質深或呈泡狀核,核仁明顯,核分裂象多見。可見透明細胞或R-S樣細胞。少數病例以不規則核的小淋巴細胞為主,伴高內皮小靜脈增生;呈多形性炎性背景,其中可見小淋巴細胞、漿細胞、嗜酸性粒細胞、大B細胞及大量的上皮樣組織細胞。另外,Lennert淋巴瘤表現為較多的上皮樣組織細胞成簇分布[6];濾泡變異型表現為瘤細胞集聚在濾泡內,似濾泡性淋巴瘤;T-區變異型的特征則是瘤細胞在淋巴結內呈濾泡周圍生長[7]。
1.2 免疫表型
PTCL-NOS的免疫表型缺乏特異性。PTCLNOS可起源于外周T淋巴細胞的各個分化階段,多為調節免疫系統的中樞記憶型CD4+細胞[8]。淋巴結內原發的免疫表型以CD4+/CD8-病例為主,有時可見CD4/CD8雙陽或雙陰型。瘤細胞多表達成熟的T細胞相關抗原如:CD2、CD3、CD4、CD8,以CD3最常見。其他非特異性T細胞相關抗原(如CD45RO和CD43等)也可陽性表達。多數病例存在T細胞抗原丟失的現象,常表現為CD5和CD7的表達下調。B細胞表面抗原多陰性,但偶爾也可出現CD20和(或)CD79a異常表達。另外,CD56和細胞毒性顆粒蛋白也可呈陽性。細胞增殖指數Ki-67可增高,超過80%為預后不良因素。需要注意的是,部分大細胞型PTCL-NOS可表達CD30,但很少表達CD15。需綜合分析免疫學和形態學特點以鑒別ALCL和霍奇金淋巴瘤[9]。另外,除了濾泡變異型,其他PTCL-NOS均缺乏濾泡T輔助細胞免疫表型(CD10+、BCL-6+、PD1+、CXCL13+)[10-12],這點可與AITL相鑒別。
1.3 基因異常
大多數PTCL-NOS伴有TCR基因克隆性重排,可有克隆性變化導致的復雜核型異常。盡管通過序列比較基因組雜交技術(comparative genom ic hybridization,CGH)已發現不少常見的突變核型,但因核型的結構和數量各不相同,并未確定一種普遍的染色體異常改變[13-15]。
近年,全基因譜表達分析(gene expression profiling,GEP)為更好地理解PTCL-NOS提供了幫助。PTCL-NOS可表現為相關細胞功能基因(如細胞黏附、凋亡、增殖、轉錄及信號轉導等)的改變,這些基因產物可能提供有效的預后判斷分子標志物及潛在的治療靶點。另外,探索一些特定基因的表達有助于更好地鑒別其他PTCL亞型[16-18]。
PTCL-NOS可有EB病毒整合現象,研究報道EB病毒的陽性率可超過40%,且與預后不良密切相關[3,9,19]。
2 臨床表現
PTCL-NOS的臨床特征存在明顯的地域差異。歐美國家報道的發病中位年齡為60~70歲,而我國的發病患者較年輕,多為40~55歲。中西方均為男性發病多見,男女發病比例為2∶1。表1總結了8個PTCL-NOS大樣本回顧性研究的臨床特點。
PTCL-NOS具有高度侵襲性,病程進展迅速。起病時通常以淋巴結增大為首發癥狀,結外部位或器官受累常見,可高達70%。診斷時Ⅰ~Ⅱ期少見,60%~80%為Ⅲ~Ⅳ期。累及淋巴結時,局部表現為淋巴結進行性增大。胸、腹腔深部的增大淋巴結可壓迫鄰進器官引起相應癥狀。結外受累部位多見于脾、韋氏環、皮膚、骨髓、肺和肝,其他部位可見于胃腸道、鼻腔、軟組織、骨等[20]。
目前研究報道的骨髓受累及>1個部位受累的概率均為20%~30%。臨床表現視侵犯的不同部位而定,如肝脾浸潤可表現為肝脾增大;累及鼻咽、口咽時,可表現為鼻塞、流涕、咽痛等;累及皮膚時,多表現為中心潰瘍型皮膚結節[21]。約50%的患者伴有B組癥狀,偶可伴有嗜酸性粒細胞增多癥、皮膚瘙癢和嗜血細胞綜合征等表現[22]。診斷時,30%~50%的患者屬于預后不良的中高危組。
實驗室檢查主要表現為乳酸脫氫酶(lactate dehydrogenase,LDH)、β-微球蛋白及血沉升高。各研究報道的LDH升高比例相似,為40%~65%。
3 治療
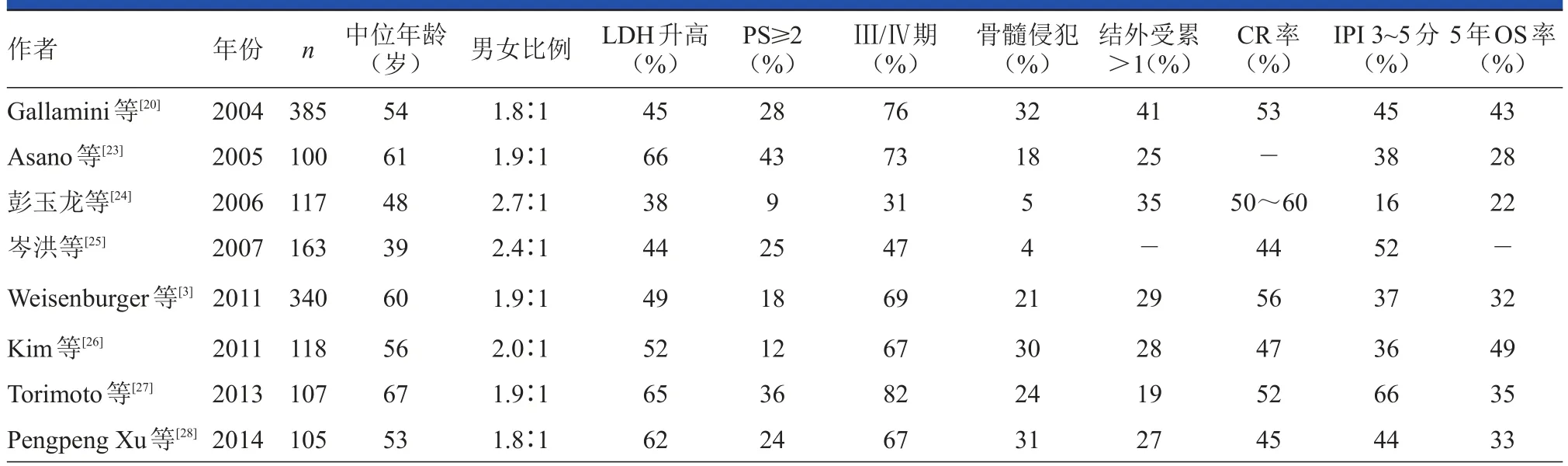
表1 8項大樣本(≥100例)PTCL-NOS臨床特點的回顧性研究
PTCL-NOS并無標準的治療方案。2015年美國癌癥綜合網絡(National Comprehensive Cancer Network,NCCN)指南建議患者應首選參與臨床試驗。若無合適的臨床試驗,則建議進行多藥聯合化療6個周期,加或不加受累區域局部放療。達完全緩解(complete response,CR)的患者可選擇造血干細胞移植(stem cell transplantation,SCT)。可選擇的多藥化療方案包括CHOEP、CHOP-14、CHOP-21、劑量調整的EPOCH等。
3.1 化療方案的選擇
傳統的含蒽環類化療方案為目前PTCL-NOS最常用的一線化療方案。研究報道的CHOP或CHOP樣方案治療獲得CR者約為50%,但由于復發轉移率高,患者的5年無進展生存(progressive free survival,PFS)率僅為20%~30%[3]。治療效果不理想促使研究者希望從改良或探索新的治療方案上來改善PTCL-NOS的預后。
德國NHL研究組的大型隊列研究報道了CHOP或CHOEP方案治療PTCL的結果。數據顯示,對于<60歲的PTCL患者,CHOEP組和CHOP組的3年無事件生存(event free survival,EFS)率分別為75%和51%(P=0.01);而對于老年患者,由于CHOEP組具有較高的不良反應率,聯合依托泊苷的方案并未顯示出預后優勢;對于IPI評價為高危的患者,由于預后極差,無論是CHOP或CHOEP治療獲益均很小。因此,CHOEP方案或許是相對年輕的非高危PTCL患者可選的治療方案[29]。北歐淋巴瘤組織的一項Ⅱ期臨床研究采用CHOEP作為一線方案治療PTCL患者,有效的患者繼續接受自體造血干細胞移植(autologous hematopoietic stem cell transplantation,ASCT),盡管有72%為IPI中高危患者,但CHOEP治療后的總有效率(overall response rate,ORR)仍達82%,獲得CR者也高達51%[30]。基于以上數據,有研究者認為,在可耐受的前提下,CHOEP是一種可選擇的方案。
MD安德森癌癥中心比較了CHOP和強化方案(包括Hyper-CVAD、Hyper-CHOP和三聯替代方案)治療PTCL的療效。研究回顧性分析了135例PTCL患者(包括PTCL-NOS 50例,ALCL 40例,AITL 14例),經CHOP或強化方案治療后,兩組患者的3年OS率分別為62%和56%(P>0.05)。考慮到預后相對較好的ALCL患者多采用CHOP方案,排除ALCL患者后進一步分析顯示兩組患者的預后相似,3年OS率分別是43%和49%。因此,采用比CHOP方案強度更高的加強化療方案并不能明顯改善PTCL患者的療效[31]。
盡管含蒽環類藥物的聯合方案對大部分的PTCL-NOS患者有效,但僅有小部分患者能獲得持續緩解。考慮到PTCL患者可能對蒽環類耐藥,含吉西他濱的化療方案逐漸被用于PTCL-NOS的治療。研究顯示,吉西他濱聯合順鉑治療PTCL(大多為非初治患者)的有效率可達73%[32],而單藥治療復發難治性PTCL,有效率也高達55%[33]。一項意大利的Ⅱ期研究顯示,GIFOX方案(吉西他濱、異環磷酰胺、奧沙利鉑)治療172例PTCL患者(除外ALCL),ORR為82%,CR率為65%。主要不良反應是血液學毒性,4級血小板減少和貧血的發生率分別為13%和23%[34]。以上研究提示吉西他濱為基礎的化療方案對PTCL患者有效,但仍需要進一步與CHOP方案對比研究。
3.2 放療在PTCL-NOS中的價值
放療在臨床上多用于PTCL-NOS早期患者化療后的鞏固治療或化療后失敗的挽救治療。由于PTCL-NOS發病率低且進展期多見,放療在PTCLNOS中的作用研究尚少。
Svoboda等[35]報道了SEER數據庫1981至2010年診斷的307例頭頸部非皮膚原發性PTCL患者(74%為PTCL-NOS,22%為ALCL),早期患者約占77%。結果顯示,局部放療明顯改善了Ⅰ期(63%∶53%,P=0.036)和Ⅱ期(61%∶36%,P=0.034)患者的5年OS率。預后分析顯示放療為OS率的獨立影響因素(HR:0.60,P=0.011)。Petrich等[36]對SEER數據庫2000至2010年診斷的8802例PTCL患者(38%為PTCL-NOS)進行預后分析,結果也提示放療為患者OS率的獨立預后因素,且該研究的亞組分析顯示早期和進展期患者均有生存獲益。
兩項回顧性研究比較了單純化療和放化療聯合治療PTCL-NOS的結果。國際外周T細胞淋巴瘤項目組報道了340例PTCL-NOS患者,亞組分析顯示一線放化療聯合方案(n=25)較單純化療(n= 16)可以明顯改善Ⅰ期患者的OS率(P=0.016)[3]。中國醫學科學院腫瘤醫院分析了1998至2010年診斷的34例早期PTCL-NOS患者,結果顯示兩組患者的臨床特征相似,放化療聯合組(n=21)較單純化療組(n=13)明顯改善了患者的3年PFS率(33%∶15%,P=0.042)及OS率(50%∶23%,P= 0.035)[37]。上述研究提示,聯合放療可以為早期PTCL-NOS患者帶來生存獲益,有必要擴大樣本量及進行前瞻性研究對比分析。
3.3 SCT在PTCL-NOS中的價值
SCT是PTCL研究的熱點領域,由于病例數的限制,針對PTCL-NOS的研究較少。近年來,幾項前瞻性非隨機研究報道了SCT作為鞏固治療對PTCL的作用[30,38-39]。德國于2009年進行了首個前瞻性多中心研究,83例PTCL患者(39%為PTCLNOS)接受4~6個周期CHOP治療后,55例(持續獲得CR或部分緩解且愿意入組的患者)繼續予以高劑量化療聯合ASCT。結果顯示化療后再接受ASCT的患者的CR率提高了約14%;3年OS率為48%,而成功完成了移植的55例患者3年OS率高達71%,明顯優于未接受ASCT的患者(11%)[39]。隨后,北歐研究組進行了目前規模最大的一項前瞻性研究,共納入160例初治PTCL患者(除外ALKALCL),其中81%為Ⅲ、Ⅳ期,患者的初始治療為接受6個周期劑量密集的CHOEP,115例符合條件的患者繼續接受HDT/ASCT。結果顯示,移植后3個月內持續CR率為78%;總體5年OS率和PFS率分別為51%和44%,其中完成SCT患者的5年OS率高達61%;大部分患者能耐受SCT,總體治療相關死亡率為4%。亞組分析顯示,ALK-ALCL患者的預后優于非ALCL患者,其中PTCLNOS患者(n=62)的5年OS率和PFS率分別為47%和38%。ASCT為符合條件的PTCL患者合理的治療方法[30]。ASCT在PTCL的治療中取得了一定的療效,但由于存在病例選擇上的偏倚,ASCT確切的治療價值仍有待隨機對照研究驗證。
3.4 新藥的探索
鑒于PTCL-NOS的治療療效差,越來越多的新藥開始應用于PTCL-NOS的治療中。主要有阿倫單抗(alem tuzumab)、地尼白細胞介素(denileukin diftitox)、普拉曲沙(pralatrexate)、羅米地辛(romidepsin)、brentuximab vedotin(SGN-35)等。
研究顯示,CD52在PTCL中廣泛表達,在PTCL-NOS中的陽性率可達90%以上[39-40]。因此,靶向CD52的單克隆抗體——阿倫單抗逐漸用于PTCL的治療。最大的一項Ⅱ期臨床研究顯示其對PTCL患者療效確切,獲CR者可達71%[41]。基于阿倫單抗前期取得的理想療效,北歐淋巴瘤組和德國淋巴瘤組于2008年啟動了兩項Ⅲ期臨床研究,比較阿倫單抗聯合CHOP-14與CHOP-14單獨作為一線治療的療效,結果有待公布。
地尼白細胞介素為白細胞介素-2——白喉毒素融合蛋白,能靶向作用于表達白介素-2受體的細胞。Ⅱ期研究顯示,其單藥治療27例復發難治T細胞NHL患者,可獲得48%的有效率[42]。而與CHOP方案聯合治療47例初治侵襲性PTCL患者,OR率可達68%,其中57%獲得CR。2年OS率達60%[43]。
普拉曲沙為一種新型的葉酸拮抗劑,研究報道其治療復發或難治性PTCL患者的有效率為29%[44]。美國食品與藥品監督管理局已于2009年批準其為治療復發或難治性PTCL的單用藥物。
其他藥物如羅米地辛、SGN-35等也在復發或難治性PTCL-NOS患者中顯示出良好的療效[45-46],目前正在開展PTCL一線治療的臨床研究。
4 預后
PTCL-NOS治療效果不佳,預后差,5年生存率為20%~40%(表1)。其預后與多種因素相關,主要包括臨床分期、LDH、PS評分、結外器官受累情況、Ki-67、初始治療療效等。另外,年齡、B癥狀、大腫塊、β-微球蛋白、EBV病毒整合、血小板計數、細胞毒性分子表達等其他臨床病理因素也可能與預后有關[3,20]。隨著分子生物學技術的發展,越來越多的分子或基因標志物如核轉錄因子(NF)–κB、T細胞轉錄因子結合蛋白3(GATA-3)等也被證實與PTCL-NOS的預后密切相關[47-48]。
目前在PTCL-NOS中運用較廣泛的主要有4種預后模型:①IPI評分;②外周T非特異型預后指數(prognostic index for PTCL-NOS,PIT);③修訂的PIT(mPIT);④國際外周T細胞淋巴瘤項目評分(IPTCLP)。
IPI預后模型是1993年Shipp在研究2031例侵襲性NHL患者的基礎上建立的,多年的臨床應用顯示該模型對判斷大多數NHL,尤其是彌漫大B細胞淋巴瘤(diffuse large B cell lymphoma,DLBCL)的預后有非常重要的指導意義。不少研究顯示,高IPI評分與PTCL-NOS的不良預后明顯相關,IPI低危組(0~1分)和高危組(4~5分)的5年OS率分別為50%和11%[3]。但是考慮到PTCL具有不同于DLBCL的臨床病理表現和生物學行為,IPI模型能否在PTCL-NOS中顯示出同樣的預測作用,尚存在一定的爭議[9,20]。
2004年,意大利一項多中心回顧性研究認為骨髓受侵為PTCL-NOS的重要預后因素,并在此基礎上提出了PTCL-NOS的新預后指數——PIT[20]。其根據4個危險因素(年齡>60歲、血清LDH增高、PS評分高、骨髓受侵)將患者分為四組,低危到高危組的5年OS率分別為62%、53%、33%和18%。作者認為該模型預后預測價值優于IPI模型,應該在臨床上推廣應用。2006年,Went等[9]繼續將病理因素納入預后模型,對PIT進行了修訂(骨髓受侵更改為Ki-67≥80%),并命名為mPIT模型。后續的一些研究對IPI、PIT及mPIT的預測價值進行了評價,卻并未得出一致的結論[3,26,49]。
2005年,國際外周T細胞淋巴瘤項目組提出了適用于PTCL-NOS和AITL的IPTCLP模型,該模型僅包括年齡、PS評分和血小板計數3個因素[50]。有學者對IPI、PIT、mPIT、IPTCLP四種模型進行了對比分析,發現IPTCLP在PTCL的生存預測方面優于其他模型[51]。然而,一項基于美國SEER數據庫的研究分析了8802例PTCL患者,卻未能得出相似的結論。該研究的學者發現與其他人種相比,黑人的預后更差,應該將種族納入到新的PTCL預后模型,以指導未來的臨床研究[36]。
5 PTCL-NOS與ALK-ALCL的關系
由于PTCL-NOS缺乏特征性的免疫表型及基因表達,其與ALK-ALCL在鑒別診斷上存在一定困難。部分研究顯示兩種疾病有相似的臨床表現和預后。因此,不少研究者提出ALK-ALCL可能是PTCL-NOS的變異型或亞型[52-54]。
近年來隨著基因技術的發展,逐漸發現ALKALCL和PTCL-NOS具有不同的基因表達。Piva等[16]對兩種疾病基因表達序列進行對比發現,由30個基因組成的基因簇能夠很好地鑒別ALKALCL與PTCL-NOS。Agnelli等[55]進行的一項轉錄譜薈萃分析共納入了309例PTCL患者,該學者采用定量逆轉錄-多聚酶鏈反應法,發現由TNFRSF8、BATF3及TMOD1構成的3基因模型能有效地鑒別ALK-ALCL與PTCL-NOS,準確率可高達97%。Piccaluga等[17]開展的有關診斷準確性的Ⅲ期研究發現,基于GEP的分子標志不僅能夠準確地鑒別ALK-ALCL和PTCL-NOS(包括形態學上不確定的CD30陽性PTCL-NOS),還能優化PTCL的預后分層。
一些研究比較了ALK-ALCL和PTCL-NOS的臨床特點。ten Berge等[52]分析了44例ALK-ALCL及45例PTCL-NOS患者,結果顯示兩組患者的5年OS率及PFS率均差異無統計學意義(OS:P= 0.2;PFS:P=0.7)。德國NHL研究組對比分析了113例ALK-ALCL及70例PTCL-NOS患者,也得到了類似的結果,ALK-ALCL的3年EFS率及OS率分別為46%和62%,PTCL-NOS的3年EFS率及OS率分別為41%和54%(OS:P=0.768;EFS:P= 0.720)[29]。2008年國際外周T細胞淋巴瘤協作組的大宗病例報道卻未得出一樣的結論。該研究包括159例ALK-ALCL及331例PTCL-NOS患者,結果表明雖然ALK-ALCL患者PS評分較差且B癥狀更為常見,但ALK-ALCL的OS和無失敗生存(failure-free survival,FFS)均明顯優于 PTCLNOS,ALK-ALCL的5年OS率和FFS率分別為49%和36%(P=0.012),PTCL-NOS為32%和20%(P=0.032)[56]。
6 小結
PTCL-NOS是一類具有高度侵襲性的成熟T細胞淋巴瘤,傳統治療療效不佳,預后差。新的治療方案或藥物盡管已取得了一定的成效,但結果仍不容樂觀。日益發展的分子遺傳學技術已經在一些惡性淋巴瘤的診斷、治療及預后判斷中起了重要的作用。越來越多和PTCL-NOS相關分子標記或基因標記的發現必將為學者們提高診斷準確率、建立更有效的預后分層模型及選擇更為有效合理的治療方案提供極大的幫助。
[1]Anderson JR,Arm itage JO,Weisenburger DD.Epidem iology of the non-Hodgkin's lymphomas:distributions of the major subtypes differ by geographic locations.Non-Hodgkin's Lymphoma Classification Project[J].Ann Oncol,1998,9(7):717-720.
[2]Vose J,Arm itage J,Weisenburger D,et al.International peripheral T-cell and natural killer/T-cell lymphoma study:pathology findings and clinical outcomes[J].J Clin Oncol,2008,26(25):4124-4130.
[3]Weisenburger DD,Savage KJ,Harris NL,et al.Peripheral T-cell lymphoma,not otherw ise specified:a report of 340 cases from the International Peripheral T-cell Lym-phoma Project[J].Blood,2011,117(12):3402-3408.
[4]Yang QP,Zhang WY,Yu JB,et al.Subtype distribution of lymphomas in Southwest China:analysis of 6,382 cases using WHO classification in a single institution[J].Diagn Pathol,2011(6):77.
[5]Sun J,Yang Q,Lu Z,et al.Distribution of lymphoid neoplasms in China:analysis of 4,638 cases according to the World Health Organization classification[J].Am J Clin Pathol,2012,138(3):429-434.
[6]Geissinger E,Odenwald T,Lee SS,et al.Nodal peripheral T-cell lymphomas and,in particular,their lymphoepithelioid(Lennert's)variant are often derived from CD8+ cytotoxic T-cells[J].Virchows Arch,2004,445(4):334-343.
[7]Swerdlow S,Campo E,Harris N.World Health Organization classification of turnouts.WHO classification of tumours of pathology and genetics of turnouts of haematopoietic and lymphoid tissues[M].Lyon:IARC,2008.
[8]Geissinger E,Bonzheim I,Krenacs L,et al.Nodal peripheral T‐cell lymphomas correspond to distinct mature T‐cell populations[J].JPathol,2006,210(2):172-180.
[9]Went P,Agostinelli C,Gallam ini A,et al.Marker expression in peripheral T-cell lymphoma:a proposed clinicalpathologic prognostic score[J].J Clin Oncol,2006,24 (16):2472-2479.
[10]Dorfman DM,Brown JA,Shahsafaei A,et al.Programmed death-1(PD-1)is a marker of germinal center-associated T cells and angioimmunoblastic T-cell lymphoma[J].Am JSurg Pathol,2006,30(7):802-810.
[11]Grogg KL,Attygale AD,Macon WR,et al.Expression of CXCL13,a chemokine highly upregulated in germinal center T-helper cells,distinguishes angioimmunoblastic T-cell lymphoma from peripheral T-cell lymphoma,unspecified[J].Modern Pathol,2006,19(8):1101-1107.
[12]Attygalle AD,Kyriakou C,Dupuis J,et al.Histologic evolution of angioimmunoblastic T-cell lymphoma in consecutive biopsies:clinical correlation and insights into natural history and disease progression[J].Am J Surg Pathol,2007,31(7):1077-1088.
[13]Zettl A,Rudiger T,Konrad MA,et al.Genomic profiling of peripheral T-cell lymphoma,unspecified,and anaplastic large T-cell lymphoma delineates novel recurrent chromosomal alterations[J].Am J Pathol,2004, 164(5):1837-1848.
[14]Thorns C,Bastian B,Pinkel D,etal.Chromosomal aberrations in angioimmunoblastic T‐cell lymphomaand peripheral T‐cell lymphoma unspecified:A matrix‐based CGH approach[J].Genes Chromosomes Cancer, 2007,46(1):37-44.
[15]Nakagawa M,Nakagawa-Oshiro A,Karnan S,et al.Array comparative genom ic hybridization analysis of PTCL-U reveals a distinct subgroup w ith genetic alterations similar to lymphoma-type adult T-cell leukemia/ lymphoma[J].Clin Cancer Res,2009,15(1):30-38.
[16]Piva R,Agnelli L,Pellegrino E,et al.Gene expression profiling uncoversmolecular classifiers for the recognition of anaplastic large-cell lymphoma w ithin peripheral T-cell neoplasms[J].JClin Oncol,2010,28(9):1583-1590.
[17]Piccaluga PP,Fuligni F,De Leo A,et al.Molecular profiling improves classification and prognostication of nodal peripheral T-cell lymphomas:results of a phase III diagnostic accuracy study[J].JClin Oncol,2013,31 (24):3019-3025.
[18]Iqbal J,W right G,Wang C,et al.Gene expression signatures delineate biological and prognostic subgroups in peripheral T-cell lymphoma[J].Blood,2014,123 (19):2915-2923.
[19]Dupuis J,Em ile JF,Mounier N,et al.Prognostic significance of Epstein-Barr virus in nodal peripheral T-cell lymphoma,unspecified:A Groupe d'Etude des Lymphomes de l'Adulte(GELA)study[J].Blood,2006,108 (13):4163-4169.
[20]Gallamini A,Stelitano C,Calvi R,et al.Peripheral T-cell lymphoma unspecified(PTCL-U):a new prognostic model from a retrospective multicentric clinical study[J].Blood,2004,103(7):2474-2479.
[21]Paulli M,Berti E.Cutaneous T-cell lymphomas(including rare subtypes).Current concepts II[J].haematologica,2004,89(11):1372-1388.
[22]Choi W,Park YH,Paik KH,et al.Peripheral T-cell lymphoma-unspecified(PTCL-U)presenting w ith hypereosinophilic syndrome and pleural effusions[J].Korean J Intern Med,2006,21(1):57-61.
[23]Asano N,Suzuki R,Kagami Y,et al.Clinicopathologic and prognostic significance of cytotoxic molecule expression in nodal peripheral T-cell lymphoma,unspecified[J].Am JSurg Pathol,2005,29(10):1284-1293.
[24]彭玉龍,黃慧強,周中梅,等.外周T細胞淋巴瘤-非特異型(PTCL-U)117例長期臨床隨訪結果分析[J].中國癌癥雜志,2006,16(2):132-135.
[25]岑洪,胡曉樺,周文獻,等.163例外周T細胞淋巴瘤-非特指型患者的臨床特征及預后分析[J].中國腫瘤臨床,2007,34(17):982-985.
[26]Kim YR,Kim JS,Kim SJ,et al.Lymphopenia is an important prognostic factor in peripheral T-cell lymphoma (NOS)treated w ith anthracycline-containing chemotherapy[J].JHematol Oncol,2011(4):34.
[27]Torimoto Y,Sato K,Ikuta K,et al.A retrospective clinical analysis of Japanese patients w ith peripheral T-cell lymphoma not otherw ise specified:Hokkaido Hematology Study Group[J].Int J Hematol,2013,98(2):171-178.
[28]Xu P,Yu D,Wang L,et al.Analysis of prognostic factors and comparison of prognostic scores in peripheral T cell lymphoma,not otherw ise specified:a single-institution study of 105 Chinese patients[J].Ann Hematol,2015,94(2):239-247.
[29]Schmitz N,Trumper L,Ziepert M,et al.Treatment and prognosis of mature T-cell and NK-cell lymphoma:an analysis of patients w ith T-cell lymphoma treated in studies of the German High-Grade Non-Hodgkin Lymphoma Study Group[J].Blood,2010,116(18):3418-3425.
[30]d'Amore F,Relander T,Lauritzsen GF,et al.Up-front autologous stem-cell transplantation in peripheral T-cell lymphoma:NLG-T-01[J].J Clin Oncol,2012,30(25): 3093-3099.
[31]Escalon MP,Liu NS,Yang Y,etal.Prognostic factorsand treatment of patients w ith T-cell non-Hodgkin lymphoma:the M.D.Anderson Cancer Center experience[J].Ann N Y Acad Sci,2005,103(10):2091-2098.
[32]Arkenau HT,Chong G,Cunningham D,et al.Gemcitabine,cisplatin and methylprednisolone for the treatment of patients w ith peripheral T-cell lymphoma:the Royal Marsden Hospital experience[J].Haematologica, 2007,92(2):271-272.
[33]Zinzani PL,Venturini F,Stefoni V,et al.Gemcitabine as single agent in pretreated T-cell lymphoma patients: evaluation of the long-term outcome[J].Ann Oncol, 2010,21(4):860-863.
[34]Corazzelli G,Marcacci G,Frigeri F,et al.Gemcitabine, ifosfamide,oxaliplatin(GIFOX)as first-line treatment in high-risk peripheral T-Cell/NK lymphomas:a phase II trial[J].Blood,2010,116(21):1167a.
[35]Svoboda J,Nasta SD,Wilson LD,etal.Radiation therapy in peripheral T-cell lymphoma of the head and neck[J].Blood,2013,122(21):1795.
[36]Petrich AM,Helenowski IB,Bryan LJ,et al.Factors predicting survival in peripheral T-cell lymphoma in the USA:a population-based analysis of 8802 patients in the modern era[J].Br J Haematol,2015,168(5): 708-718.
[37]Zhang XM,Li YX,Wang WH,et al.Survival advantage w ith the addition of radiation therapy to chemotherapy in early stage peripheral T-cell lymphoma,not otherw ise specified[J].Int J Radiat Oncol Biol Phys, 2013,85(4):1051-1056.
[38]Mehta N,Maragulia JC,Moskow itz A,et al.A retrospective analysis of peripheral T-cell lymphoma treated w ith the intention to transplant in the first remission[J].Clin Lymphoma Myeloma Leuk,2013,13(6):664-670.
[39]Reimer P,Rüdiger T,Geissinger E,et al.Autologous stem-cell transplantation as first-line therapy in peripheral T-cell lymphomas:results of a prospective multicenter study[J].JClin Oncol,2009,27(1):106-113.
[40]Jiang L,Yuan CM,Hubacheck J,et al.Variable CD52 expression in mature T cell and NK cellmalignancies: implications for alem tuzumab therapy[J].Br J Haematol,2009,145(2):173-179.
[41]Gallamini A,Zaja F,Patti C,et al.Alem tuzumab(Campath-1H)and CHOP chemotherapy as first-line treatment of peripheral T-cell lymphoma:results of a GITIL (Gruppo Italiano Terapie Innovative nei Linfomi)prospectivemulticenter trial[J].Blood,2007,110(7):2316-2323.
[42]Dang NH,Pro B,Hagemeister FB,etal.Phase II trial of denileukin diftitox for relapsed/refractory T‐cell non‐Hodgkin lymphoma[J].Brit J Haematol,2007,136(3): 439-447.
[43]Foss FM,Sjak-Shie N,Goy A,et al.A multicenter phase II trial to determine the safety and efficacy of combination therapy w ith denileukin diftitox and cyclophospham ide,doxorubicin,vincristine and prednisone in untreated peripheral T-cell lymphoma:the CONCEPT study[J].Leuk Lymphoma,2013,54(7):1373-1379.
[44]O'Connor OA,Pro B,Pinter-Brown L,etal.Pralatrexate in patients w ith relapsed or refractory peripheral T-cell lymphoma:results from the pivotal PROPEL study[J].J Clin Oncol,2011,29(9):1182-1189.
[45]Coiffier B,Pro B,Prince HM,et al.Romidepsin for the treatment of relapsed/refractory peripheral T-cell lymphoma:pivotal study update demonstrates durable responses[J].JHematol Oncol,2014(7):11.
[46]Horw itz SM,Advani RH,Bartlett NL,et al.Objective responses in relapsed T-cell lymphomas w ith singleagent brentuximab vedotin[J].Blood,2014,123(20): 3095-3100.
[47]Wang T,Feldman AL,Wada DA,et al.GATA-3 expression identifies a high-risk subset of PTCL,NOS w ith distinctmolecular and clinical features[J].Blood,2014, 123(19):3007-3015.
[48]Briones J,Moga E,Espinosa I,et al.Bcl-10 protein highly correlates w ith the expression of phosphorylated p65 NF-kappaB in peripheral T-cell lymphomas and is associated w ith clinical outcome[J].Histopathology, 2009,54(4):478-485.
[49]Niitsu N,Okamoto M,Nakamine H,et al.Clinicopathologic features and outcome of Japanese patients w ith peripheral T-cell lymphomas[J].Hematol Oncol, 2008,26(3):152-158.
[50]Vose JM.International Peripheral T-Cell Lymphoma (PTCL)Clinical and Pathologic Review Project:poor outcome by prognostic indices and lack of efficacy w ith anthracyclines[J].Blood,2005,106(11):811a.
[51]Gutierrez-Garcia G,Garcia-Herrera A,Cardesa T,et al.Comparison of four prognostic scores in peripheral T-cell lymphoma[J].Ann Oncol,2011,22(2):397-404.
[52]ten Berge RL,de Bruin PC,Oudejans JJ,et al.ALK-negative anaplastic large-cell lymphoma demonstrates similar poor prognosis to peripheral T-cell lymphoma, unspecified[J].Histopathology,2003,43(5):462-469.
[53]Medeiros LJ,Elenitoba-Johnson KS.Anaplastic large cell lymphoma[J].Am J Clin Pathol,2007,127(5): 707-722.
[54]Fornari A,Piva R,Chiarle R,et al.Anaplastic large cell lymphoma:one ormore entities among T-cell lymphoma?[J].Hematol Oncol,2009,27(4):161-170.
[55]Agnelli L,Mereu E,Pellegrino E,et al.Identification of a 3-genemodel as a powerful diagnostic tool for the recognition of ALK-negative anaplastic large-cell lymphoma[J].Blood,2012,120(6):1274-1281.
[56]Savage KJ,Harris NL,Vose JM,et al.ALK-anaplastic large-cell lymphoma is clinically and immunophenotypically different from both ALK-ALCL and peripheral T-cell lymphoma,not otherw ise specified:report from the International Peripheral T-Cell Lymphoma Project[J].Blood,2008,111(12):5496-5504.
R733.4
A
10.11877/j.issn.1672-1535.2015.13.05.08
#通信作者(corresponding author),e-mail:yexiong12@163.com
2015-03-24)

