六種復配劑對芒果細菌性黑斑病菌的室內抑菌效果評價
蒲金基 張賀 漆艷香 張欣 喻群芳 李小娟 趙麗 劉曉妹

摘要:為篩選出有效防治芒果細菌性黑斑病菌(Xanthomonas campestris pv. mangiferaeindicae)的復配劑,采用Horsfall法對6種復配劑進行室內增效評價。試驗結果表明,硫酸鏈霉素與噻菌銅各配比、敵磺鈉與中生菌素以1∶4、4∶1配比及噻菌銅與鹽酸四環素以4∶1、3∶2、2∶3配比時有明顯的增效作用;其余的組合則表現協同或拮抗作用。
關鍵詞:芒果細菌性黑斑病菌(Xanthomonas campestris pv. mangiferaeindicae);復配劑;抑菌效果;評價
中圖分類號:S481.9 文獻標識碼:A 文章編號:0439-8114(2015)10-2387-03
DOI:10.14088/j.cnki.issn0439-8114.2015.10.021
芒果(Mangifera indica L.)屬于漆樹科植物,因其獨特的風味和富含維生素C,被譽為熱帶水果之王[1],熱帶和亞熱帶地區約有100多個國家和地區廣泛種植,并在熱帶和亞熱帶地區的水果出口中占有重要地位[2]。芒果細菌性黑斑病(Mango bacterial black spot)是嚴重影響芒果生產的細菌性病害之一,又稱芒果細菌性角斑病、細菌性葉斑病、細菌性潰瘍病等[3]。該病在巴西[4]、南非[5]、印度[6,7]、巴基斯坦[8]等芒果種植地均有發生,在中國的海南、廣東、廣西、福建、云南等省為害嚴重,一般造成15%~30%的損失,嚴重時達50%以上,且近年來為害有加重的趨勢[1]。芒果細菌性黑斑病主要為害芒果葉片、枝條、花芽、花和果實。感病葉片最初產生水漬狀小點,逐步變成黑褐色,后擴大呈多角形或不規則形,病斑表面隆起,周圍常有黃暈;枝條和花穗發病呈黑褐色潰瘍斑;果實上病斑呈水漬狀小點,常有膠粘汁液流出,后擴大成黑褐色,表面隆起,潰瘍開裂[2]。此病全年均可發生,溫度高于25 ℃,相對濕度大于90%有利于病害的發生和流行[9,10],臺風雨與病害發生有極其密切的關系,秋梢期的臺風雨次數和病葉率與次年黑斑病發生的嚴重程度呈正相關,可以作為病害流行的預測指標[10]。
目前,國內外對該病害的防治主要依靠單一化學藥劑,而且化學農藥長期使用不可避免地導致病原細菌產生抗藥性。向平安等[11]人在辣椒瘡痂病菌(Xanthomonas campestris pv.vesicatoria)和水稻細菌性條斑病菌(X.oryzae pv.oryzicola)中均發現耐鏈霉素菌株,可見已有部分黃單孢菌屬病原細菌對鏈霉素產生了抗性。此外,還有文獻報道水稻白葉枯病菌、柑橘潰瘍病菌等病原細菌對葉枯唑產生了抗藥性[12]。如何應對病原細菌的抗藥性已成為一個突出的問題。農藥復配是科學用藥的一種好方法,不同作用機制的農藥合理復配可以提高工效,擴大使用范圍,兼治幾種病害,減少用藥量,降低成本,提高藥效,降低毒性,延緩病原菌對藥劑產生抗藥性等[13]。本試驗采用含毒介質法,以常規農藥按“比例混合法”復配[14,15],篩選出殺菌效果較好的復配劑,以便有效地防治芒果細菌性黑斑病。
1 材料和方法
1.1 供試菌株與藥劑
供試芒果細菌性黑斑病病原細菌(X. campestris pv. mangiferaeindicae)由本實驗室分離純化保存,菌株編號為XCM-3。供試藥劑、生產廠家和藥劑濃度設置見表1。
1.2 方法
1.2.1 菌懸液的制備 菌懸液的制備參考劉曉妹等[16]人的試驗方法略有改進。將實驗室保存的病原細菌XCM-3進行單菌落培養,挑取一單菌落接種于30 mL LB液體培養基內,28 ℃、150 r/min培養24 h,制得菌原液。取1 mL菌原液,用無菌水按101,102,…,1010倍系列稀釋后涂板于LB固體培養基上,28 ℃培養48 h,根據平板菌落計數法,推算出菌原液的濃度[17]。根據菌原液濃度,制備菌懸液,使菌懸液涂板后長出的菌落數約100個。
1.2.2 復配藥劑的室內抑菌效果評價 采用Horsfall法[18,19]進行復配劑增效配比的篩選。據本實驗室前期工作測得的鹽酸四環素、硫酸鏈霉素、敵磺鈉、中生菌素和噻菌銅5種單劑的抑菌最低抑菌濃度(MIC)[20],按6個比例即5∶0、4∶1、3∶2、2∶3、1∶4、0∶5進行配比,將單劑鹽酸四環素與硫酸鏈霉素、敵磺鈉與中生菌素、硫酸鏈霉素與噻菌銅、硫酸鏈霉素與敵磺鈉、中生菌素與噻菌銅、噻菌銅與鹽酸四環素共6種復配組合,每種復配組合設3個重復。采用含毒介質法制成不同配比的含毒平板,涂布50 μL菌懸液于含毒平板上,以無毒平板為對照,置于28 ℃恒溫培養箱中培養,96 h后檢查菌落生長情況并記錄數據。計算各配比的抑菌率,若毒力比值明顯大于1,為增效作用;反之毒力比值明顯小于1,為拮抗作用;毒力比值為1,則為協同作用。
抑菌率=(對照的平均菌落數-處理的菌落數)/對照的平均菌落數×100%
預期抑菌率=(單劑A的MIC劑量實際抑菌率×配比中的百分比)+(單劑B的MIC劑量實際抑菌率×配比中的百分比)
毒力比值=實際抑菌率(%)/預期抑菌率(%)
2 結果與分析
2.1 復配劑鹽酸四環素與硫酸鏈霉素對病原細菌的抑菌效果
試驗結果(表2)表明,復配劑鹽酸四環素與硫酸鏈霉素各配比的毒力比值均小于1,表現為拮抗作用。
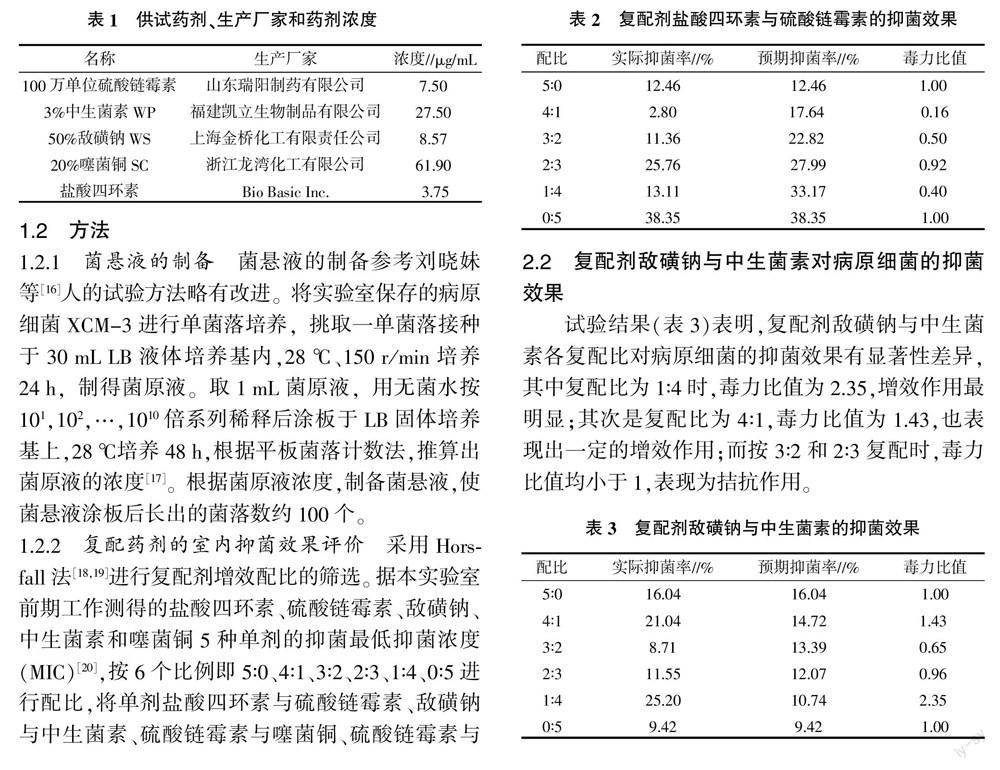
2.2 復配劑敵磺鈉與中生菌素對病原細菌的抑菌效果
試驗結果(表3)表明,復配劑敵磺鈉與中生菌素各復配比對病原細菌的抑菌效果有顯著性差異,其中復配比為1∶4時,毒力比值為2.35,增效作用最明顯;其次是復配比為4∶1,毒力比值為1.43,也表現出一定的增效作用;而按3∶2和2∶3復配時,毒力比值均小于1,表現為拮抗作用。
2.3 復配劑硫酸鏈霉素與噻菌銅對病原細菌的抑菌效果
試驗結果(表4)表明,復配劑硫酸鏈霉素與噻菌銅中各配比毒力比值均大于1,則該復配劑各配比均表現為增效作用;其中按3∶2、2∶3、1∶4配比時,抑菌率達100%;按3∶2配比時毒力比值最高達2.23,但從經濟角度考慮,生產上應使用1∶4配比,可降低生產成本。
2.4 復配劑硫酸鏈霉素與敵磺鈉對病原細菌的抑菌效果
試驗結果(表5)表明,復配劑硫酸鏈霉素與敵磺鈉中各復配中,只有按1∶4配比時毒力比值為1.02,未表現出明顯的增效作用,其余的配比毒力比值均小于1,表現為拮抗作用。
2.5 復配劑中生菌素與噻菌銅對病原細菌的抑菌效果
試驗結果(表6)表明,復配劑中生菌素與噻菌銅中各復配比毒力比值均小于1,則該復配劑表現為拮抗作用。
2.6 復配劑噻菌銅與鹽酸四環素對病原細菌的抑菌效果
試驗結果(表7)表明,復配劑噻菌銅與鹽酸四環素中各復配比中,配比為2∶3時毒力比值最高達2.07,表現為明顯的增效作用;其次是配比為3∶2、4∶1的毒力比值依次為1.53和1.21,表現為一定的增效作用;而1∶4時的毒力比值為0.46,表現為拮抗作用。
3 小結與討論
目前,噴施化學農藥是防治芒果細菌性黑斑病的主要措施之一,鑒于一些病原細菌已產生抗藥性[13],有必要篩選出一批高效、低毒、低殘留、無公害的環境友好型,且具有治療和保護性的內吸性的復配藥劑,用于延緩病原細菌的抗藥性,提高防治效率,實現綠色芒果的增產增收。
采用Horsfall法對供試的5種單劑以不同配比進行復配篩選,結果表明,有3個配比組合毒力比值大于2,分別是敵磺鈉與中生菌素1∶4(毒力比值為2.35)、硫酸鏈霉素與噻菌銅3∶2(毒力比值為2.23)及噻菌銅與鹽酸四環素2∶3(毒力比值為2.07),應用潛力較大,初步推斷這些復配劑的配比具有進一步研究的價值。硫酸鏈霉素的作用機理是抑制細菌蛋白質的合成[21],而噻菌銅的噻唑基團和銅離子不僅具有殺細菌效果也具有殺真菌效果,兩種單劑的復配豐富了藥劑的作用機理,延緩病原細菌的抗藥性,亦能對芒果炭疽病(Colletotrichum gloeosporioides)也有很好的防治效果[22]。建議果農在生產中,可以購置龍克菌(噻菌銅)和農用鏈霉素按3∶2、2∶3、1∶4比例范圍進行復配,從而提高防效、擴大防治譜、緩解靶標生物的抗性及降低防治成本。
芒果生產上,果農防治芒果細菌性黑斑病常會進行農藥復配,農藥復配理論上雖能提高防治效果、延緩病原細菌抗藥性的產生,但對具有拮抗作用的藥劑進行盲目的復配則會造成防治效果下降及農藥的浪費。如試驗測得鹽酸四環素與硫酸鏈霉素、硫酸鏈霉素與敵磺鈉及中生菌素與噻菌銅復配則產生拮抗作用。同時,同一復配劑不同配比所表現的作用也不相同。如試驗中的敵磺鈉∶中生菌素3∶2(毒力比值為0.65)與1∶4(毒力比值為2.35)配比及噻菌銅∶鹽酸四環素2∶3(毒力比值為2.07)與1∶4(毒力比值為0.46)配比。因此,在生產上使用合適的配比也是防效的關鍵所在。對一些抑菌效果好、增效作用明顯的復配劑如何加工生產出與先進施藥技術、環境保護要求相適應的劑型則有待進一步研究。
參考文獻:
[1] 劉曉妹,劉文波,范秀利.芒果細菌性黑斑病生防菌的篩選及防效測定[J].中國生物防治,2006,22(S):94-97.
[2] 董 春,何漢生.芒果細菌性黑斑病研究進展[J].果樹科學,1999,16(S):47-51.
[3] 文衍堂,黃圣明.芒果細菌性黑斑病癥狀與病原鑒定[J].熱帶作物學報,1994,15(1):79-84.
[4] SOM?魪 A,SAMSON R.Isoenzyme diversity Xanthomonas campestris pv.mangiferaeindicae[J]. Plant Pathology,1996(45):426-431.
[5] MANICOM B Q,WALLIS F M.Further characterization of Xanthomonas campestris pv.mangiferaeindicae[J].International Journal of Systematic Bacteriology,1984,34(1):77-79.
[6] DAYAKAR B V,GNANAMANICKAM S S. Biochemical and pathogenic variation in strains of Xanthomonas campestris pv. mangiferaeindicae from Southern India[J]. Indian Phytopathology,1996,49(3):227-233.
[7] MISHRA A K,PRAKASH O M.Bacterial canker of mango:incidence and control[J]. Indian Phytopathology,1992,45(2):172-175.
[8] STEYN P L,VILJOEN N M,KOTZ?魪 J M.The causal organism of bacterial black spot of mangoes[J]. Phytopathology,1974(64):1400-1404.
[9] FUKUDA T,UEHARA K,AZAGAMI K,et al.Bacterial canker of mango in Japan caused by Xanthomonas compestris pv.mangiferaeindicae[J]. Annals of the Phytopathological Society of Japan,1990,56(4):474-480.
[10] 何漢生,董 春,朱彬年,等.芒果細菌性黑斑病的發生與防治研究初報[J].廣東農業科學,1996,1(6):35-37.
[11] 向平安,周 燕,高必達. 椒瘡痂病菌(Xanthomonas vesicatoria)和水稻細菌性條斑病菌(X. oryzae pv. oryzicola)的質粒及其與耐霉素和耐銅性關系[J]. 植物病理學報,2003,33(4):330-333.
[12] 趙英俄,祝明亮,秦西云,等.我國植物病原細菌抗藥性的研究進展[J].安徽農業科學,2007,35(23):7198-7199.
[13] 張應芝.農藥混配四原則[J].南方科技報,2008,45(2):61.
[14] 慕立義.植物化學保護

