自由基氧化對乳蛋白聚集行為和持水性的影響
(天津科技大學食品工程與生物技術學院,天津 300457)
(天津科技大學食品工程與生物技術學院,天津 300457)
乳蛋白的氧化會使其蛋白質品質發生劣變.為了研究乳蛋白氧化聚集行為與其性質的關系,采用鐵/過氧化氫/抗壞血酸(Fe/H2O2/Asc)羥自由基氧化系統誘導濃縮乳蛋白(MPC80)和酪蛋白氧化,對其聚集行為和持水性進行了分析和比較.實驗證明,乳蛋白氧化聚集體分為大粒度(約1,000,nm)和小粒度(約100,nm)兩個部分,氧化會使小粒度部分發生聚合,同時大粒度部分發生斷裂.隨著氧化值增加,MPC80和酪蛋白的持水力分別提高了0.43倍和1.73倍,酪蛋白的持水力整體高于 MPC80.以上結果表明,氧化改變了乳蛋白的聚集行為,影響其凝膠網絡,在宏觀上改變了乳蛋白的持水性.
乳蛋白;氧化聚集;粒度分析;持水性
蛋白質的氧化行為是使蛋白質性質改變的主要原因之一,其對蛋白質引發的品質劣變僅次于微生物腐敗.乳蛋白會受到游離基的影響,對氧化非常敏感,乳及乳制品中含有的不飽和脂肪酸、金屬離子、氧化酶類以及其他內源性促氧化成分或在加工中引入的外源性促氧化成分,都會引發乳蛋白的氧化,造成乳品味道、顏色和營養成分的改變,甚至產生有毒化合物.
目前,對蛋白質氧化機理的解釋主要來自醫學研究.在食品科學領域,人們對大豆蛋白氧化的了解多于乳蛋白.這些研究[1]證實,在模擬氧化體系中對蛋白質進行氧化處理,可以引發大豆蛋白的交聯聚合和降解作用,多肽鏈和許多氨基酸側鏈都易于氧化,造成蛋白質結構的改變.這些改變可能包括:氨基酸的破壞、肽鏈的斷裂、肽鏈的交聯、羰基的形成、蛋白質的聚合等.這些結構的變化進一步導致蛋白質功能性質的改變.在對乳蛋白的研究中,氧化對乳蛋白的分子狀態和聚集程度產生的影響存在不同結論.F?rgemand等[2]發現,乳清蛋白由不同的氧化酶引發氧化后,交聯聚合能力增加.?stdal等[3]報道了乳過氧化酶可以使乳蛋白聚合并產生蛋白質游離基.Wiking等[4]對原料乳蛋白水解的研究表明 H2O2的添加可以提高蛋白質的水解度.但是以上研究并沒有深入揭示氧化對乳蛋白聚集狀態的改變及其與功能性質之間的關系.
本文以羥基自由基產生體系為模擬氧化體系,以濃縮乳蛋白(MPC80)和酪蛋白為原料制備氧化蛋白,研究比較不同氧化強度的乳蛋白其聚集行為及持水性產生的變化,以期從聚集行為與功能性質的角度揭示羥自由基氧化對乳蛋白結構和性質的影響,揭示乳蛋白氧化的機制.
1 材料與方法
1.1 原料與試劑
酪蛋白、濃縮乳蛋白(MPC80),寧夏塞尚乳業有限公司.
氯化鈉、氯化鐵(FeCl3)、鹽酸、乙二胺四乙酸(EDTA)、2,4-二硝基苯肼(DNPH)、鹽酸胍、過氧化氫(H2O2)、三氯乙酸、抗壞血酸(Asc),以上試劑均為分析純.牛血清蛋白(BSA),國藥集團上海化學試劑公司.
1.2 儀器與設備
UV-VIS型紫外可見光分光光度計,天津普瑞斯儀器有限公司;TGL-16C型高速離心機,上海安亭科學儀器廠;BT-90型激光粒度分析儀,百特儀器有限公司.
1.3 實驗方法
1.3.1 羥自由基產生系統(hydroxyl free radical generation system,HRGS)的構建
在 pH,6.0的磷酸鹽緩沖液中加入 FeCl3、Asc、H2O2,使其濃度分別為 0.1、0.1、20,mmol/L.鐵/過氧化氫/抗壞血酸(Fe/H2O2/Asc)氧化系統可以產生活性氧自由基,主要由FeCl3、Asc和H2O2通過鐵的氧化還原反應而產生[5].通過改變氧化時間來控制對乳蛋白的氧化強度.
1.3.2 MPC80和酪蛋白的氧化反應
在上述氧化體系中分別加入 MPC80和酪蛋白,使蛋白的最終質量濃度為20,mg/mL.在80,℃水浴中使樣品進行恒溫氧化,氧化時間分別為 1、2、3、4,h,使其達到不同的氧化強度.添加 EDTA(使其濃度為1,mmol/L)終止氧化反應.氧化后的產物用磷酸鹽緩沖液洗滌后進行過濾、離心、凍干處理.所得氧化乳蛋白樣品備用.
1.4 測定方法
1.4.1 蛋白質氧化值測定
采用改進的 DNPH比色法[6]進行蛋白質氧化值的測定.將制備的氧化蛋白分散在去離子水中,采用雙縮脲法以牛血清蛋白為標準測定上清液中蛋白濃度,隨后稀釋上清液使得每 0.35,mL上清液中含有1.0~1.5,mg蛋白質.
在 2.0,mL具蓋的聚乙烯離心管中,將 0.35,mL蛋白質溶液與 1,mL含有 10,mmol/L 2,4-二硝基苯肼的2,mol/L HCl混合,在20,℃條件下水浴2,h.另取0.35,mL蛋白質溶液與1,mL不含有2,4-二硝基苯肼的 2,mol/L HCl混合,同樣在 20,℃條件下水浴2,h,作為空白對照.
在每個離心管中加入 0.45,mL質量分數 40%的三氯乙酸,劇烈振搖均勻后靜置 20,min,10,000,g離心20,min后棄去上清液,隨后采用1.5,mL體積比為1∶1的乙醇-乙酸乙酯混合溶液洗滌沉淀,然后10,000,g離心 10,min后棄去洗滌液,如此重復洗滌蛋白質沉淀3次.將蛋白質懸浮于1.0,mL含6,mol/L鹽酸胍pH為7.0的磷酸鹽緩沖液中,在37,℃條件下水浴20,min,每5,min劇烈振搖一次.以空白為對照在 367,nm處作校正,以 22,000,mol-1·cm-1消光系數計算每毫克蛋白質羰基衍生物的量.
1.4.2 蛋白質粒度測定
蛋白質粒度測定采用激光粒度分析儀.將氧化處理后的乳蛋白樣品用 0.12,mol/L的氯化鈉溶液稀釋至蛋白質量分數為0.2%的溶液,于18,℃下進行測定.散射角度 90.00°,測量時間 60.00,s,分布類型為光強分布.
1.4.3 蛋白質持水力測定
稱取0.2,g蛋白于15,mL離心管中,加入4,g去離子水,記錄此時蛋白和離心管總質量,漩渦振蕩2,min后靜置5,h,8,800,r/min離心30,min(20,℃),將水倒出后,記錄此時離心管和蛋白及水的總質量,持水力用每克蛋白吸附的水的質量來計算.
1.5 數據統計分析方法
本研究采用兩次獨立的重復實驗,每次進行3個平行實驗.數據分析采用Excel和Origin 8.6軟件進行分析.
2 結果與討論
2.1 氧化對乳蛋白氧化值的影響
在羥自由基氧化體系中不同強度的氧化后,MPC80和酪蛋白聚集體中羰基含量變化見表 1.由表1可知:羥自由基氧化體系使所有樣品中的羰基含量均明顯增加.相同樣品的羰基含量隨著氧化時間的增加而增加.氧化4,h與1,h相比,MPC80和酪蛋白的氧化值分別提高了 1.48倍和 1.06倍.3,h以內的氧化使酪蛋白的羰基含量顯著增加(P≤0.05),但是氧化時間 3,h和 4,h比較,羰基含量增加不顯著(P>0.05).
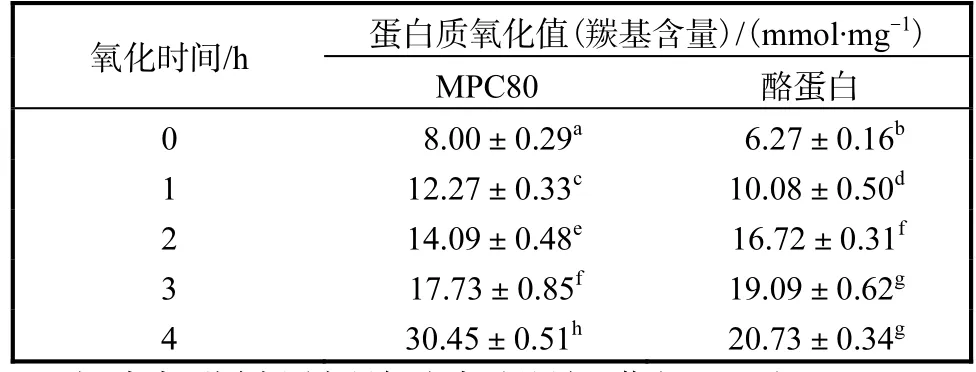
表1 自由基產生體系對乳蛋白羰基含量的影響Tab. 1 Effect of HRGS on the carbony content of milk protein
在羥自由基氧化系統中,所有樣品的氧化值均隨著氧化時間的增加而增加,通過對氧化時間的控制可以實現對乳蛋白氧化值的改變.
2.2 氧化對乳蛋白粒度的影響
在蛋白質聚集過程中,粒度是常用來表征蛋白聚集程度的重要指標.在羥自由基氧化體系中不同強度的氧化后,MPC80和酪蛋白聚集體粒度測定結果見表2和表3,粒度光強分布圖見圖1和圖2.
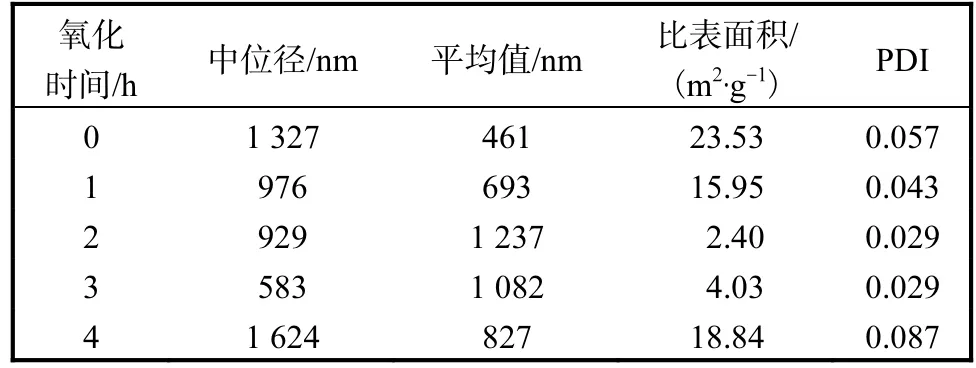
表2 MPC80聚集體粒度測定結果Tab. 2 Results of size measurement by intensity of MPC80
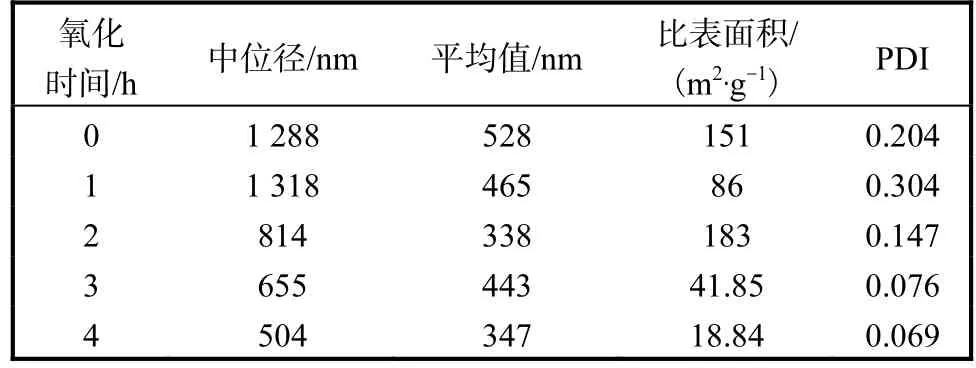
表3 酪蛋白聚集體粒度測定結果Tab. 3 Results of size measurement by intensity of casein
如表2和圖1所示,氧化使MPC80的粒度發生改變,分為大粒度(約 1,000,nm)和小粒度(約100,nm)兩個部分.MPC80的平均粒度隨著氧化時間的增加先升高后降低,氧化時間為2,h的MPC80平均粒度達到 1,237,nm,比表面積達到最低.氧化時間為 2,h和 3,h的 MPC80,其 PDI(多分散指數,polydiseperse index)值最低,為 0.029,粒度分散的均勻性較高,氧化3,h的樣品粒度整體低于氧化2,h的樣品.氧化時間 0,h(對照組)、1,h和 4,h的 MPC80中存在部分小粒度的顆粒,氧化4,h的樣品PDI值最高,說明粒度差異最大.MPC80中粒度大的部分,其粒徑隨氧化時間先降低后增加.氧化 4,h后,MPC80中的兩部分蛋白質粒度分別降低為28.1~44.5,nm和397~706,nm,平均粒度降低.
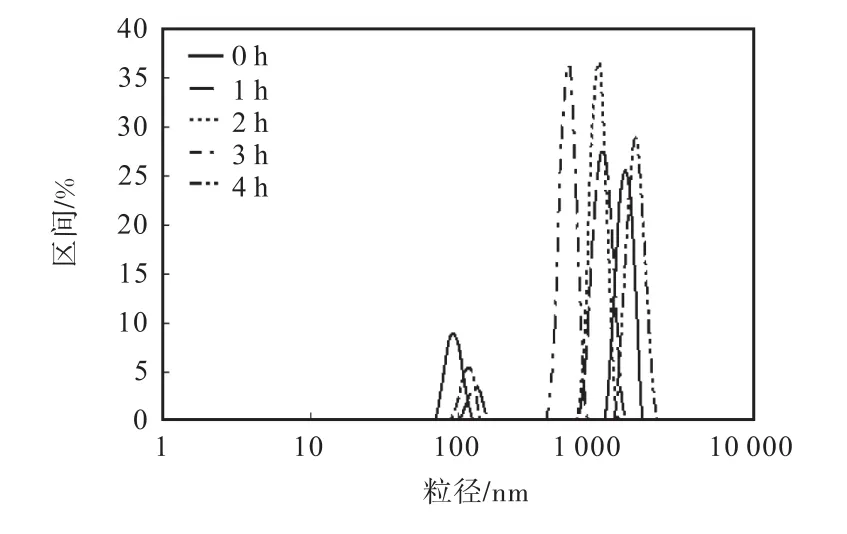
圖1 氧化MPC80粒度的光強分布Fig. 1 Size distribution by intensity of MPC80
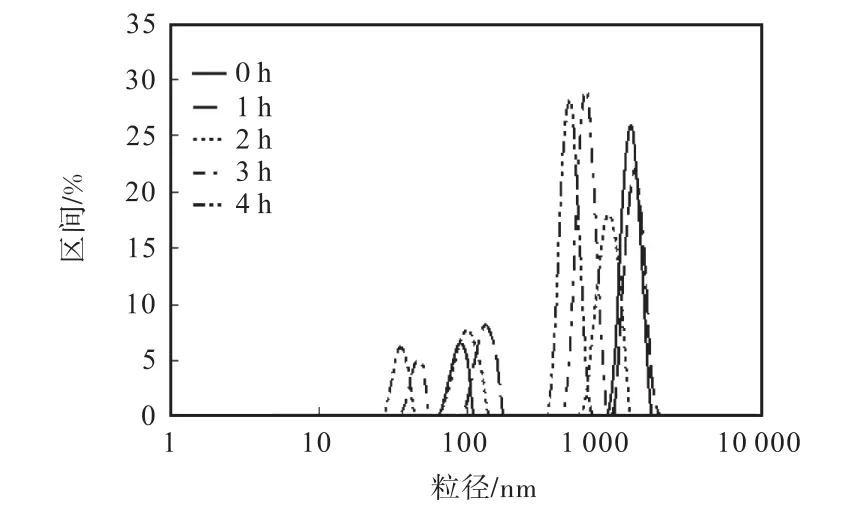
圖2 氧化酪蛋白粒度的光強分布Fig. 2 Size distribution by intensity of casein
如表 3和圖 2所示,酪蛋白的粒度分為大粒度(約 1,000,nm)和小粒度(約 100,nm)兩部分,氧化使酪蛋白的粒度發生改變,中位徑隨著氧化時間的增加,由 1,288,nm降低至 504,nm.平均粒度變化趨勢不明顯.隨著氧化時間的增加,大粒度部分的粒徑降低,含量先升高后降低;小粒度部分的粒徑先增加后降低,含量先降低后增加.酪蛋白中小粒度部分含量顯著高于MPC80.
這說明氧化使乳蛋白產生的聚集和斷裂兩種作用同時進行.乳蛋白中本身存在的小分子顆粒隨著氧化發生交聯,聚集成為較大的顆粒;同時,大分子發生斷裂,其粒度隨著分子的斷裂而降低,氧化使蛋白質大分子的側鏈斷裂成較小的小顆粒.當氧化達到一定程度,小粒度的部分會逐漸增加,使乳蛋白的平均粒度降低.此時,PDI值升高,說明粒度的均一度差,兩部分粒度差異較高,而平均粒度與兩部分的含量有關,不再能夠描述粒度變化情況.酪蛋白中的小粒度部分顯著高于MPC80,說明乳蛋白中的其他組分(乳清蛋白等)在氧化過程中與酪蛋白的交聯度和敏感度均高于酪蛋白-酪蛋白的交聯,聚合更為緊密.
吳偉[1]在對大豆蛋白氧化的研究中也發現了蛋白質發生聚集及斷裂形成小分子的現象,與本實驗結論相符.郭建[7]、蔣將[8]對蛋白質進行熱變性和pH偏移等研究,結果表明蛋白質發生了交聯聚集,但是并沒有同時產生高粒度聚集體斷裂形成低粒度聚集體的現象.因此,蛋白質的聚合與斷裂同時發生可能是蛋白質氧化聚集行為的特點,是否有小粒度部分形成也可以作為對蛋白質聚集行為原因的判斷依據之一.
2.3 氧化對乳蛋白持水性的影響
在羥自由基氧化體系中不同強度的氧化后,MPC80和酪蛋白聚集體的持水力變化如圖3所示.
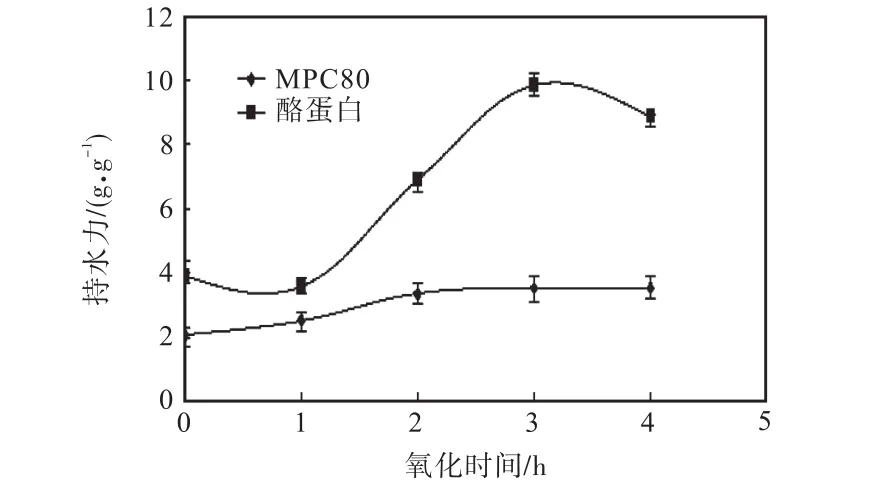
圖3 氧化時間對乳蛋白持水性的影響Fig. 3 Effect of oxidation time on water binding capacity
由圖 3可知,氧化處理后,除氧化 1,h的酪蛋白外,所有樣品中的持水力均高于對照組.MPC80的持水力隨著氧化時間的增加而增加,在自由基產生體系中氧化4,h與1,h的MPC80相比,其持水力增加了0.43倍,達到3.56,g/g,氧化2,h、3,h、4,h均顯著高于氧化 1,h(P≤0.05),極顯著高于 0,h對照組(P≤0.01),但氧化2,h、3,h、4,h的MPC80持水力變化不顯著(P>0.05).在酪蛋白的氧化中,持水力變化均為極顯著(P≤0.01),氧化時間3,h與1,h相比,持水力增加了 1.73倍,達到 9.86,g/g.但是氧化時間超過3,h后,酪蛋白的持水力開始下降(P≤0.01).整體比較,酪蛋白持水力高于 MPC80(P≤0.01),二者的變化趨勢差異顯著.
蛋白質的持水力與其形成的凝膠網絡結構有關,過于松散或過于緊密的網絡結構不利于水分的保持,緊密有序的網絡結構可能將水分排出凝膠網絡結構之外.因此,持水力不僅與乳蛋白的組成有關,聚集狀態的改變也會影響其凝膠網絡狀態.與MPC80相比,酪蛋白的網絡結構的柔韌開放,使其持水力整體高于前者.MPC80中含有酪蛋白和其他組分,成分更為復雜,氧化處理后,各組分交聯聚合的緊密度高于酪蛋白-酪蛋白聚體,聚合體的粒度更小.隨著氧化時間的增加,氧化交聯引起的粒度范圍變化不大,小粒度部分的含量低,使持水力變化不顯著.酪蛋白隨著氧化分為粒度差異顯著的兩部分,聚體狀態改變顯著,這可能是其持水力變化顯著的原因.粒度大的聚集體利于形成網絡,其含量隨著氧化時間的增加而降低,使其持水力也出現了相似的變化趨勢,與粒度分析結果一致.
3 結 語
采用 Fe/H2O2/Asc羥自由基氧化系統誘導濃縮乳蛋白(MPC80)和酪蛋白氧化,通過控制氧化時間實現了對乳蛋白氧化值(羰基含量)的改變,并對其聚集行為(粒度)和持水性進行了分析和比較.乳蛋白的氧化聚集體分為大粒度(約1,000,nm)和小粒度(約100,nm)兩個部分,氧化會使低粒度部分聚合成為高粒度聚集體,高粒度部分斷裂成低粒度顆粒,兩種行為同時進行.酪蛋白持水力高于 MPC80,氧化對MPC80持水性影響小,這與乳蛋白的組分、氧化值和聚集狀態有關.
氧化還會引起蛋白質結構的其他變化,進而在宏觀上改變蛋白質的功能性質,這些內容會在進一步的研究中進行探索.
[1] 吳偉. 蛋白質氧化對大豆蛋白結構和凝膠性質的影響[D]. 無錫:江南大學,2010.
[2] F?rgemand M,Otte J,Qvist K B. Cross-linking of whey proteins by enzymatic oxidation[J]. Journal of Agricultural and Food Chemistry,1998,46(4):1326-1333.
[3] ?stdal H,Bjerrum M J,Pedersen J A,et al. Lactoperoxidase-induced protein oxidation in milk[J]. Journal of Agricultural and Food Chemistry,2000,48(9):3939-3944.
[4] Winking L,Nielsen J H. The influence of oxidation on proteolysis in raw milk[J]. Journal of Dairy Research,2004,71(2):196- 200.
[5] Srinivasan S,Hultin H O. Chemical,physical,and functional properties of cod proteins modified by a nonenzymic free-radical-generating system[J]. Journal of Agricultural and Food Chemistry,1997,45(2):310-320.
[6] Huang Y R,Hua Y F,Qiu A Y. Soybean protein aggregation induced by lipoxygenase catalyzed linoleic acid oxidation[J]. Food Research International,2006,39(2):240-249.
[7] 郭建. 大豆蛋白熱聚集行為控制及其結構表征的研究[D]. 廣州:華南理工大學,2012.
[8] 蔣將. pH偏移處理誘導熔球態大豆蛋白的結構變化及功能性質的改善[D]. 無錫:江南大學,2011.
自由基氧化對乳蛋白聚集行為和持水性的影響
汪建明,譚瑤瑤,于景華,陳立紅,李 陽
Effect of Protein Oxidation on the Aggregation Behavior and Water Binding Capacity of Milk Protien
WANG Jianming,TAN Yaoyao,YU Jinghua,CHEN Lihong,LI Yang
(College of Food Engineering and Biotechnology,Tianjin University of Science & Technology,Tianjin 300457,China)
Protein oxidation will result in the quality deterioration of milk protein. The changes in aggregation behavior and water binding capacity of milk protein concentrate(MPC80)and casein oxidated in a Fe/H2O2/Asc hydroxyl free radical generation system(HRGS)were investigated. The results showed that the oxidated aggregation of milk protein fell into two parts:the big particle size(1,000 nm) group and the small particle size(100 nm) group. The aggregation of the latterand the fracture of the former occurred simultaneously. The waterbinding capacity of casein was greater than that of MPC80,which increased by 0.43 and 1.73 times respectively with the increase of oxidation. Thus,HRGS-mediated oxidation alteredthe aggregation of milk protein,which may lead to modifications of protein functionalities.
milk protein;oxidation;particle size analysis;water binding capacity
TS252.59 文獻標志碼:A 文章編號:1672-6510(2015)02-0025-04
10.13364/j.issn.1672-6510.20140088
2014-06-05;
2014-09-10
國家自然科學基金資助項目(31271904)
汪建明(1972—),女,新疆人,教授,wangjianming@tust.edu.cn.
周建軍

