前列腺癌組織中p53、bcl-2和E-cadherin蛋白的表達水平及臨床意義
韓麗媛,王偉,王慧萍,陳東*
(1.首都醫科大學附屬北京安貞醫院,北京 100029;2.國家衛生計生委科學技術研究所,北京 100081)
前列腺癌是中老年男性泌尿生殖系統常見的惡性腫瘤之一,在我國其發病率逐年上升。因此對前列腺癌發生發展以及治療和預后的研究具有重要意義。研究發現:p53 基因是腫瘤 抑制基因,突變后則失去原有功能反而促進細胞轉化和過度增殖,導致腫瘤的發生[1]。bcl-2是一種凋亡抑制基因,可抑制細胞凋亡延長其生長,導致腫瘤的發生[2]。E-cadherin是鈣黏蛋白家族中的主要成員之一,主要介導上皮細胞之間的粘附,與腫瘤細胞的侵襲和轉移密切相關[3]。本研究應用免疫組織化學方法分別檢測p53、bcl-2和E-cadherin在不同病理分級的前列腺癌組織及前列腺增生組織中的表達情況,探討其在前列腺癌病變中表達的意義以及與前列腺癌病理分級的相關性,為其鑒別診斷和判斷預后提供幫助。
材料和方法
一、標本來源及分組
收集2012年6月至2013年12月北京安貞醫院活檢及手術切除的前列腺標本71例,均經病理診斷明確,其中前列腺增生組織25例,前列腺癌組織46例。前列腺癌組織按Gleason分級又分為3組,對同一腫瘤的主要結構和次要結構分別評分,兩項評分相加總積分為2~4 分者列為高分化組(11例),總積分為5~7分者列為中分化組(13例)、8~10分者列為低分化組(22例)。
二、試劑與方法
1.主要試劑:p53、bcl-2 和E-cadherin均為即用型兔抗人單克隆抗體,二抗為辣根過氧化物酶標記的山羊抗兔IgG,3 種抗體和免疫組織化學試劑盒均購自北京中杉金橋生物技術有限公司。
2.免疫組織化學法:采用SP法,經脫蠟、水化、抗原修復、過氧化物酶阻斷、孵育一抗、孵育二抗、二氨基聯苯胺(DAB)顯色、復染、脫水、透明、封片后顯微鏡下觀察。用已知陽性標本作陽性對照,PBS替代一抗作空白對照。
3.結果判斷:免疫組織化學染色結果評價主要根據陽性細胞占所有細胞的比例。p53以細胞核著棕色顆粒為陽性,bcl-2 以細胞漿著棕色顆粒為陽性,E-cadherin以細胞膜顯棕色著色為陽性。陽性細胞計數采用高倍鏡(×400)下隨機選取5個視野計數陽性細胞所占比例的平均數,以百分率表示。無陽性細胞或陽性細胞率<10%為陰性,陽性細胞率≥10%為陽性。
三、統計學分析
采用SPSS 14.0 統計軟件對數據進行分析處理,兩組間表達率采用χ2檢驗,P<0.05為差異有統計學意義。
結 果
一、p53在前列腺增生組織和前列腺癌組織中的表達
在前列腺組織中,p53 主要表達于正常的腺上皮細胞以及癌變細胞的細胞核(圖1),其在25例前列腺增生組織中有3 例陽性表達,陽性率為12.0%;46 例 前 列 腺 癌 組 織 中 有23 例 陽 性 表達,陽性率為50.0%;前列腺癌組織中p53 的陽性表達率顯著高于前列腺增生組織的p53 的陽性表達率(P<0.05)(表1)。在前列腺癌高分化組、中分化組、低分化組中,p53 的陽性表達率分別 為36.4%(4/11)、46.2%(6/13)和59.1%(13/22),表達雖然隨著癌細胞分化程度的降低而呈現逐漸升高的趨勢,但差異無統計學意義(P>0.05)。
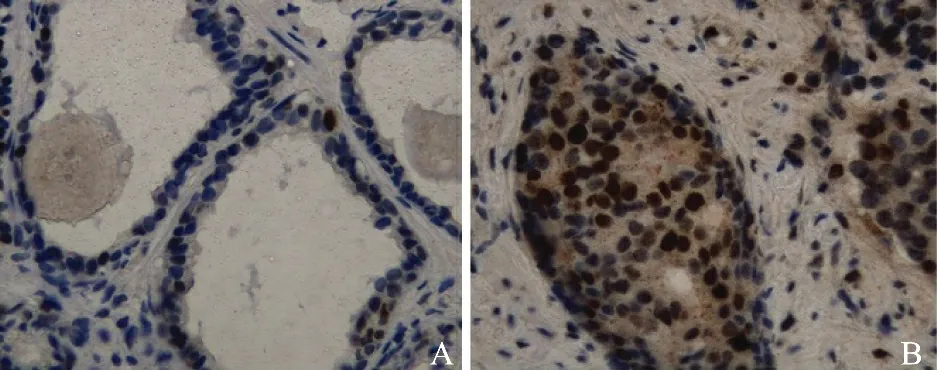
圖1 p53在前列腺組織中的表達。免疫組織化學染色SP法 ×400

表1 各組中p53、bcl-2、E-cadherin的陽性表達率比較[n(%)]
二、bcl-2在前列腺增生和前列腺癌組織中的表達
bcl-2主要表達于正常前列腺的腺上皮細胞以及前列腺癌細胞的細胞質(圖2),在25例前列腺增生組織中有2例bcl-2陽性表達,陽性率為8.0%。46例前列腺癌組織中有27例陽性表達,陽性率為58.7%。兩組bcl-2 表達陽性率相比較,差異具有統計學意義(P<0.05)(表1)。bcl-2在前列腺癌高分化組的陽性表達率36.4%(4/11)顯著低于低分化組72.7%(16/22)(P<0.05)。
三、E-cadherin在前列腺增生和前列腺癌組織中的表達
E-cadherin主要表達于前列腺上皮細胞和前列腺癌細胞的細胞膜(圖3),25 例前列腺增生組織全部表現為E-cadherin表達陽性,陽性表達率為100.0%。在46例前列腺癌組織中20例陽性表達E-cadherin蛋白,陽性表達率為43.5%。兩組E-cadherin蛋白表達陽性率相比較,差異具有統計學意義(P<0.05)。在前列腺癌高、中、低分化3組中的陽性表達率分別為90.9%(10/11)、46.2%(6/13)、18.2%(4/22),高分化組陽性表達率顯著高于低分化組,差異具有統計學意義(P<0.05)。

圖2 p53在前列腺組織中的表達。免疫組織化學染色SP法 ×400

圖3 E-cadherin在前列腺組織中的表達。免疫組織化學染色SP法 ×400
討 論
p53基因最初是由Crawford等[4]從猿病毒40轉化細胞中發現的,其編碼的蛋白質產物可分為野生型p53(Wild-type p53,wtp53)和突變型p53(mutant p53,mtp53)。wtp53 可以參與細胞周期的調控,通過阻斷有損傷的DNA 復制而保持細胞穩定生長,抑制細胞惡性增殖[5],因此其是重要的抑癌物質。在外界因素的影響下,wtp53可轉變為mtp53,mtp53不僅失去了正常的抑癌作用,而且可以抑制wtp53的活性,滅活其功能,從而促進細胞的惡性轉化,導致腫瘤的發生[6]。wtp53在細胞中的半衰期極短,僅為20~60 min,因此一般用免疫組化的方法檢測到的p53 均為mtp53(半衰期2~12h)[7]。徐妙生等[8]關于p53的研究顯示,前列腺增生組織其陽性率為15.0%,前列腺癌中陽性率為33.3%,癌組織中的表達雖然有所升高,但是比較差異無統計學意義。而本研究檢測到前列腺癌中p53陽性細胞率為50.0%,顯著高于前列腺增生組織(12.0%)(P<0.05),并且隨著癌細胞分化程度的降低,陽性表達率呈現一定的升高趨勢(P>0.05),此結果與蘇振波等[9]、于曉謨[10]的研究結果基本一致,說明在前列腺癌中mtp53的表達量明顯增加,它可能在前列腺癌的發生、發展中起一定的作用。有文獻報道[11],低分化的前列腺癌以及雄激素非依賴性前列腺癌組織中p53蛋白表達增高,mtp53蛋白的表達與雄激素受體呈一定的負相關性,提示突變型p53蛋白的表達情況可能與前列腺癌預后發展以及對內分泌治療的反應性有關。
近年來研究發現,細胞凋亡在前列腺癌發生、發展中起著至關重要的作用,bcl-2作為調控凋亡的重要基因產物廣泛受到關注,其可以抑制多種組織的細胞凋亡,是目前公認的抗凋亡基因。bcl-2表達于細胞線粒體膜、核膜和內質網,主要通過阻止細胞膜溶解、胞質固縮及DNA 內源性酶解等關鍵步驟來抑制細胞調亡,延長細胞壽命[12]。本研究中,前列腺癌組織中bcl-2表達陽性率為58.7%,明顯高于前列腺增生組織中的陽性表達(8.0%),與文獻[13-14]報道基本一致,提示bcl-2 可能參與了前列腺癌的發生。同時在前列腺癌不同組中,低分化組bcl-2陽性表達率高達72.7%,高分化組陽性表達率為32.4%,兩組差異具有統計學意義,表明bcl-2蛋白表達量與前列腺癌細胞的分化程度有關,癌細胞分化差時,其表達增高。可見檢測bcl-2 蛋白表達水平,對前列腺癌的鑒別診斷和分期預后評估具有一定參考價值。
近年來發現鈣黏蛋白家族成員E-cadherin 蛋白在腫瘤組織中表達普遍顯著減弱,有研究證實,其表達的降低與肺癌、肝癌、進展期胃癌和子宮內膜癌等腫瘤的侵襲和轉移密切相關[15-18]。E-cadherin蛋白主要介導同型細胞間的粘附,它通過連環素(catenin)與細胞骨架肌動蛋白絲連接形成E-cad復合物,參與上皮細胞間粘合及信號轉導。腫瘤細胞中E-cadherin表達降低,導致細胞間連接松散,易于脫離原發瘤而進入周圍組織及血管淋巴管,使腫瘤細胞獲得較強的侵襲能力,極易發生浸潤和轉移[19]。本實驗結果顯示,前列腺癌組織中E-cad-herin表達明顯低于前列腺增生組織,并且隨著腫瘤分化程度的降低顯著改變:前列腺癌高分化組陽性表達率90.9%,中分化組陽性表達率48.2%,低分化組陽性表達率18.2%,表明E-cadherin表達減弱與前列腺癌發生有關,并且其表達水平與腫瘤惡性程度的進展密切相關。此外,溫爽等[20]還對前列腺高級別上皮內腫瘤中的E-cadherin表達進行了研究,發現其表達量明顯低于前列腺增生組織,提示E-cadherin蛋白有可能在前列腺癌變早期即開始發揮作用。Whiteland等[21]研究認為:E-cadherind蛋白表達量的改變,不僅與前列腺癌Gleason評分等級有關,還與臨床分期及患者預后生存狀況顯著相關。E-cadherin表達降低或缺失的比率越高,腫瘤發生浸潤轉移的幾率越大,預后越差,其有可能成為前列腺癌惡性轉變及向轉移癌發展的標志。
到目前為止,前列腺癌的發生機制尚不是十分明確。本研究結果顯示:p53及bcl-2在前列腺癌組織中表達均較前列腺增生組織明顯增加,且隨腫瘤分化程度的降低呈升高趨勢,E-cadherin與二者表達相反,前列腺癌惡性程度越高,表達陽性率越低,提示3種蛋白與前列腺癌的發生、發展密切相關,檢查其表達水平對疾病鑒別診斷和治療預后有一定幫助。但p53、bcl-2和E-cadherin之間是否存在相關性,還需要擴大樣本進行更詳細的研究。
[1] Yan WF,Wu G,Sun PC,et al.P53 mutations occur more commonly than KRAS mutations in colorectal adenoma[J].Int J Clin Exp Med,2015,8:1370-1375.
[2] Wang G,Reed E,Li QQ.Apoptosis in prostate cancer:progressive and therapeutic implications(Review)[J].Int J Mol Med,2004,14:23-34.
[3] Baranwal S,Alahari SK.Molecular mechanisms controlling Ecadherin expression in breast cancer[J].Biochem Biophys Res Commun,2009,384:6-11.
[4] Crawford LV,Pim DC,Lamb P.The celluar protein p53in human tumor[J].Mol Biol Med,1984,2:261-272.
[5] Pisters LL,Pettaway CA,Troncoso P,et al.Evidence that transfer of functional p53 protein results in increased apoptpsis in prostate cancer[J].Clin Cancer Res,2004,10:2587-2593.
[6] Levine AJ,Finlay CA,Hinds PW.P53is a tumor suppressor gene[J].Cell,2004,116:S67-69.
[7] Ostrakhovitch EA,Olsson PE,Jiang S,et al.Interaction of metallothionein with tumor suppressor p53protein[J].FEBS Lett,2006,580:1235-1238.
[8] 徐妙生,何艷姣,劉朝霞,等.前列腺癌組織bcl-2、p53、P504S及34βE12蛋白的表達水平[J].首都醫科大學學報,2007,4:538-541.
[9] 蘇振波,梁作文,趙丹,等.TGF-β和P53蛋白在前列腺癌組織中的表達及其意義[J].吉林大學學報(醫學版),2010,36:364-367.
[10] 于曉謨.前列腺癌Bcl-2、p53和PCNA 表達的研究[J].現代中西醫結合雜志,2010,19:4665-4667.
[11] Hara T,Miyazaki H,Lee A,et al.Androgen receptor and invasion in prostate cancer[J].Cancer Res,2008,68:1128-1135.
[12] Yuan J,Kroemer G.Alternative cell death mechanisms in development and beyond[J].Genes Dev,2010,24:2592-2602.
[13] Kaur P,Kallakury BS,Sheehan CE,et al.Survivin and Bcl-2 expression in prostatic adenocarcinomas[J].Arch Pathol Lab Med,2004,128:39-43.
[14] Liu YB,Gao X,Deeb D,et al.Pristimerin induces apoptosis in prostate cancer cells by down-regulating bcl-2through ROSdependent ubiquitin-proteasomal degradation pathway[J].J Carcinog Mutagen,2013,5:005.
[15] Zhang H,Liu J,Yue D,et al.Clinical significance of Ecadherin,β-catenin,vimentin and S100A4 expression in completely resected squamous cell lung carcinoma[J].J Clin Pathol,2013,66:937-945.
[16] Hashiguchi M,Ueno S,Sakoda M,et al.Clinical implication of ZEB-1 and E-cadherin expression in hepatocellular carcinoma(HCC)[J].BMC Cancer,2013,13:572.
[17] Wang ZS,Shen Y,Li X,et al.Significance and prognostic value of Gli-1and Snail/E-cadherin expression in progressive gastric cancer[J].Tumour Biol,2014,35:1357-1363.
[18] González-Rodilla I,Aller L,Llorca J,et al.The E-cadherin expression vs.tumor cell proliferation paradox in endometrial cancer[J].Anticancer Res,2013,33:5091-5095.
[19] Fan CC,Wang TY,Cheng YA,et al.Expression of Ecadherin,Twist and p53and their prognostic value in patients with oral squamous cell carcinoma[J].J Cancer Res Clin Oncol,2013,139:1735-1744.
[20] 溫爽,蓋宇,宗華鳳,等.前列腺癌組織P504S、E-cadherin和bcl-2蛋白表達及意義[J].大連醫科大學學報,2013,35:123-126.
[21] Whiteland H,Spencer-Harty S,Thomas DH,et al.Putative prognostic epithelial-to-mesenchymal transition biomarkers for aggressive prostate cancer[J].Exp Mol Pathol,2013,95:220-226.

