乳酸菌對老面團發酵過程中可溶性糖和游離氨基酸含量的影響
宋佳錕,張 灝,趙建新 (江南大學食品學院,江蘇無錫 214000)
我國傳統主食饅頭香甜可口,有著獨特的風味,這是由于其采用的老面是一種天然發酵劑,有著多菌種混合發酵的優勢[1]。老面中含有豐富的微生物,是一種復雜的生化體系,含有多種微生物的酸面團在發酵過程中相互作用,它們產生的各種代謝產物也相互作用,改變了面團的生化特性甚至是物理性質[2-5]。老面中的微生物主要為植物乳桿菌、舊金山乳桿菌、短乳桿菌、戊糖片球菌、短乳桿菌等乳酸菌和少量的酵母菌。乳酸菌在面團中利用各種糖類進行發酵,根據其發酵過程的不同可以分為同型發酵和異型發酵2種途徑,同型發酵產生乳酸,而異型發酵除了乳酸外還生成乙醇、乙酸和二氧化碳等。小麥面粉中含有1.5%左右的可溶性碳水化合物,這取決于面粉和微生物的水解酶與微生物消耗之間的平衡[6]。Kim等研究發現,面團發酵過程中產生風味成分如乳酸、乙醇、有機酸、蛋白質降解產物和羰基化合物等是由于面粉中的酶類被激活[7]。此外,還生成大量的醛類、酮類等化合物,這些化合物再相互作用產生多種維生素、氨基酸使得制品的營養價值得到提升[8],另外還會產生多種新的呈味物質[9]。氨基酸和多肽可以被微生物用作重要前體物質轉化為風味物質[10]。從這些研究成果中可以看出,乳酸菌對于老面中的糖代謝和氨基酸的產生有著很大的影響,但是現在還沒有關于不同的乳酸菌對于老面中可溶性糖和游離氨基酸含量的影響的研究報告。所以筆者的主要研究內容為不同的乳酸菌對于老面發酵過程中可溶性糖和游離氨基酸含量變化的影響。
1 材料與方法
1.1 材料
1.1.1 主要原輔料。風箏牌高筋小麥粉;乳酸菌,實驗室保藏;活性干酵母,安琪酵母股份有限公司;去離子水,飄之霖實驗用水;定性濾紙。
1.1.2 主要試劑。D(-)果糖,葡萄糖,蔗糖,D(+)麥芽糖,乙腈(色譜純),三氯乙酸(分析純)。
1.1.3 培養基。MRS液體培養基配方:魚粉蛋白胨10.0 g、牛肉膏 10.0 g、酵母膏 5.0 g、葡萄糖 20.0 g、無水乙酸鈉 5.0 g、MgSO4·7H2O 0.1 g、MnSO4·H2O 0.05 g、檸檬酸二銨 2.0 g、磷酸二氫鉀 2.0 g、吐溫 80 1 ml、去離子水 1 000 ml。MRS固體培養基配方:在液體培養基的基礎上添加2%的瓊脂條。孟加拉紅固體培養基:蛋白胨5.0 g、葡萄糖10.0 g、磷酸二氫鉀1.0 g、硫酸鎂 0.5 g、瓊脂 20.0 g、孟加拉紅 0.033 g、氯霉素0.1 g。
1.1.4 主要儀器。不銹鋼蒸汽滅菌鍋,上海三申醫療器械有限公司;超凈工作臺SW-CJ-1FD,蘇州安泰空氣技術公司;隔水式恒溫培養箱PYX-DHS,上海一恒科技有限公司;冷凍離心機,Heal Force;超低溫冰箱 M DF-U53V,SANYO;氣相色譜-質譜聯用儀Trace MS型,美國Finnigan公司;分析天平AB104-N,METTLR。
1.2 方法
1.2.1 老面的制作方法。取冷藏保存的乳酸菌菌液200 μl接入10 ml液體MRS培養基活化2次。量取1 ml(菌體密度108/ml)處于對數期的乳酸菌菌液,于5 000 r/min離心15 min。取菌泥和1 g酵母粉加入100 g水混勻,活化5 min后加入100 g面粉攪拌均勻。
1.2.2 老面發酵過程中乳酸菌和酵母菌活菌數的測定。取10 g老面加入90 ml無菌生理鹽水,置于磁力攪拌器上攪拌20 min混勻,稀釋至適當的梯度之后,涂布于固體培養基上一定時間后計數,通過形成的菌落數計算出老面中的活菌密度。乳酸菌的計數采用MRS固體培養基,接種后平板置于37℃恒溫培養箱培養24 h。酵母菌計數采用孟加拉紅固體培養基,接種后置于30℃倒置恒溫培養48 h。
1.2.3 可溶性糖含量的測定方法。
1.2.3.1 色譜條件。色譜柱:Prevail Carbohydrate ES Columns(250 mm ×4.6 mm,5 μm);流動相:乙腈 - 水(體積比70∶30),使用前先經過 0.45 μm 濾膜過濾;流速:1.0 ml/min;柱溫:25℃;ELSD參數:漂移管溫度83.5℃,載氣流速2.2 L/min;進樣量:10 μl。
1.2.3.2 標準曲線的制作[11]。準確稱取(精確至 0.000 1 g)干燥至質量恒定的麥芽糖0.2 g,果糖、葡萄糖、蔗糖各0.05 g,分別用純凈水定容于50 ml容量瓶中。用自動進樣器分別注入1、3、5、7、10 μl 4 種糖的標準溶液,以質量濃度為橫坐標,峰面積為縱坐標,分別繪制標準溶液曲線,計算線性回歸方程。同時配制果糖、葡萄糖、蔗糖、麥芽糖的混合標準溶液,使各糖的質量濃度均約為1 mg/ml,進樣量10 μl作為標準品色譜圖。表1為標準回歸方程。
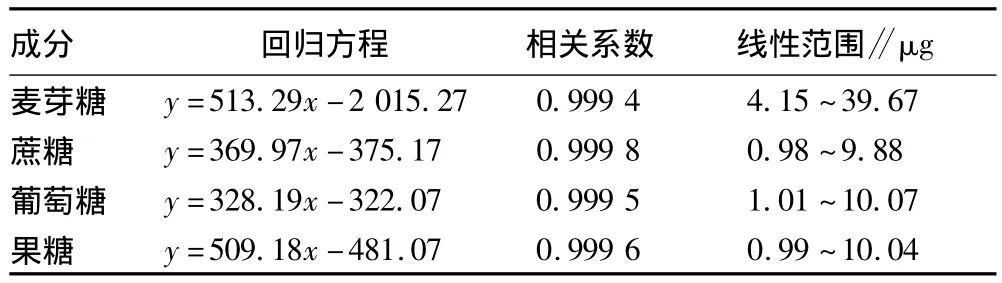
表1 標準回歸方程
1.2.3.3 樣品測定[11]。準確稱取樣品 25 g(精確至 0.000 1 g),置于100 ml容量瓶中,加水約50 ml,超聲提取20 min,慢慢加入質量分數50%三氯乙酸溶液5 ml,用蒸餾水定容至刻度、混勻,靜置30 min,用干燥濾紙過濾,棄去初濾液數毫升,濾液離心(8 000 r/min,20 min,4 ℃),經 0.22 μm 微孔濾膜過濾,待上機。
制備好的樣液10 μl注入高效液相色譜,在“1.2.3.1”測定條件下記錄果糖、葡萄糖、蔗糖、麥芽糖的峰面積,依據保留時間分別用外標法計算各組分的質量濃度,再計算樣品中各組分的含量。
1.2.4 游離氨基酸含量的測定方法。采用HPLC法,取1.000 0 g老面加入15 ml錐形瓶中,加入約5 ml 5%三氯乙酸并攪拌均勻,倒入25 ml容量瓶中,用約5 ml 5%三氯乙酸沖洗15 ml錐形瓶內部后倒入25 ml容量瓶中,重復一次,再將25 ml容量瓶用5%三氯乙酸定容至25 ml。靜置2 h,上清液用雙層濾紙過濾,取3~5 ml濾液,10 000 r/min 5℃離心15 min。然后用鄰苯二醛進行柱前衍生,然后使用HPLC進行游離氨基酸分析。
色譜條件:ODS Hypersil毛細管色譜柱(250 mm ×4.6 mm,5 μm),流動相為20 mmol/L乙酸鈉的甲醇-乙腈溶液(體積比為1∶2),流速 1.0 ml/min,柱溫 40 ℃,338 nm 紫外檢測。
2 結果與分析
2.1 老面發酵過程中乳酸菌和酵母菌數量的變化 將從老面中分離出的明登乳桿菌Z4、植物乳桿菌S1、戊糖片球菌S2、舊金山乳桿菌S8和短乳桿菌S9分別按照“1.2.1”的方法制作其與酵母菌共同發酵的老面團,對照組為不添加乳酸菌而只添加酵母菌的老面。按照“1.2.2”的方法測定6種老面在發酵過程中乳酸菌和酵母菌活菌數的變化情況。由圖1可知,對照組中乳酸菌起始菌落數只有不到103,其他5種添加了乳酸菌的老面起始菌落數相同,均為107,發酵前6 h乳酸菌的數量增加緩慢,隨后開始迅速增加,直到16 h之后增長速率開始放緩。在整個發酵過程中,明登乳桿菌的生長速度明顯快于其他乳酸菌,并且在發酵時間達到20 h之后數量還在繼續增加;植物乳桿菌、舊金山乳桿菌和短乳桿菌在前16 h的生長速度無明顯差異,16 h之后植物乳桿菌繼續快速生長,而舊金山乳桿菌和短乳桿菌的數量增長緩慢;戊糖片球菌在整個發酵過程中的生長速度最慢,但是在20 h之后戊糖片球菌的數量已經和舊金山乳桿菌、短乳桿菌沒有明顯差異。
圖2所示為酵母菌在添加6種老面中生長變化情況,添加了乳酸菌能夠促進老面中酵母菌的生長,發酵起始階段0~3 h的時候幾種老面中酵母菌的數量沒有明顯差別,3 h后酵母菌的數量變化則不相同。明登乳桿菌對于酵母菌生長的促進作用最為明顯,其次為植物乳桿菌,再次為舊金山乳桿菌和短乳桿菌,最次為戊糖片球菌,酵母菌數量的增加使得面團產期增加進而導致了饅頭的比容及質構的變化。但是當發酵時間達到15 h之后時,幾種老面中的酵母菌數量開始趨近于一致,這是由于一方面老面中營養物質的大量消耗導致酵母菌無法繼續大量增殖;另一方面,乳酸菌在后期數量的增加多于酵母菌使得更多的營養物質被乳酸菌利用。Hansen等證實了相對于異型發酵乳酸菌,酵母菌更加適應和同型發酵乳酸菌進行共同發酵[12],明登乳桿菌為同型發酵乳酸菌,植物乳桿菌為兼性異型發酵乳酸菌,舊金山乳桿菌和短乳桿菌為異型發酵乳酸菌,這4種乳酸菌的生長速度以及其對于酵母菌生長速度的促進作用的不同再次證明了Hansen等的研究成果。例外的是戊糖片球菌雖然是同型發酵乳酸菌,但是它和酵母菌的協同發酵作用卻是最弱的,這是因為戊糖片球菌的生長速率相對于乳酸桿菌較慢導致的。
2.2 不同乳酸菌發酵老面過程中可溶性糖含量的變化 將明登乳桿菌Z4、植物乳桿菌S1、戊糖片球菌S2、舊金山乳桿菌S8和短乳桿菌S9按照“1.2.1”的方法制作其與酵母菌共同發酵的老面團,對照組為不添加乳酸菌而只添加酵母菌的老面。按照“1.2.3”的方法測定6種老面在發酵過程中可溶性糖含量的變化情況。發酵過程中各糖濃度變化見圖3。如圖3(a)所示,前4 h主要由于酵母菌的快速生長,6種老面中麥芽糖濃度都快速消耗,隨后各樣品中麥芽糖的變化趨勢不同。僅接種酵母菌的老面,16 h后麥芽糖的濃度維持在較低水平;對接種了乳酸菌的老面,4~8 h麥芽糖濃度快速降低,到12 h時麥芽糖濃度降低到了最低水平,這是由于酵母菌和乳酸菌的協同發酵,使得酵母菌的生長速率加快,同時乳酸菌也在消耗面團中的麥芽糖。其中添加了明登乳桿菌和舊金山乳桿菌的老面中麥芽糖的濃度降低到了接近0的水平,明登乳桿菌和酵母菌有很好的協同發酵作用,菌的快速生長對于老面中的麥芽糖消耗非常快,舊金山乳桿菌與酵母菌的協同作用雖然弱于明登乳桿菌,但是它能夠產生麥芽糖磷酸化酶促進麥芽糖分解為葡萄糖[13],使得老面中的麥芽糖含量較低。但是不同的乳酸菌對于老面中酵母菌的代謝促進作用不一樣,使得它們的老面中麥芽糖的消耗速度存在差異。12 h之后,接種了乳酸菌的老面中麥芽糖的含量開始逐漸增加,這可能是因為發酵使得淀粉水解形成糊精、多肽等易溶于水的小分子量物質使得酶能夠更加充分地利用原料生成麥芽糖。從圖3(a)中可以看到,接種明登乳桿菌和植物乳桿菌的老面在發酵末期麥芽糖含量有所升高,這為這2種乳酸菌提供了充足的營養物質,使得它們在發酵末期還能夠繼續生長。
如圖3(b)所示,6種老面在發酵過程中蔗糖含量均逐漸減少,接種單一酵母菌的老面,蔗糖的濃度在整個發酵過程中菌高于其他老面;接種酵母菌和乳酸菌的樣品蔗糖的濃度降低也較快,約9 h被消耗殆盡。由此看出,乳酸菌影響酵母菌對蔗糖的代謝。接種乳酸菌的老面蔗糖的濃度較低,總體來看呈下降趨勢,可能由于多種原因所致。
由圖3(c)可知,除了添加舊金山乳桿菌的老面,其他樣品的葡萄糖變化情況與麥芽糖的變化趨勢基本相同。舊金山乳桿菌產生麥芽糖磷酸化酶能夠將麥芽糖分解為葡萄糖,這使得老面中麥芽糖的含量降低而葡萄糖的含量增加。接種不同菌種發酵老面團過程中,葡萄糖和麥芽糖濃度變化不同,這與菌種的代謝密切相關。
果糖以果葡聚糖形式存在面粉中,在所有谷物中的含量約為1% ~4%,能夠水解果聚糖β-果糖苷連接鍵的酵母酶(轉化酶和菊糖酶),受pH影響,在老面團中活性可能被增強。如圖3(d)所示,接種單一酵母菌的樣品,前幾個小時果糖的濃度有所增加,但隨后濃度不再明顯變化,約16 h已低于其他樣品;接種植物乳桿菌Z4的樣品,果糖濃度的變化波動較大,前12 h增加隨后的8 h內降低;另外2種老面在發酵過程中果糖濃度都在緩慢增加。
2.3 不同乳酸菌發酵老面過程中游離氨基酸含量的變化 游離氨基酸是饅頭風味物質的重要前提物質,將明登乳桿菌Z4、植物乳桿菌S1、戊糖片球菌S2、舊金山乳桿菌S8和短乳桿菌S9按照“1.2.1”的方法制作其與酵母菌共同發酵的老面團,對照組為不添加乳酸菌而只添加酵母菌的老面。應用“1.2.4”的方法測定老面發酵過程中FAA含量,結果如圖4所示。沒有添加乳酸菌的老面在發酵過程中游離氨基酸的含量持續下降,而添加了乳酸菌的老面在發酵初期FAA含量也是持續下降的,但是在8 h之后添加了明登乳桿菌、植物乳桿菌、舊金山乳桿菌和短乳桿菌的老面中FAA含量開始逐漸增加,12 h之后添加了戊糖片球菌的老面中FAA也開始迅速增加。老面發酵的酸化過程為面粉中的蛋白酶發揮最大活力提供了適宜條件,從而強化了蛋白降解。發酵初期乳酸菌的數量較少,面團的酸化程度較低,沒有充分發揮面粉中蛋白酶的作用,隨著發酵的進行,乳酸菌的增加使得pH下降,進而促進蛋白酶水解蛋白質使得FAA升高。戊糖片球菌產酸能力相對較弱使得老面中FAA的含量相對植物乳桿菌相對較少。添加舊金山乳桿菌和短乳桿菌的老面中FAA含量相對較高,這預示著這2種乳酸菌對于饅頭的風味很可能有著更加積極的作用。另外有研究者發現,戊糖片球菌的蛋白酶活性較弱[14],這可能也是其老面中FAA含量較低的一個原因。
3 結論
不同的乳酸菌與老面中的酵母菌的協同發酵作用強弱不同,其中同型發酵的明登乳桿菌效果最好,兼性異型發酵的植物乳桿菌次之,異型發酵的舊金山乳桿菌和短乳桿菌較弱,戊糖片球菌雖然是同型發酵,但是其生長緩慢導致協同發酵作用不明顯;乳酸菌在發酵初期會使得老面中的可溶性糖含量減少加快,發酵后期不添加乳酸菌的老面中的可溶性糖含量較低,但是乳酸菌會使得發酵后期可溶性糖含量增加,同時乳酸菌會增加發酵期間老面中游離氨基酸的含量;其中明登乳桿菌Z4對于可溶性糖的代謝促進最為明顯,戊糖片球菌S2的作為最弱,舊金山乳桿菌S8可以促進麥芽糖的減少從而增加葡萄糖的含量;舊金山乳桿菌和短乳桿菌則對于游離氨基酸含量增加的促進較為明顯。不同的乳酸菌對于老面中可溶性糖和游離氨基酸的代謝不同,這些變化會導致饅頭的質構和風味從而影響饅頭的品質。
[1]楊敬雨,劉長虹.中國傳統酵子的工業化[J].食品研究與開發,2007,28(2):164-166.
[2]DECOCK P,CAPPELLE S.Bread technology and sourdough technology[J].Trends in Food Science & Technology,2005,16:113 -120.
[3]GOBBETTI M,ANGELIS M,CORSETTI A.Biochemistry and physiology of sourdough lactic acid bacteria[J].Trends in Food Science & Technology,2005,16:57 -69.
[4]LEMKI S,FERRIS D.Production of sourdough frozen pizza and fresh focaccia using MIVAC spices and Herbs[N].CATI Publication,2001 -09 -04.
[5]SPICHER G.Preparation of stable sourdoughs and sourdough starters by drying and freeze drying[M]//KULP K,LORENZ K,BRüMMER J,et al.Frozen and refrigerated doughs and batters.St.Paul,MN:Am Assoc Cereal Chem,1995:53 -61.
[6]MARTINEZ-ANAYA M A.Enzymes and bread flavour[J].Journal of Agricultural and Food Chemistry,1996,44:2469 -2480.
[7]KIM Y,HUANG W,ZHU H,et al.Spontaneous sourdough processing of Chinese northern -style steamed breads and their volatile compounds[J].Food Chemistry,2009,114(2):685 -692.
[8]杜磊,喬發東,杜楊.乳酸菌濃縮發酵劑的研究意義[J].河南畜牧獸醫:綜合版,2007,28(2):13 -15.
[9]郭興華.益生乳酸細菌-分子生物學及生物技術[M].北京:科學出版社,2008:160 -162.
[10]G?NZLE M G,LOPONEN J,GOBBETTI M.Proteolysis in sourdough fermentations mechanisms and potential for improved bread quality[J].Trends in Food Science & Technology,2008,19(10):513 -521.
[11]劉玉峰,李黎,李東,等.高效液相色譜法測定食品中的單糖、雙糖[J].食品科學,2007,28(3):293 -296.
[12]HANSEN A,LUND B,LEWIS M J.Flavour of sourdough rye bread crumb[J].Lebensmittel Wissenschaft und Technologie,1989,22:141 -144.
[13]EHRMANN M A,VOGEL R F.Maltose metabolism ofLactobacillus sanfranciscensis:Cloning and heterologous expression ofthe key enzymes,maltose phosphorylase and phosphoglucomutase[J].FEMS Microbiology Letters,1998,169:81 -86.
[14]馬曉燕.牛肉發酵過程中優勢微生物的分離鑒定及應用研究[D].保定:河北農業大學,2004.

